EPO修饰增强Müller细胞对RCS大鼠视网膜变性的干预效果
李宗义 李鹏 高芙蓉 范氏雪幸 张敬法 王方 吕立夏 徐国彤
遗传性和老年性的视网膜变性疾病(degenerative retinal diseases,DRD)是目前全球性的重要致盲原因,严重影响着众多患者的生活。经过多年努力,尽管对个别类型DRD的认识和治疗有所进展,比如对年龄相关性黄斑变性(agerelated macular degeneration)中湿性AMD的抗血管内皮生长因子(vascular endothelial growth factor,VEGF)治疗取得初步效果[1-2],但对这类疾病来讲,不论是对干性AMD还是视网膜色素变性(retinitis pigmentosa,RP)或是其他类型的DRD,总体上还缺少有效的治疗方法[3-5]。现有治疗方法的研究主要集中在药物治疗、基因治疗以及与包括干细胞在内的细胞治疗等方法。
研究表明,多种神经营养因子有保护视网膜神经元存活的作用[6-8]。其中,促红细胞生成素(erythropoietin,EPO)对视网膜细胞的保护作用受到越来越多的重视。有研究表明,EPO具有血管保护作用[9-11]。本实验室的前期研究工作证明:在糖尿病大鼠玻璃体腔内注射hEPO,可以通过抗凋亡途径保护视网膜神经元、视网膜血管细胞以及视网膜色素上皮(retinal pigment epithelium,RPE)细胞[12-13],并且通过负反馈抑制低氧诱导因子-1alpha(Hypoxia-inducible factor 1-alpha,HIF-1α)的表达,从而降低VEGF、iNOS和内源性EPO的水平,进而减轻视网膜组织水肿而引起的视网膜血管和神经元损伤[14],改善患者视力。基于这些研究结果,笔者提出,EPO对视网膜神经元和血管的保护作用也可能会在AMD等视网膜变性疾病中有干预治疗效果。鉴于EPO的半衰期短,反复注射有引起视网膜脱离、出血、炎症反应等多种并发症的可能[15],笔者进一步采用腺相关病毒(adenoassociated virus,AAV)为载体携带EPO基因,在糖尿病大鼠中实验EPO基因治疗。结果显示,这种基因治疗能有效延长EPO的治疗效果,使EPO治疗视网膜疾病更为简单、安全[16]。
除分泌细胞因子外,细胞治疗的另一个目的和主要干预机制是利用供体细胞或其分化及转分化产生的细胞去取代或修复受损伤的视网膜神经元或其他细胞。在神经视网膜中,Müller细胞是视网膜中最主要的一种胶质细胞,在视网膜正常生理活动以及病理生理过程中发挥着重要作用。Müller细胞贯穿整个视网膜,与神经元及血管细胞广泛密切接触,并可分泌多种因子为视网膜提供营养物质并帮助视网膜排出代谢废物[17],为其作为细胞载体提供可能。同时,有研究表明,Müller细胞是神经视网膜组织中具有干性的细胞[14],在神经视网膜发育或损伤修复过程中有重要作用。
基于EPO保护视网膜细胞的作用和Müller细胞可能的干性及旁分泌功能,本研究利用RCS大鼠视网膜变性模型探讨两者结合使用时对视网膜变性的干预及其机制,旨在研发hEPO修饰的Müller(hEPO-Müller)细胞干预视网膜退行性病变的治疗方法。
材料与方法
一、材料
RCS大鼠:由同济大学动物饲养中心饲养并提供。胰蛋白酶、磷酸缓冲液(PBS)、细胞培养基及部分添加成分均购自Gibco/Invitrogen公司;TriZOL购自于Takara Bio公司;胎牛血清(FBS)及部分细胞培养添加成分购自Hyclone公司;ReverTra-Ace mRNA逆转录试剂盒购自TIANGEN公司;荧光封片剂Flurorescence Mounting Medium为DAKO公司产品;牛血清白蛋白(BSA)、多聚甲醛(PFA)、细胞核染料DAPI等均购自Sigma公司。细胞培养皿、孔板及15ml、50ml刻度塑料离心管购自BD/Corning公司。Anti-EPO、Anti-GFAP购自Abcam;Anti-Actin抗体为Sigma产品;Anti-Recoverin抗体购自Millipore公司。Taq酶购自天根生化科技(北京)有限公司。
二、方法
1.Müller细胞的培养和转染:大鼠Müller细胞系由Vijay Sarthy(Northwestern University,Evanston,IL)提供,在含10﹪FBS,1﹪青霉素-链霉素的DMEM高糖培养基中培养。用LipofectAMINETM 2000 分别将EPO-PPYCAGIP和GFP-PPYCAGTP转染正常培养的大鼠Müller细胞系。通过1 μg/ml嘌呤霉素筛选得到稳定表达GFP或hEPO的Müller细胞系。
2.RCS大鼠视网膜组织的体外培养:将出生后21d的RCS大鼠脱颈处死后,剥离获得视网膜组织并在不同条件下培养。实验分为五组,将视网膜组织分别与完全培养基、含Müller细胞裂解液的完全培养基、添加hEPO的完全培养基、Müller细胞及hEPO-Müller细胞培养/共培养,每两天更换一次细胞培养液。两周后收集视网膜组织,用4﹪PFA固定后进行包埋和切片。
3.细胞准备:单层培养,到细胞融合度达到80﹪时用0.25﹪胰酶消化细胞成单细胞后终止。经70 μm孔径细胞滤网(cell dtrainer,BD)过滤去除细胞团和杂质,计数后离心收集,以5×105cells/μl重悬于PBS。
4.细胞移植:将出生后21d RCS大鼠麻醉后,置于体式显微镜下,并在大鼠眼球上放置凹透镜;用30 gauge针头在角巩膜缘后2 mm处刺一个针孔,然后用装有33 gauge针头的微量注射器从针孔处进针至视网膜下腔,注入3μl(含3×105细胞)悬液。
5.冰冻切片免疫荧光染色分析:将细胞移植后不同时间的RCS大鼠脱颈处死并立即取出眼球置于4﹪多聚甲醛中固定,4℃放置1h。将眼球解剖获得视杯后用组织包埋剂OCT于4℃平衡1h,液氮中包埋并保存于-80℃。用冰冻切片机连续切8 μm厚的组织片,于室温用电风扇吹2~3 h后,用PBS洗去OCT后,加入0.25﹪ Triton X-100并置于室温透膜10min。用PBS洗去透膜液3次,每次5min。用3﹪ BSA/PBS于室温封闭切片30min。用封闭液稀释一抗至适当浓度,去除封闭液加一抗,4℃过夜。用PBS洗去一抗,洗3次,每次5min。加荧光二抗并置室温反应1h后,用PBS洗去二抗,洗3次,每次5min。以DAPI处理5min标记细胞核后,用封片剂封片。在荧光显微镜下观察并照相或置于4 ℃暗室中保存。
6.hEPO酶联免疫吸附测定(ELISA):将GFP-Müller和hEPO-Müller培养在6 cm细胞培养皿中。当细胞长至80﹪的融合度时,更换无血清培养基培养24 h并收集培养基。培养基中的hEPO的水平反应了细胞分泌的hEPO的量。根据试剂盒的说明书检测培养基中hEPO的浓度。
7.RT-PCR:视网膜组织经TriZOL(Takara Bio公司)抽提获得RNA,进一步经反转录酶(Takara Bio公司)反转成cDNA,用Taq酶进行相关基因表达检测。所用PCR引物序列见表1。
三、统计学分析方法
采用SigmaPlot 11.0统计软件进行分析。体外将视网膜组织分别与完全培养基、含Müller细胞裂解液的完全培养基、添加hEPO的完全培养基、Müller细胞及hEPO-Müller细胞培养/共培养两周后视网膜组织的内核层与外核层的厚度测量值表示为,且外核层与内核层平均厚度在不同处理条件下的比较采用t检验。以P < 0.05为差异有统计学意义。

表1 PCR引物序列
结 果
一、构建hEPO-Müller细胞和GFP-Müller细胞系
本研究应用的hEPO-Müller细胞系和作为对照和示踪的GFP-Müller细胞系均获成功。如图1所示,通过转染获得的GFP-Müller细胞呈绿色荧光阳性(图 1a,b),而 hEPO-Müller细胞为绿色荧光阴性(图1c,d)。RT-PCR和Western blot检测也证明GFP-Müller细胞表达GFP,不表达hEPO;hEPO-Müller细胞表达hEPO,不表达GFP(图2 a,b)。鉴于EPO是一种分泌蛋白,笔者也对细胞培养液进行EPO检测以进一步确定hEPO转染的结果。在两种细胞生长融合度达到80﹪左右,分别取培养1d后的培养液并利用ELISA检测hEPO含量。结果显示,hEPO-Müller细胞的培养液中的hEPO达到900 mIU/ml,而GFPMüller细胞培养液中未能检测到hEPO(图2c)。因此,本实验通过质粒转染的方法得到了稳定表达GFP和hEPO的Müller细胞系。

图1 GFP- Müller细胞系和hEPO-Müller细胞系的构建

图2 GFP- Müller细胞系和hEPO-Müller细胞系的鉴定
二、hEPO-Müller细胞对体外培养的RCS大鼠视网膜病变的干预作用
RCS大鼠的RPE细胞由于酪氨酸激酶受体Mertk基因突变而失去特异性识别并吞噬光感受器细胞脱落外节(Outsegment,OS)的功能,最终将导致光感受器细胞死亡[18],是广泛使用的视网膜变性的动物模型。为研究Müller细胞和hEPO-Müller细胞对视网膜变性的干预作用,笔者将RCS大鼠视网膜组织分离并在体外与hEPO或Müller细胞共培养。两周后,组织学检测5个实验组的视网膜组织的外核层(ONL)与内核层(INL)的平均厚度的统计结果表明,在作为对照组的完全培养基以及含有Müller细胞裂解液的完全培养基组,视网膜核层厚度明显变薄,其厚度分别为内核层(15.19±7.08)μm,外核层(13.87±8.60)μm 和内核层(15.94±1.77)μm,外核层(24.81±3.03)μm 的厚度。相比之下,hEPO、Müller细胞和hEPO-Müller细胞都能一定程度上保护视网膜核层的厚度,两核层的厚度分别在hEPO组为(23.03±3.29)μm,(33.92±7.59)μm ;Müller组为(24.81±2.02)μm,32.15±3.03 μm ;hEPO-Müller组为(32.40±8.35)μm,(40.25±3.29)μm(n=3);并以hEPO-Müller组厚度增加最为显著(P均 < 0.05,图 3)。
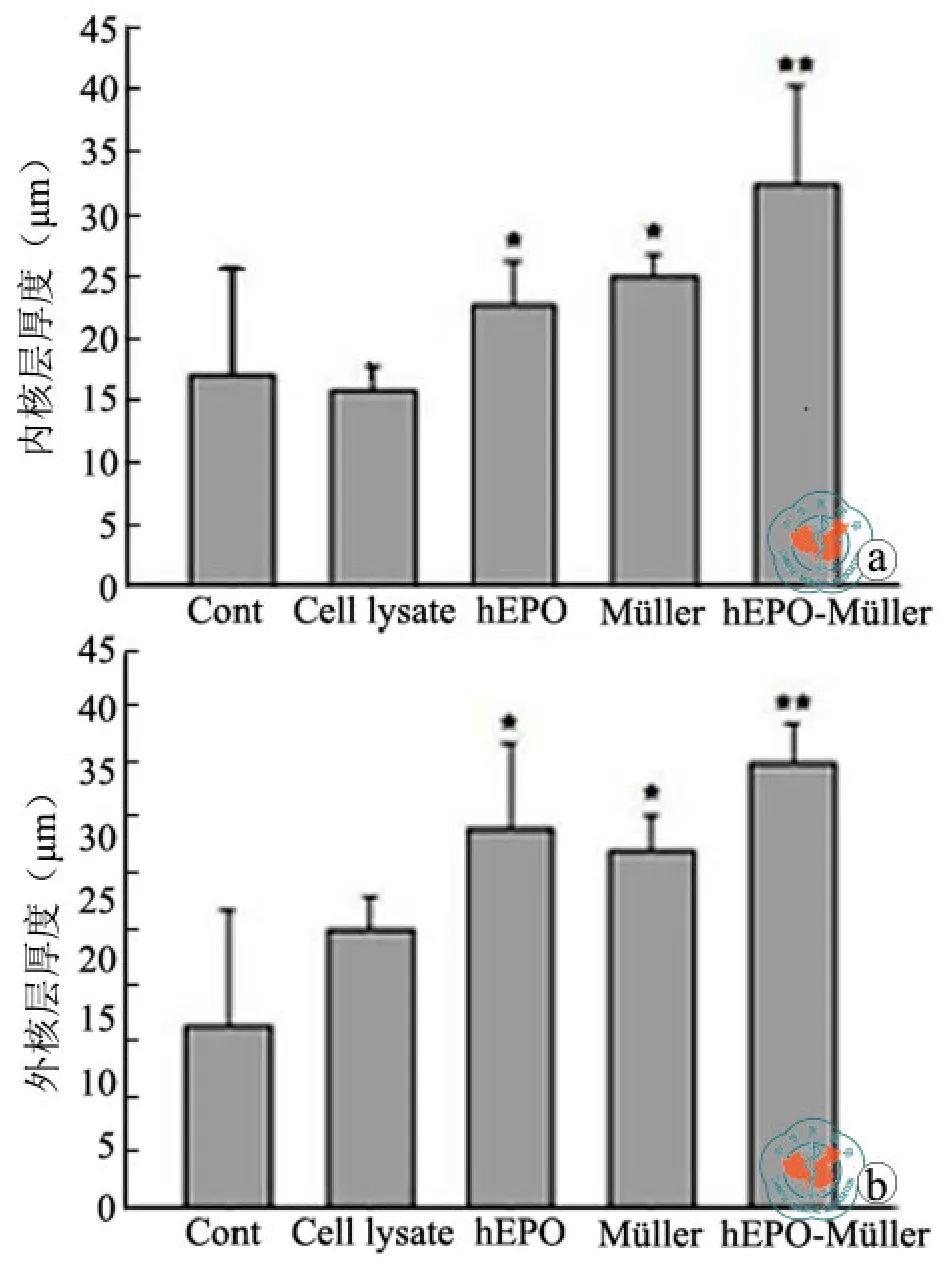
图3 不同条件下培养的RCS大鼠视网膜外核层(ONL)与内核层(INL)厚度的比较
三、hEPO-Müller细胞移植后在RCS大鼠视网膜下腔的存活情况

图4 RCS大鼠视网膜下腔移植GFP-Müller细胞和hEPO-Müller细胞操作示意图及移植确认
供体细胞移植后在受体组织中的存活是细胞治疗能获得成功的重要条件,本研究中将GFPMüller细胞和hEPO-Müller细胞注射到生后21d的RCS大鼠视网膜下腔(图4a)1d后,取眼球制备冰冻切片标本并染色检查时,可观察到呈现绿色荧光的GFP-Müller细胞堆积在视网膜下腔(图4b,c)。注射后2周和4周检查,视网膜下腔绿色荧光依旧存在。表明本实验构建的GFP-Müller细胞和hEPO-Müller细胞可以通过视网膜下腔注射的方法进行移植,并能在视网膜下腔中存活。
四、hEPO-Müller细胞视网膜下腔移植后未发生胶质化改变
应用Müller细胞治疗的主要风险是其胶质化改变,有报道说Müller细胞的胶质化会导致神经细胞的退行性改变,并且胶质化形成的瘢痕也会影响视网膜组织的修复[19]。因此,笔者检查移植后的Müller细胞的胶质化情况,以确定这些细胞是否适合用于细胞移植治疗。如图5所示,与未做处理或假处理的RCS大鼠视网膜相比,接受GFP-Müller细胞和hEPO-Müller细胞移植的大鼠视网膜的胶质化的标志基因GFAP和Vimentin的表达都没有明显变化,表明本实验中制备的GFP-Müller细胞和hEPO-Müller细胞移植后不会引起受体大鼠神经视网膜的胶质化。

图5 用RT-PCR检测接受不同处理的RCS大鼠视网膜的GFAP和Vimentin(Vim)表达

图6 免疫荧光染色检测不同细胞移植对RCS大鼠视网膜核层的保护
五、hEPO-Müller细胞对RCS大鼠视网膜退行性病变的干预效果
未接受任何干预处理的RCS大鼠,在出生后7周时,视网膜ONL只有1~2层细胞还存活(图6a)。在RCS大鼠出生后3周进行GFP-Müller细胞移植,四周后(即出生后第7周),外核层存活细胞约2~3层,提示即使单纯移植Müller细胞对视网膜变性也有一定延缓作用。在接受hEPOMüller细胞移植的大鼠,ONL中存活的细胞数目明显增加,大约形成5~6层(图6)。用免疫组化方法检测光感受器细胞标记物Recoverin时发现,尽管各组之间在视网膜厚度及核层数方面有明显差异,接受GFP-Müller细胞和hEPO-Müller细胞移植的大鼠ONL与对照组大鼠的ONL相同,Recoverin染色均为阳性(图7),表明细胞移植治疗组中较厚的视网膜厚度和较多的细胞层数是供体细胞保护了ONL的光感受器细胞的结果,而不是移植的供体细胞的堆积,即hEPO-Müller细胞移植可以更好地干预视网膜核层的退行性病变,保护视网膜外核层。
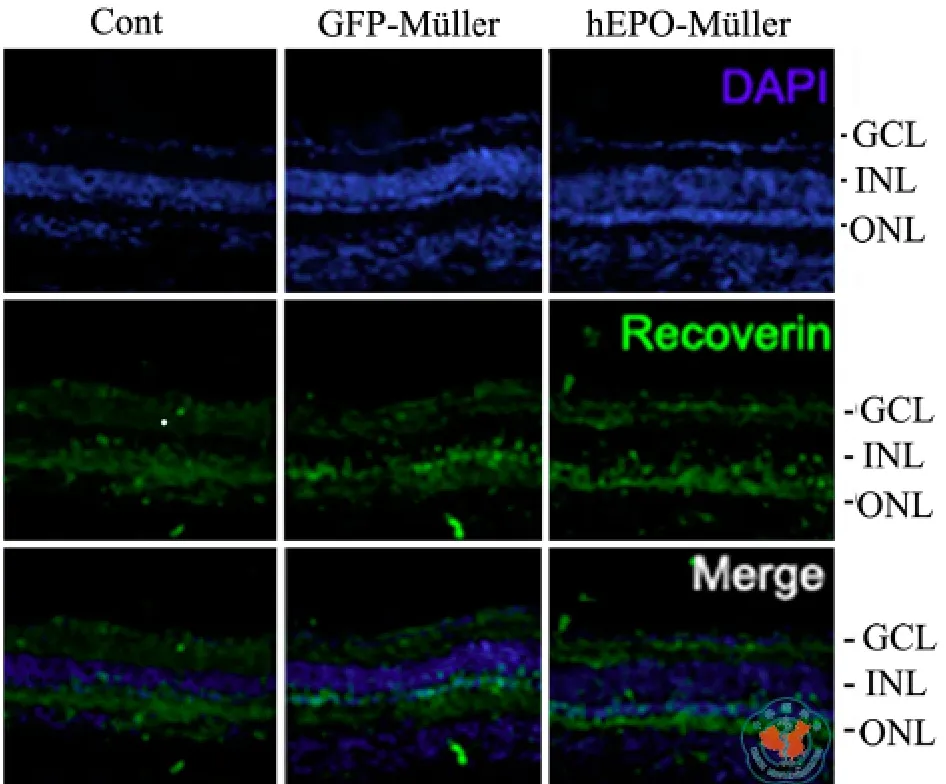
图7 免疫荧光染色法检测经不同细胞移植的RCS大鼠视网膜中Recoverin的表达情况
讨 论
作为视网膜变性疾病(DRD)的主要代表,年龄相关性黄斑变性(AMD),特别是干性AMD,是全球性重要致盲眼病之一。其发病机理尚不明确,也缺乏有效治疗方法,更是医学界的重要挑战。像多种视网膜疾病的最终表型一样,AMD发病到一定阶段,也表现出视网膜神经元的不可逆丧失。因此,大家对细胞移植治疗寄予厚望,旨在用移植的供体细胞修复或者取代受损伤的视网膜细胞。目前研究中的供体细胞有胚胎干细胞(embryonic stem cells,ESCs)、诱导多能干细胞(induced pluripotent stem cells,iPSCs)、间充质 干 细 胞(mesenchymal stem cells,MSCs),以及视网膜祖/干细胞,包括睫状体边缘区(ciliary marginal zone,CMZ)细胞、Müller胶质细胞及视网膜色素上皮细胞(RPE)等[20-21]。本研究选用Müller细胞作为供体细胞,结合hEPO进行基因修饰,旨在通过Müller与视网膜神经脊血管细胞广泛联系的特性,在细胞替代治疗理念基础上,把可分泌的细胞营养因子更广泛地输送到视网膜组织中。
在各种视网膜细胞中,Müller细胞在维持结构、支持视网膜细胞和参与代谢等多方面发挥着重要作用。与各类视网膜神经元相比,Müller细胞还具有更强的抵抗炎症、低氧和损伤的能力[17]。最近的研究表明,在成人的神经视网膜中分离出的Müller细胞,经过体外培养会得到表达Sox2、Nestin和CHX10等标记物的具备干性的Müller细胞[22]。因此,新的治疗策略可以利用Müller细胞进行细胞治疗或将Müller细胞转分化为需要修复的受损伤的视网膜神经元。此外,Müller细胞是视网膜中唯一贯穿整个视网膜并与视网膜神经元及血管细胞广泛密切接触的细胞,还具有分泌细胞因子及帮助视网膜排出代谢废物的功能[17]。用这种细胞作为载体表达某个或某些用于治疗的因子,有可能使治疗的作用影响到更大的区域。在本研究中,与对照组相比,RCS大鼠的视网膜组织在体外与hEPO、Müller细胞及hEPO-Müller细胞共培养后,视网膜组织的INL与ONL厚度都一定程度上得到保护,并以hEPO-Müller细胞的保护效果更为显著。这一现象在RCS大鼠体内实验中也得到了证实,表明Müller细胞对于视网膜退行性病变具有干预作用,而这种作用在移植同时表达EPO的Müller细胞时更为明显。
EPO,也称造血细胞因子,是一种多功能蛋白质。在胎儿阶段,主要产生于肝脏,而在成年人则主要有肾脏产生和分泌。在人的神经视网膜和中枢神经组织中都有EPO及其受体的表达[23]。近年来,越来越多的证据表明,EPO具有保护神经和血管的作用[8-10]。对视网膜神经节细胞的研究表明,EPO能剂量依赖地促进其神经生长并对其有保护作用。在视网膜退行性病变的模型中,通过检测光感受器细胞内节中EPO与EPO受体的相互作用,也证实全身使用EPO治疗可以保护视网膜光感受器细胞、对抗光诱导的细胞凋亡[24]。2008年,实验室首次证明了眼内注射EPO能在糖尿病大鼠模型中保护视网膜神经元和血管细胞,并保护大鼠的视功能[12]。在其后的研究中,笔者进一步阐明了EPO的作用机制[13]并在初步临床试验中证实了EPO的这一作用[25]。基于这些研究,笔者预期EPO能在保护RCS大鼠视网膜中发挥作用,并可能会通过Müller细胞的持续分泌而更为有效。本研究的结果与实验前的预期一致:在视网膜下腔移植治疗中,hEPO修饰的Müller细胞可以延缓RCS大鼠神经视网膜光感受器细胞的变性,并表现出比单纯EPO注射和单纯Müller细胞移植更强的治疗作用。此外,本研究中,移植到视网膜下腔的供体细胞,其胶质化标志蛋白GFAP和Vimentin的表达在细胞移植组和对照组中无明显差异,说明Müller移植不会促进视网膜的胶质化,为Müller细胞移植的安全性提供了一个侧面的依据。
综上所述,Müller细胞通过视网膜下腔注射可以减缓RCS大鼠视网膜退行性病变,经hEPO修饰Müller对视网膜变性有更好的干预作用,并且不会发生胶质化。因此,Müller可以作为一种细胞载体携带hEPO等营养因子用以治疗视网膜变性,为视网膜退行性疾病的治疗研究提供了一种新的方法。
1 Kovach JL,Schwartz SG,Flynn HJ,et al.Anti-VEGF Treatment Strategies for Wet AMD[J].J Ophthalmol,2012,2012:786870.
2 Campa C,Harding SP.Anti-VEGF compounds in the treatment of neovascular age related macular degeneration[J].Curr Drug Targets,2011,12(2):173-181.
3 Bessant DA,Ali RR,Bhattacharya SS.Molecular genetics and prospects for therapy of the inherited retinal dystrophies[J].Curr Opin Genet Dev,2001,11(3):307-316.
4 Xu L,Hu L,Ma K,et al.Prevalence of retinitis pigmentosa in urban and rural adult Chinese: The Beijing Eye Study[J].Eur J Ophthalmol,2006,16(6):865-866.
5 Sen P,Bhargava A,George R,et al.Prevalence of retinitis pigmentosa in south indian population aged above 40 years[J].Ophthalmic Epidemiol,2008,15(4):279-281.
6 LaVail MM,Yasumura D,Matthes MT,et al.Protection of mouse photoreceptors by survival factors in retinal degenerations[J].Invest Ophthalmol Vis Sci,1998,39(3):592-602.
7 Di Polo A,Aigner LJ,Dunn RJ,et al.Prolonged delivery of brain-derived neurotrophic factor by adenovirus-infected Muller cells temporarily rescues injured retinal ganglion cells[J].Proc Natl Acad Sci U S A,1998,95(7):3978-3983.
8 Cayouette M,Behn D,Sendtner M,et al.Intraocular gene transfer of ciliary neurotrophic factor prevents death and increases responsiveness of rod photoreceptors in the retinal degeneration slow mouse[J].J Neurosci,1998,18(22):9282-9293.
9 Chong ZZ,Kang JQ,Maiese K.Erythropoietin is a novel vascularprotectant through activation of Akt1 and mitochondrial modulation of cysteine proteases[J].Circulation,2002,106:2973-2979.
10 Ghezzi P,Brines M.Erythropoietin as an antiapoptotic,tissue-protective cytokine[J].Cell Death Differ.2004.11(suppl 1):S37-44.
11 Buemi M,Cavallaro E,Floccari F,et al.The pleiotropic effects oferythropoietin in the central nervous system[J].J Neuropathol ExpNeurol,2003,62(3):228 -236.
12 Zhang J,Wu Y,Jin Y,et al.Intravitreal injection of erythropoietin protects both retinal vascular and neuronal cells in early diabetes[J].Investigative Ophthalmology &Visual Science,2008,49(2):732-742.
13 Shen J,Wu Y,Xu JY,et al.ERK- and Akt-dependent neuroprotection by erythropoietin (EPO) against glyoxal-AGEs via modulation of Bcl-xL,Bax,and BAD[J].Invest Ophthalmol Vis Sci,2010,51(1):35-46.
14 Zhang J,Hu LM,Xu G,et al.Anti-VEGF effects of intravitreal erythropoietin in early diabetic retinopathy[J].Front Biosci (Elite Ed),2010,2:912-927.
15 Broxmeyer HE.Erythropoietin: multiple targets,actions,and modifying influences for biological and clinical considerationbiological and clinical consideratioin[J].J Exp Med,2013,210(2):205-208.
16 Xu H,Zhang L,Gu L,et al.Subretinal delivery of AAV2-mediated human erythropoietin gene is protective and safe in experimental diabetic retinopathy[J].Invest Ophthalmol Vis Sci,2014,55(3):1519-1530.
17 Bringmann A,Pannicke T,Grosche J,et al.Müller cells in the healthy and diseased retina[J].Prog Retin Eye Res,2006,25(4):397-424.
18 D'Cruz PM,Yasumura D,Weir J,et al.Mutation of the receptor tyrosine kinase gene Mertk in the retinal dystrophic RCS rat[J].Hum Mol Genet,2000,9(4):645-651.
19 Bringmann A,Iandiev I,Pannicke T,et al.Cellular signaling and factors involved in Muller cell gliosis:Neuroprotective and detrimental effects[J].Prog Retin Eye Res,2009,28(6): 423-451.
20 Baker PS,Brown GC.Stem-cell therapy in retinal disease[J].Curr Opin Ophthalmol,2009,20(3):175-181.
21 Siqueira RC.Stem cell therapy for retinal diseases:update[J].Stem Cell Res Ther,2011,2(6):50.
22 Fischer AJ,Reh TA.Müller glia are a potential source of neural regeneration in the postnatal chicken retina[J].Nature Neurosci,2001,4(3):247-252.
23 Juul SE,Yachnis AT,Christensen RD.Tissue distribution of erythropoietin and erythropoietin receptor in the developing human fetus[J].Early Hum Dev,1998,52(3):235-249.
24 Shah SS,Tsang SH,Mahajan VB.Erythropoetin receptor expression in the human diabetic retina[J].BMC ResNotes,2009,2:234.
25 Li W,Sinclair SH,Xu GT.Effects of intravitreal erythropoietin therapy for patients with chronic and progressive diabetic macular edema[J].Ophthalmic Surg Lasers Imaging,2010,41(1):18-25.

