OSMAC 策略及其在烟曲霉菌次级代谢产物研究中的应用
谢绵测,李先国,张大海
中国海洋大学化学化工学院,青岛 266100
微生物次级代谢产物的结构多样性赋予其广泛的生物活性,是药物先导化合物的重要来源[1],然而实验室传统单一的培养模式,使微生物中大量的合成基因簇[2]处于休眠状态,使大量的代谢途径不能被表达,导致次级代谢产物的数量较少,骨架结构也偏于单一[3],对微生物资源造成了极大的浪费。同时,由于研究的不断深入,使得天然微生物资源逐渐稀缺,发现结构新颖,高活性的新化合物难度越来越大。针对这些难点问题,研究人员开始尝试改变微生物的培养环境以刺激微生物做出不同的代谢反应。2002年,Zeeck 等[4]在前人的基础上归纳提出了单株菌多次级代谢产物(one strain-many compounds,OSMAC)策略,即OSMAC 策略。OSMAC 策略强调通过改变培养基成分、培养条件和添加酶抑制剂等干扰因素来刺激微生物,激活不同的合成基因簇,挖掘其产生不同次级代谢产物的能力,从而获得骨架新颖,活性高的新化合物。
烟曲霉菌(A.fumigatus)是自然界中最常见的陆生致病霉菌之一,能够产生多种真菌毒素类化合物,能引起人、畜和禽类的多种疾病,如肺曲霉病等。较早的学者多关注于A.fumigatus 代谢的真菌毒素及其致病机理和防治,而忽略了其对人类有益的方面。近年来随着开发海洋的热潮,多个课题组研究发现该菌株可以来源于海洋,并从其次级代谢产物中发现了多个具有抗肿瘤活性的化合物[5],这使得研究人员对A.fumigatus 次级代谢产物研究产生了极大的动力。随着OSMAC 策略的提出,研究人员尝试将其应用于烟曲霉次级代谢产物研究,大大提高了新化合物和活性化合物的发现几率。本文综述了以海洋来源A.fumigatus ZTF001 为研究对象,应用OSMAC 策略研究所取得的成果。
1 OSMAC 策略
1.1 培养基对微生物次级代谢产物的影响
1.1.1 C、N 源及C/N 比
碳源为菌体的生长繁殖提供能源和合成菌体所需的必要成分,也为次级代谢产物提供所需的碳素成分。不同的碳源在分子结构上有着显著的差异,微生物在生物转化过程中也会表现出差异性,常见的碳源有糖类、油脂、有机酸和低碳醇等。在特殊情况下(如碳源匮乏时),蛋白质水解的中间产物以及氨基酸等也能被微生物作为碳源使用。氮源主要用于提供合成细胞质和细胞中其他结构的原料,很少用作能量来源,且氮源消耗会导致培养环境中pH的变化。研究发现:C/N 比对菌体的生长繁殖以及次级代谢产物有极大的影响。碳源过多,易形成较低的pH,影响微生物生长;碳源不足则会引起微生物本体的衰老和自溶。氮源过多,会使菌体生长过旺,pH 偏高,不利次级代谢产物的积累;而氮源不足则时菌体繁殖量少,直接影响次级代谢产物的产量。
1.1.2 盐度和金属离子
盐度能影响微生物的生长量和次级代谢产物。盐度的高低直接决定体系渗透压的大小,而适当的渗透压是微生物正常生长的保障[6]。刘琳等[7]在乳酸菌发酵研究中发现,由于细胞壁的保护,低渗透压对微生物影响不大,但高渗透压易使细胞脱水而影响微生物的生化反应。Miller[8]和Masuma[9]等人在研究盐度对Aspergillus sp.、Penicillium sp.、Fusarium sp.、Cladosporium sp.等24 株海洋来源真菌的次级代谢产物及其抗菌活性影响时,发现盐度的适当增加有助于其次级代谢产物抗菌活性的提高。
金属离子与微生物的生理结构和功能息息相关,在生物化学反应中起到重要的作用(表1)。
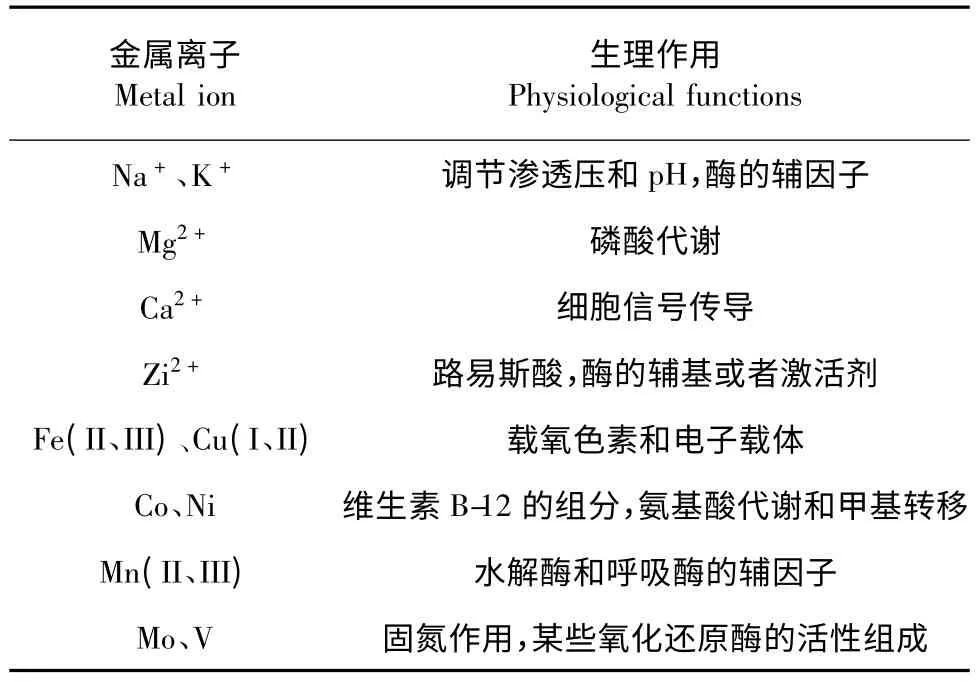
表1 常见金属离子的主要生理作用[10]Table 1 Common physiological functions of metal ion
多个研究小组通过改变或添加金属离子培养微生物而获得了一系列新型化合物。Priyani 等[11]仅把培养基中的自来水换成蒸馏水,内生真菌Paraphaeosphaeria quadriseptata 的代谢就发生根本性变化,主要次级代谢产物改变为cytosporones F-I(1~4)、quadriseptin A(5)和5'-hydroxymonocillin III(6)(图1)。而Wang WJ 等[12]将一定量的Mg2+加入到培养基中,从海洋来源真菌Ascotricha sp.ZJ-M-5 中获得了3 个结构新颖的石竹烯类化合物(7~9)(图1)。
1.1.3 培养体系中pH 值

图1 化合物1~9 的化学结构Fig.1 Structures of compounds 1-9
在微生物培养过程中,营养物质被分解利用和次级代谢产物的形成与积累,均会导致培养体系pH值发生变化,其不仅对各种酶活产生影响,还会影响膜表面电荷的性质及膜的通透性,改变菌体对基质的利用速率,从而影响菌的生长和产物的合成[13]。培养体系pH 的变化影响微生物的代谢过程,导致次级代谢产物的差异性,科研工作者利用微生物的这一特性,通过调节pH 获取目标产物的最佳产率。各类抗生素生物合成工业生产中,金霉素和四环素最佳pH 为5.9~6.3、青霉素为6.5~6.8、链霉素和红霉素为6.8~7.3。而阮复昌等[14]在研究Aspergillums niger 的次级代谢产物时发现,pH 2~2.5 时以合成柠檬酸为主;当pH 在2.5~6.5 时,以菌体生长为主,较少有次级代谢产物;而在pH 升至7.0时,则主要合成草酸。
1.2 培养条件对微生物次级代谢产物的影响
1.2.1 培养温度
微生物的自身生长和生物化学反应,均需要在其各自适宜的温度下进行。从酶反应动力学角度分析,温度升高,酶活性变大,反应速率加快,微生物生长代谢速率提升,产物生成提前,但温度越高,酶失活速率也越快,反而影响次级代谢产物的生成[15]。此外,温度还通过改变发酵液的理化性质(如溶解氧、基质传递速率、各营养成分的溶解度和吸收速率等)来间接影响次级代谢产物的合成、分泌和类型。以链霉菌发酵生产金霉素[16]为例,温度低于30 ℃时,该菌以合成金霉素为主,随着温度的提高,产物中四环素的比例不断增加,当温度升高到35 ℃时,则只产生四环素而无法合成金霉素。
1.2.2 培养状态
培养状态主要包括固态和液态、静态和动态,状态的不同也能直接影响微生物的代谢过程。相比于固态和静态培养,液态和动态培养不仅保证了菌体与营养成分的充分接触,还能通过供氧量的变化来影响菌株的生化反应,激活不同的功能基因簇而产生不同的次级代谢产物。菌株Chaetomium chiversil[11]在固态培养基中主要代谢产生radicicol(10)(图2),而在液态培养基中则主要代谢合成Chaetomium A(11)(图2)。
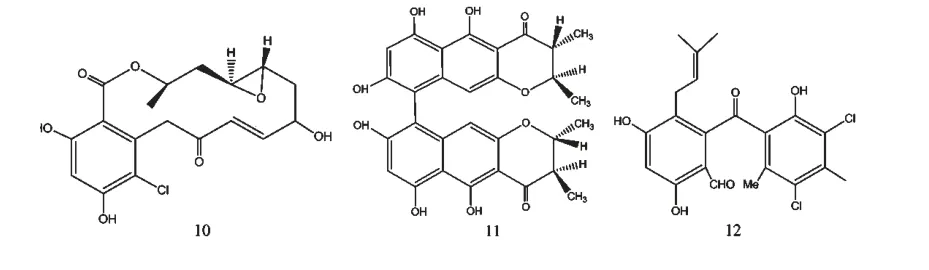
图2 化合物10~12 的化学结构Fig.2 Structures of compounds 10-12
1.2.3 培养时间
培养时间也是微生物生长发酵过程的重要因素之一,直接影响次级代谢产物的产量和质量。如果培养时间过短,微生物不能达到有效的生长量且影响次级代谢产物的产量;而培养时间太长,微生物则会因为培养基的营养不足或自身产生的毒素而逐渐凋亡[7],甚至有些次级代谢产物发生分解或异构化而影响次级代谢产物类型和产量。Kepler 等[17]研究乳酸菌转化亚油酸时发现,随着发酵时间的延长,部分共轭亚油酸能够进一步转化生成其他非目标物。
1.3 酶抑制剂对微生物次级代谢产物的影响
通过酶抑制剂的添加,选择性的抑制代谢途径中相关酶的活性,在抑制某些代谢途径的同时,促进其他通路相关代谢产物的合成[1]。例如在工业生产过程中,在酵母厌氧发酵时加入亚硫酸或碱类物质,能够抑制酒精发酵,从而转入甘油发酵。常用抗生素的生物合成过程中,常常通过添加抑制剂来控制产品的质量和产率,综合文献资料,常见抗生素所对应的酶抑制剂如表2。

表2 常见抗生素及其对应的酶抑制剂Table 2 Common antibiotics and their corresponding enzyme inhibitors
1.4 OSMAC 策略新思路
随着研究人员的不断探索和新型仪器分析技术的发展,OSMAC 策略研究提出了新的思路和方法,归纳为微生物的混合培养和基于基因组扫描技术(genome scanning)的高通量筛选。
微生物的混合培养能够发生协同或者拮抗作用,进而使微生物产生结构新颖、高活性的次级代谢产物,这是近年来OSMAC 策略在微生物次级代谢产物研究方面的新思路。统计发现,天然来源的抗生素多是由于微生物的生存环境受其它物种威胁而产生的一种化学防御武器,探索这种防御机制是寻找新抗生素的有效途径[18]。Clardy 等[19]在海洋真菌Pestalotia sp.CNL-365 和海洋细菌CNJ-328 混合培养的次级代谢产物中发现了新型抗生素pestlone(12)(图2),而分别单独培养时并未发现该化合物。
控制微生物次级代谢产物生物合成的功能基因通常成簇分布于其染色体的某一区域,根据基因-合成酶系-化合物的对应关系,通过筛选、测序、定位和表达该特定的生物合成基因簇,可以针对性地获得特定结构的次级代谢产物,从而充分发掘微生物次级代谢的潜力,为新药发现提供更多天然来源或其前驱体。Banskota 等[20]扫描了2 株链霉菌Streptomyces sp.Eco86 和 Streptomyces aculeolatus NRRL 18422 的基因序列,发现二者均含有编码I 型PKS和Baeyer-Villiger 单加氧酶的基因簇,将这2 株菌进行发酵研究,结合所预测化合物的MS 和UV 等理化数据,成功激活了这2 个基因簇,获得3 个结构类似的5-链烯基-3,3(2H)-呋喃酮类活性化合物E-837、E-492、E-975(13-15)(图3)。文孟良等[2]则归纳提出了利用基因扫描技术与OSMAC 策略相结合获得新化合物的平台模式:

图3 化合物13~15 的化学结构Fig.3 Structures of compounds 13-15

随着基因扫描技术的不断发展,与OSMAC 策略结合的力度也将不断地加大,将为更多结构新颖和高活性次级代谢产物的发现提供有力的支持。
2 OSMAC 策略下的烟曲霉代谢产物
本课题组从日本奄美大岛海葵中分离纯化出一株A.fumigatus ZTF001,采用YPG 培养基培养,主要得到化合物Pyripyropene A(16)(图4),一种稳定的啶南平衍生物,能选择性抑制ACAT2 的代谢酶,主要用于预防或治疗动脉硬化症,到目前为止仅能来源于微生物。根据OSMAC 策略,我们改变了培养基的组成,将YPG 培养基改为Malt 培养基,而其他培养条件不变(37 ℃,静置培养14 d),获得了7 个次级代谢产物(17~23)(图4),其中化合物17 和18 为新化合物(见文献[21])。相比于YPG 培养基,菌株在Malt 培养基上生长较为迅速,且外观上与YPG 培养时有较大差异,次级代谢产物类型和数量也相对较多。YPG 和Malt 培养基的差异主要在于C、N 源的来源不同,同时C/N 存在较大的差异,分别为富碳和富氮型培养基。C、N 源的差异性以及C/N 的不同能够刺激菌株做出不同的生化反应,表明该菌对培养基成分比较敏感,能够激活功能基因簇,进而产生不同的代谢途径,代谢出不同的次级代谢产物。

图4 化合物16~23 的化学结构Fig.4 Structures of compounds 16-23
近十几年来,研究人员通过培养基成分的调整和培养条件的变化来刺激A.fumigatus,先后提取分离次级代谢产物得到的新化合物33 个,具有活性的化合物31 个,具有新骨架结构化合物5 个(详见表3),证实了不同的培养基成分和培养条件对A.fumigatus 的代谢途径的确有着巨大重大的影响。

表3 OSMAC 策略下,A.fumigatus 次级代谢产物分布情况Table 3 The distribution of microbial secondary metabolites under OSMAC
3 结论
微生物生存环境的复杂多样性能够刺激其不同合成基因簇的表达,促使其次级代谢产物结构的多样性,而结构的多样性赋予了其活性的多样性。OSMAC 策略通过改变微生物的生存环境来刺激微生物,使其做出不同的生化反应,产生不同的次级代谢产物,能为新药的研制提供新的来源或其前驱体。以A.fumigatus 研究为例,对比不同培养条件下,该菌株次级代谢产物的差异性,印证了OSMAC 策略在菌株次级代谢产物研究中的可行性和潜在价值,并从中分离得到了2 个新化合物,虽然OSMAC 策略研究目前还存在一定的盲目性,但对已知的微生物的再培养和再开发不失为应对天然产物资源枯竭危机的新方法和思路。随着微生物基因组学的发展和代谢机制研究的深入,OSMAC 策略定将为微生物次级代谢产物的发展带来新的生机。
1 Wei HJ(韦洪娟),et al.OSMAC (One Strain Many Compounds)approach in the research of microbial metabolites-A review.Acta Microbiol Sin (微生物学报),2010,50:701-709.
2 Zhao Q(赵琪),et al.Studies on activating silent biosynthetic gene clusters to synthesize new natural products in microorganisms.World Clin Drugs (世界临床药物),2014,35:501-505.
3 Hewage RT,et al.One strain-many compounds (OSMAC)method for production of polyketides,azaphilones,and an isochromanone using the endophytic fungus Dothideomycete sp.Phytochem,2014,108:87-94.
4 Bode HB,et al.Big effects from small changes:Possible ways to explore nature's chemical diversity.ChemBioChem,2002,3:619-627.
5 Zhao WY(赵文英),et al.Studies on chemical constituents of secondary metabolites of marine-derived Aspergillus fumigatus (I):alkaloids.J Qingdao Univ Sci Technol,Sci Ed (青岛科技大学学报:自科版),2007,3:199-201.
6 Wei HJ(韦洪娟).OSMAC approach and application in the research of Marine-derived Fungi Spicaria elegans KLA03.Qingdao:Ocean University of China (中国海洋大学),PhD.2010.
7 Qi HW(祁宏伟),et al.Effects of different culture conditions on lactic acid bacteria fermentation metabolites of CLA.Anhui Agri Sci Bull (安徽农学通报),2011,21:38-40.
8 Miller JD,et al.Marine fungi of the Bay of Fundy VI:Growth and metabolites of Leptoshpaeria oraemaris,Sphaerulina oraemaris,Monodictys pelagica and Dendryphiella salina.Proc Nova Scot Inst Sci,1984,34.
9 Masuma R,et al.Effect of sea water concentration on hyphal growth and antimicrobial metabolite production in marine fungi.Mycoscience,2001,42:455-459.
10 Louro R,et al.Practical approaches to biological inorganic chemistry.Elsevier,2012.
11 Paranagama PA,et al.Uncovering biosynthetic potential of plant-associated fungi:Effect of culture conditions on metabolite production by Paraphaeosphaeria quadriseptata and Chaetomium chiversii.J Nat Prod,2007,70:1939-1945.
12 Wang WJ,et al.Caryophyllene sesquiterpenes from the Marine-Derived Fungus Ascotricha sp.ZJ-M-5 by the One Strain-Many Compounds Strategy.J Nat Prod,2014,77:1367-1371.
13 Shi TH(石天虹),et al.Influence factors and control of microbial fermentation.Poultry Sci (家禽科学),2005,2:45-48.
14 Ruan FC(阮复昌),et al.Control of temperature and pH value in the fermentation process.Mod Food Sci Technol (现代食品科技),1991,4:15-17.
15 Wang FZ,et al.Seven new prenylated indole diketopiperazine alkaloids from holothurian-derived fungus Aspergillus fumigatus.Tetrahedr Lett,2008,64:7986-7991.
16 Cui CB,et al.Novel mammalian cell cycle inhibitors,spirotryprostatins A and B,produced by Aspergillus fumigatus,which inhibit mammalian cell cycle at G2/M phase.Tetrahedr Lett,1996,52:12651-12666.
17 Kepler CR,et al.Intermediates and products of the biohydrogenation of linoleic acid by Butyrivibrio fibrisolvens.J Biol Chem,1966,241:1350-1354.
18 Burgess JG,et al.Microbial antagonism:a neglected avenue of natural products research.J Biotechnol,1999,70:27-32.
19 Cueto M,et al.Pestalone,a new antibiotic produced by amarine fungus in response to bacterial challenge.J Nat Prod,2001,64:1444-1446.
20 Zhang DH,et al.Two new indole alkaloids,2-(3,3-dimethylprop-1-ene)-costaclavine and 2-(3,3-dimethylprop-1-ene)-epicostaclavine,from the marine-derived fungus Aspergillus fumigatus.J Nat Med,2012,66:222-226.
21 Banskota AH,et al.Isolation and identification of three new 5-alkenyl-3,3(2H)-furanones from two Streptomyces species using a genomic screening approach.J Antibiot,2006,59:168-176.
22 Han XX(韩小贤),et al.Alkaloidal compounds produced by a marine-derived fungus,Aspergillus fumigatus H1-04,and their antitumor activities.Chin J Med Chem (中国药物化学杂志),2007,17:232-237.
23 Wang FZ (王发左).Studies on the antitumor constituents and biotransformation of secondary metabolites produced by marine-derived fungi.Qingdao:Ocean University of China(中国海洋大学),PhD.2008.
24 Cui CB,et al.Novel mammalian cell cycle inhibitors,tryprostatins A,B and other diketopiperazines produced by Aspergillus fumigatus.I.Taxonomy,fermentation,isolation and biological properties.J Antibiot,1996,49:527-533.
25 Numata A,et al.Fumiquinazolines,novel metabolites of a fungus isolated from a saltfish.Tetrahedr Lett,1992,33:1621-1624.
26 Takahashi C,et al.Fumiquinazolines A-G,novel metabolites of a fungus separated from a Pseudolabrus marine fish.J Chem Soc,1995,18:2345-2353.
27 Yamamoto Y,et al.Studies on the metabolic products of Aspergillus fumigatus (J-4)Chemical structure of metabolic products.Chem Pharm Bull,1968,16:304-310.
28 Li XJ,et al.Metabolites from Aspergillus fumigatus,an endophytic fungus associated with Melia azedarach,and their antifungal,antifeedant,and toxic activities.J Agric Food Chem,2012,60:3424-3431.
29 Ye BP(叶波平),et al.Study on rhizosphere soil of Rhizophora stylosa of Aspergillus fumigatus F3 and its active metabolites.Hainan haikou China (中国海南海口),2008.
30 Alcazar FL,et al.Ergosterol biosynthesis pathway in Aspergillus fumigatus.Steroids,2008,73:339-347.
31 Nieminen SM,et al.Genotoxicity of gliotoxin,a secondary metabolite of Aspergillus fumigatus,in a battery of short-term test systems.Mutat Res,2002,520:161-170.

