颈动脉内膜剥脱术和颈动脉支架的疗效分析
陈宇,刘昌伟,刘志丽,吴巍巍,曾嵘,宋小军,刘暴
颈动脉内膜剥脱术(carotid endarterectomy,CEA)和颈动脉支架置入术(carotid artery stenting,CAS)都是治疗动脉硬化性颈动脉狭窄、预防缺血性卒中的重要方法。关于CEA与CAS对颈动脉狭窄的疗效和安全性的比较一直是学术界关注和争论的热点。本研究回顾分析了2010年1月-2014年12月北京协和医院血管外科收治的颈动脉狭窄患者,对比分析两种治疗方式的疗效和特点。
1 对象与方法
1.1 研究对象 回顾性分析2010年1月-2014年12月在北京协和医院血管外科收治并完成术后1年随访的572例颈动脉狭窄患者的临床资料,按照治疗方法分为CEA组和CAS组。所有患者均经颈动脉超声、经颅多普勒超声(transcranial Doppler,TCD)、计算机断层扫描血管造影术(computed tomographic angiography,CTA)和(或)数字减影血管造影(digital subtraction angiography,DSA)确诊。颈动脉狭窄率判断标准参照北美症状性颈动脉内膜剥脱试验(North American Symptomatic Carotid Endarterectomy Trial,NASCET)的标准[1]。
1.2 方法 CEA组术前均给予口服阿司匹林(100 mg,qd)至少1周。手术均在全身麻醉下进行,采用胸锁乳突肌前缘斜切口,牵开胸锁乳突肌显露颈动脉鞘,游离显露颈总动脉、颈内动脉及颈外动脉,注意保护迷走神经、舌下神经、喉上神经等。全身肝素化后,先后阻断颈内动脉、颈外动脉及颈总动脉。根据术中情况决定是否放置转流管。沿颈总动脉做纵向切口并延至颈内动脉病变段以远,完整剥除增生的颈动脉内膜及斑块,清除剥离面碎片和浮动内膜,取PTFE或Dacron人工血管补片,修剪成合适形状,用血管缝线连续缝合修补血管壁。修补完成后依次开放颈外动脉、颈总动脉及颈内动脉,确切止血后放置伤口内引流管,逐层缝合切口。术后给予每日口服阿司匹林100 mg。
CAS组术前每日口服拜阿司匹林(100 mg,qd)及氯吡格雷(75 mg,qd)至少1周。术前2 h开始预防性静脉应用血管解痉药物(尼莫地平)。手术采用局部麻醉,Seldinger法穿刺股动脉,全身肝素化后,超选治疗侧颈动脉,行全脑血管造影,选择合适的角度使颈内、颈外动脉分叉完全展开,评价病变段血管狭窄率及狭窄段长度,选择合适的脑保护装置置入病变段远端的颈内动脉,距离病变部位2 cm以上。选择合适的球囊进行预扩张,然后在病变段置入合适的支架,根据术中情况决定是否给予后扩张。回收脑保护装置,并再次行颈动脉造影及全脑血管造影,与术前对比。手术完毕常规缝合器封闭穿刺点。术后继续每日口服拜阿司匹林100 mg及氯吡格雷75 mg半年,根据复查结果调整用药。
分别统计两组性别、年龄、伴随疾病、颈动脉狭窄程度、是否症状性狭窄及是否合并对侧病变等临床基线资料。其中伴随疾病包括高血压、冠状动脉粥样硬化性心脏病、糖尿病、高脂血症、吸烟史和高同型半胱氨酸(homocysteine,HCY)血症。高血压、冠状动脉粥样硬化性心脏病、糖尿病、高脂血症病史定义为既往明确诊断或目前正在服用相应药物;吸烟史定义为既往曾吸烟及目前正在吸烟;高HCY定义为入院检查血清HCY高于正常高限(>15 μmol/L)。
分别统计两组术后30 d内并发症及不良反应,包括手术伤口及穿刺点情况,术后30 d内出现的手术相关死亡、缺血性卒中、急性心肌梗死、移植物感染、颅外神经损伤、脑过度灌注综合征(cerebral hyperperfusion syndrome,CHS)及持续低血压等。其中,缺血性卒中诊断参照世界卫生组织标准[2],急性心肌梗死定义为至少具备下列3条标准中的2条:①缺血性胸痛的临床病史;②心电图的动态演变;③心肌坏死的血清心肌标志物浓度的动态改变[3]。诊断CHS需同时符合以下3个条件:①颈动脉干预术后发生严重头痛、癫痫、意识障碍和(或)发展为局灶性神经症状如幻视、运动障碍等;②TCD监测术后大脑中动脉流速增加>100%;③除外任何脑缺血病灶[4]。持续低血压定义为收缩压<90 mmHg或平均动脉压<50 mmHg或者必须用血管活性药物维持时间超过6 h[5]。
1.3 术后随访 患者分别在出院后30 d、3个月、6个月和12个月,以及其后每年进行门诊或经电话随访。本研究统计出院后1年的随访资料。内容包括神经系统症状、彩色多普勒超声或CTA等检查资料,明确手术部位术后再狭窄情况。术后再狭窄定义为手术侧颈动脉超声或CTA提示血管狭窄≥50%;重度狭窄定义为手术侧颈动脉超声或CTA提示血管狭窄>70%。
1.4 统计学处理 用SPSS 19.0统计软件统计分析,计量资料符合正态分布,以表示,组间比较采用t检验;计数资料用率表示,比较采用卡方检验。以P<0.05为差异有统计学意义。
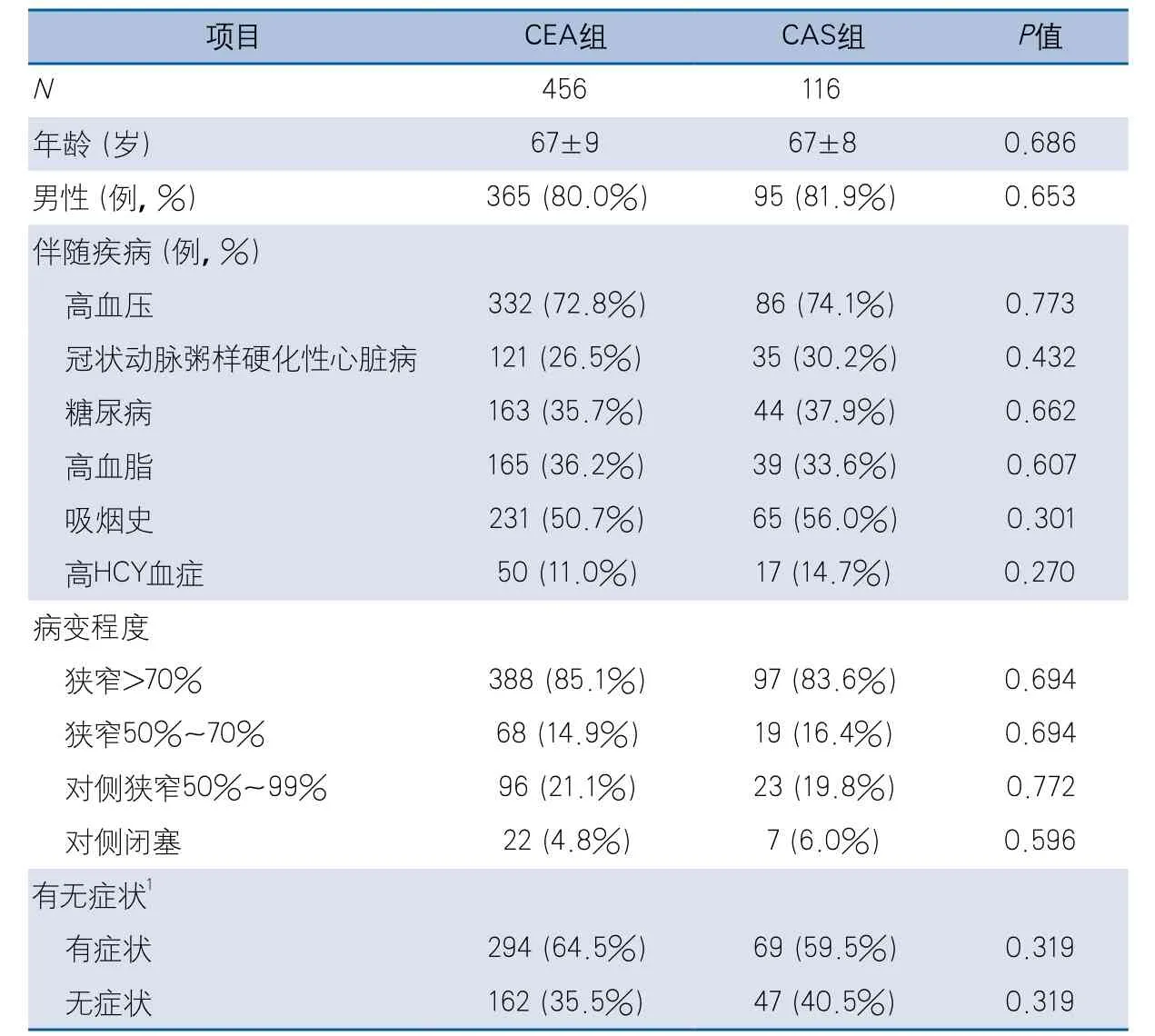
表1 CEA组和CAS组患者一般情况比较
2 结果
2.1 一般资料 2010年1月-2014年12月,北京协和医院血管外科共收治颈动脉狭窄并至少完成1年随访的患者572例,其中456例行CEA,116例行CAS。两组患者在年龄、性别比和伴随疾病(高血压、冠状动脉粥样硬化性心脏病、糖尿病、高血脂、吸烟史和高同型半胱氨酸血症)等方面均无显著差异;在颈动脉狭窄程度和有无临床症状方面也无显著差异(表1)。
2.2 CEA组和CAS组术后30 d内并发症及不良反应 所有患者均顺利完成手术。CEA组术后出现5例(1.1%)缺血性卒中,其中1例麻醉苏醒后意识障碍,立即行颈动脉造影显示补片远端颈内动脉夹层,再次给予颈动脉支架置入后神志逐渐恢复,未遗留明显后遗症;余4例均在麻醉清醒后出现肢体无力症状,均给予保守治疗,2例遗留一侧下肢肌力下降,2例遗留一侧肢体偏瘫。3例(0.7%)急性心肌梗死,分别发生在术后6 h、1 d及3 d,1例行急诊冠状动脉支架置入术、2例给予保守治疗,症状均逐渐缓解。5例颅外神经损伤(1.1%),其中3例舌下神经损伤,2例喉上神经损伤。2例(0.4%)伤口血肿形成,予术后第二天手术清除血肿。2例(0.4%)术后1周发现补片感染,予人工补片取出、大隐静脉补片修补、伤口清创。26例(5.7%)术后CHS,发生于术后1~6 d,其中1例脑出血术后6 d死亡,剩余25例给予严格控制血压、20%甘露醇降颅压后缓解。5例(1.1%)术后即出现持续低血压、窦性心动过缓,予多巴胺静脉泵入维持血压及心率,1~5 d后血压、心率恢复术前水平。
CAS组术中出现2例(1.7%)缺血性卒中,均遗留一侧肢体偏瘫。2例(1.7%)急性心肌梗死,分别发生在术后12 h及术后1 d。1例转心内科行冠状动脉支架置入、1例对症治疗,均缓解。1例(0.8%)穿刺点血肿,给予保守治疗,未发生穿刺点假性动脉瘤及动静脉瘘。4例(3.4%)术后CHS,发生于术后1~7 d,给予严格控制血压、20%甘露醇降颅压后缓解。15例(12.9%)术后即出现持续低血压、窦性心动过缓,给予多巴胺静脉泵入维持血压及心率,1~7 d后血压、心率恢复术前水平。
两组术后手术相关死亡率,神经系统并发症、心脏和局部并发症、CHS发生率均无显著差异;CAS术后持续低血压发生率显著高于CEA组(表2)。
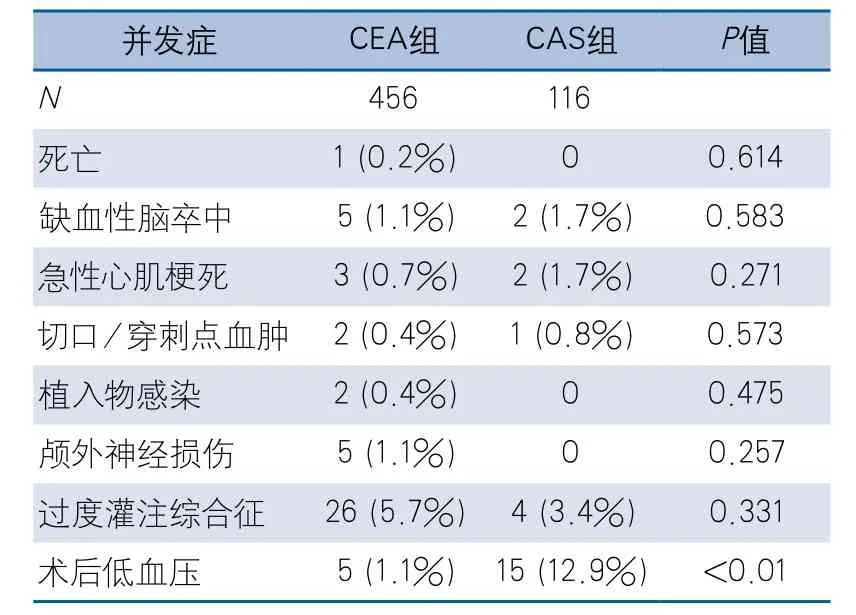
表2 CEA组和CAS组术后30 d内并发症及不良反应
2.3 CEA组和CAS组1年随访情况 本研究所有患者都完成至少1年随访,并在术后3个月、6个月、1年完成颈动脉超声或CTA检查。CEA组术后1年内出现术侧颈动脉再狭窄12例,其中中度狭窄7例,重度狭窄5例;出现术侧缺血性卒中2例。CAS组术后1年内出现颈动脉支架内再狭窄8例,其中中度狭窄5例,重度狭窄3例;出现术侧缺血性卒中1例(表3)。CAS组总体再狭窄率显著高于CEA组,但重度狭窄率及术侧缺血性卒中发生率没有显著性差异。
3 讨论
颈动脉狭窄是导致缺血性卒中的重要原因,据统计20%~25%的缺血性卒中是由颈动脉狭窄引起[6]。CEA作为预防卒中的有效治疗方式始于20世纪50年代,目前已成为治疗颈动脉狭窄的“金标准”。而CAS作为一种微创治疗方法应用也日益广泛。近年来随着比较CEA及CAS的多中心随机对照试验结果的相继发布,CAS的安全性及预防卒中的有效性越来越得到学界的认可。然而关于CEA和CAS孰优孰劣的话题并没有停歇,各个试验的结论也不尽相同。国际颈动脉支架研究(International Carotid Stenting Study,ICSS)试验数据显示,颈动脉狭窄适合手术治疗的患者仍应首选CEA[7],而颈动脉内膜切除术与支架置入术的对比试验研究(the Carotid Revascularization Endarterectomy versus Stenting Trial,CREST)试验数据则显示CAS与CEA有相似的短期及长期疗效[8]。
本研究结果表明CEA组和CAS组在围术期死亡、缺血性卒中、心肌梗死、伤口血肿等手术安全性指标上没有显著性差异。CEA组出现了2例补片感染、5例颅外神经损伤,但与CAS组相比同样没有显著性差异。
CHS是颈动脉狭窄再通术后的严重并发症。可能的发病机制是长期颈动脉狭窄、颅内灌注相对不足导致血管自我调节机制受损。当狭窄血管被开通之后,过高的血压增加脑灌注压,破坏了原已受损的脑血管屏障,引起液体渗漏至组织间隙产生脑水肿,甚至导致血管破裂,从而引起CHS[9]。文献统计CAS术后CHS发生率为1.16%(0.44%~11.7%),CEA术后CHS发生率为1.9%(0.4%~14%)[10],CEA术后CHS的发病率略高于CAS。本研究中CEA和CAS术后CHS发生率分别为5.7%和3.4%,两者相比没有显著性差异。
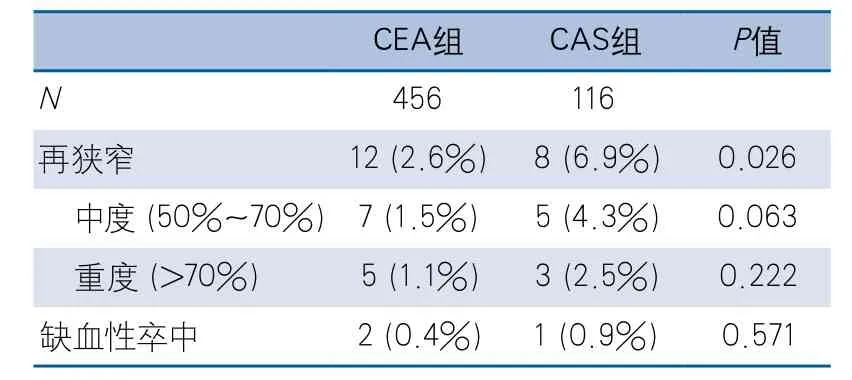
表3 CEA组和CAS组1年随访情况
接受CEA或CAS的患者,术后不但可能出现CHS,还可能出现持续低血压。本研究显示CAS术后出现持续性低血压的情况更多见,这可能是因为CAS在球囊扩张、支架置入等机械性扩张调整了颈动脉壁的顺应性,改变了颈动脉窦的敏感性,从而导致患者心率减慢和血压下降[11]。既往研究认为动脉狭窄靠近分叉、偏心性狭窄和伴有钙化斑是术后低血压的易发因素[12]。这种低血流动力学状态下的低灌注可能导致脑循环缺血产生短暂性或永久性神经系统损伤症状,诱发卒中及心脏事件,因此积极预防及治疗低血流动力学状态具有重要意义。手术过程中,术者应对狭窄血管及邻近正常血管影像进行精确的测量,从而能够选择适合尺寸的扩张球囊及支架,避免由于球囊及支架型号选择不当而过度刺激颈动脉窦。球囊扩张前如心率低于80次/分,则给予阿托品0.5~1 mg,使心率在80次/分以上再开始扩张;术中缓慢扩张球囊,如患者心率、血压有变化则迅速释放球囊。一旦出现持续低血压,立即给予多巴胺、多巴酚丁胺等肾上腺素受体激动剂并给予积极扩容,通常1周内能够恢复。本组病例中在发生严重低血流动力学状态时患者常表现不同程度的神经系统症状,如头晕、视物模糊和反应低下等,经药物治疗使血压和心率改善后症状明显缓解,未发生永久性神经功能损伤。
早期文献认为相对于CEA,CAS患者术后发生重度再狭窄(>70%)或闭塞的概率较大,Bonati等报道CAS 5年内发生再狭窄的概率是CEA的3倍[13]。但是近年来很多文献认为CEA与CAS术后再狭窄或闭塞的概率相当[14]。本研究随访数据显示,CEA组及CAS组术后1年发生治疗侧颈动脉重度狭窄(>70%)及再发卒中无显著性差异,但如果把再狭窄程度扩展到中度以上(>50%),则CAS组要显著高于CEA组。这可能是因为行CAS过程中,为了避免过度刺激颈动脉窦,避免支架对斑块产生切割效应,并没有给予支架充分球囊后扩张,部分病例仍存在10%~30%的残余狭窄,从而使得CAS术后中度狭窄概率增加。这种残余狭窄对CAS术后通畅率的远期影响,还需要更长时间的随访研究。
综上所述,本研究进一步证实CEA和CAS均能够安全有效地治疗严重颈动脉狭窄,需要注意的是CAS更容易引起术后持续低血压,更容易出现中度以上的再狭窄。但本研究是单中心回顾性结果,且仅有1年的随访数据,仍有待于大样本、多中心、随机研究结果的证实。
1 North American Symptomatic Carotid Endarterectomy Trial Collaborators. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis[J]. N Engl J Med,1991,325:445-453.
2 World Health Organization. Recommendations on stroke prevention,diagnosis,and therapy.Report of the WHO Task Force on Stroke and other Cerebrovascular Disorders[J]. Stroke,1989,20:1407-1431.
3 中华医学会心血管疾病分会. 急性心肌梗死诊断和治疗指南[J]. 中华心血管病杂志,2001,29:705-720.
4 Ogasawara K,Sakai N,Kuroiwa T,et al. Intracranial hemorrhage associated with cerebral hyperperfusion syndrome following carotid endarterectomy and carotid artery stenting:retrospective review of 4494 patients[J]. J Neurosurg,2007,107:1130-1136.
5 Susan MT,Rabih AC,Stephanie CL. Analysis of parameters associated with hypotension requiring vasopressor support after carotid angioplasty and stenting[J]. J Vasc Surg,2005,12:714-715.
6 Mozaffarian D,Benjamin EJ,Go AS,et al. Heart disease and stroke statistics--2015 update:a report from the American Heart Association[J]. Circulation,2015,131:e29-322.
7 Ederle J,Dobson J,Featherstone RL,et al. Carotid artery stenting compared with endarterectomy in patients with symptomatic carotid stenosis(International Carotid Stenting Study):an interim analysis of a randomised controlled trial[J]. Lancet,2010,375:985-997.
8 Timaran CH,Mantese VA,Malas M,et al. Differential outcomes of carotid stenting and endarterectomy performed exclusively by vascular surgeons in the Carotid Revascularization Endarterectomy versus Stenting Trial (CREST)[J]. J Vasc Surg,2013,57:303-308.
9 Lieb M,Shah U,Hines GL. Cerebral hyperperfusion syndrome after carotid intervention:a review[J].Cardiol Rev,2012,20:84-89.
10 Moulakakis KG,Mylonas SN,Sfyroeras GS,et al. Hyperperfusion syndrome after carotid revascularization[J]. J Vasc Surg,2009,49:1060-1068.
11 Mylonas SN,Moulakakis KG,Antonopoulos CN,et al. Carotid artery stenting-induced hemodynamic instability[J]. J Endovasc Ther,2013,20:48-60.
12 Borhani Haghighi A,Kokabi S,Yousefi S,et al. The prevalence and factors contributing to hemodynamic depression in patients undergoing carotid angioplasty and stenting[J]. J VascInterv Neurol,2015,8:5-10.
13 Bonati LH,Ederle J,Mc Cabe DJ,et al. Longterm risk of carotid restenosis in patients randomly assigned to endovascular treatment or endarterectomy in the Carotid and Vertebral Artery Transluminal Angioplasty Study (CAVATAS):long-term follow-up of a randomised trial[J]. Lancet Neurol,2009,8:908-917.
14 Lal BK,Beach KW,Roubin GS,et al. Restenosis after carotid artery stenting and endarterectomy:a secondary analysis of CREST,a randomized controlled trial[J]. Lancet Neurol,2012,11:755-763.

