阻塞性睡眠呼吸暂停低通气综合征与眼病
侯 乐,谢立科,曲进锋,郝晓凤,祁怡馨
·个案报告·
阻塞性睡眠呼吸暂停低通气综合征与眼病
侯 乐1,谢立科1,曲进锋2,郝晓凤1,祁怡馨1
阻塞性睡眠呼吸暂停低通气综合征;眼病
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)是指在睡眠状态下,由于上呼吸道狭窄或阻塞引起的睡眠中断,进而出现夜间睡眠障碍、白天嗜睡、长期疲劳、认知能力下降等一系列症状的临床综合征。其在成年人群中的发病率为2%~5%[1]。男性的发病率高于女性,分别为4%和2%[2]。在糖尿病、高血压患者中发病率则更高,为30%~40%[3]。国内外研究发现,OSAHS与众多眼部疾病有关,包括眼睑松弛综合征(floppy eyelid syndrome,FES)、青光眼、视盘水肿、视网膜静脉阻塞(retinal vein occlusion,RVO)、中心性浆液性脉络膜视网膜病变(central serous chorioretinopathy,CSC)等[4]。本文报道了1例OSAHS合并视网膜中央静脉阻塞患者,并对与OSAHS有关的眼病进行了文献回顾,具体如下。
患者男性,28岁,主诉“双眼视力下降1个月”,于2013年9月5日就诊于北大人民医院门诊。体格检查:体质量115 kg,身高176 cm,身体质量指数(BMI):37.12 kg/m2,血压140/108 mm Hg(1 mm Hg= 0.133 kPa),余(-)。眼科检查:视力右眼0.2,左眼0.1;眼压双眼14 mm Hg;双眼前节(-),视盘充血,边界模糊,视网膜静脉血管迂曲扩张,动脉狭窄。视网膜水肿,可见火焰状出血,黄斑水肿。光学相干断层扫描(OCT)示:双眼黄斑区神经上皮脱离,黄斑水肿(图1)。荧光素眼底血管造影(FFA)示:视网膜循环时间延长;视盘边界不清,其上毛细血管扩张、渗漏。静脉显著扩张、迂曲,管壁着染,黄斑周围毛细血管渗漏(水肿),造影晚期呈现花瓣样染料积存(图2、图3)。血常规检查:单核细胞百分比12.6%↑,单核细胞绝对值0.8×109/L↑,红细胞8.24×1012/L↑,血红蛋白含量214 g/L↑,红细胞压积66.4%↑,平均红细胞体积分布宽度-变异系数20.8%↑,平均红细胞体积分布宽度-标准差56.1 fL↑,红细胞平均体积80.6 fL↓,平均红细胞血红蛋白含量26.0 pg↓。请血液内科和心内科会诊。诊断为:双眼视网膜中央动脉阻塞;真性红细胞增多症;高血压病。予别嘌醇,羟基脲和阿司匹林治疗真性红细胞增多症;予苯磺酸左旋氨氯地平片治疗高血压病。眼科予双眼玻璃体注射康柏西普注射液治疗。
二诊(2013年10月10日)。注药1个月后复查,视力右眼0.5,左眼0.1,OCT示:双眼黄斑水肿,右眼黄斑中心凹处水肿基本消退,黄斑旁仍有少量水肿,左眼水肿基本同前(图4)。
三诊(2013年11月21日)。患者诉视力再次下降,查:视力右眼0.05,左眼0.2。OCT示:双眼黄斑区神经上皮脱离,黄斑水肿较前加重(图5);FFA示:眼底出血、渗出和黄斑水肿渗漏较前加重(图6)。血常规检查:单核细胞绝对值0.68×109/L↑,红细胞7.92×1012/L↑,血红蛋白含量215 g/L↑,红细胞压积70.1%↑,平均红细胞体积分布宽度-变异系数21.9%↑,平均红细胞体积分布宽度-标准差68.9 fL↑,平均红细胞血红蛋白浓度307 g/L↓。再次行双眼玻璃体注射康柏西普注射液治疗。
四诊(2013年12月17日)。诉第二次注药2周后,视力开始持续下降,查:视力右眼光感,左眼0.05。OCT示:黄斑水肿大致同前(图7);FFA示:视网膜毛细血管扩张、渗漏,静脉迂曲扩张,管壁着染,可见无灌注区较前加重(图8)。血常规检查:红细胞7.40×1012/L↑、血红蛋白含量215 g/L↑、红细胞压积68.1%↑、平均红细胞体积分布宽度-变异系数18.2%↑、平均红细胞体积分布宽度-标准差57.3 fL↑,血小板计数107×109/L↓。
五诊(2014年2月11日)。诉第二次注药1个月后视力再次开始持续下降,查:视力右眼无光感,左眼0.01。OCT示:右眼黄斑区视网膜厚度变薄,左眼黄斑区水肿大致同前(图9)。FFA示:视网膜出血较前减少,可见视网膜毛细血管无灌注区,小动脉狭窄,动脉短路(图10)。血常规检查:单核细胞百分比10.6%↑、单核细胞绝对值0.78×109/L↑,红细胞7.25×1012/L↑,血红蛋白含量222 g/L↑,红细胞压积67.5%↑,平均红细胞体积分布宽度-变异系数19.0%↑,平均红细胞体积分布宽度-标准差61.4 fL↑,嗜酸细胞百分比0.1%↓,嗜酸性粒细胞绝对值0.01×109/L↓。再次详细询问患者病史及是否有其他全身症状,患者诉近1年来晚上睡觉时经常感觉憋气。遂请呼吸科会诊,行多导睡眠监测检查,显示:平均血氧饱和度(SO2)54.8%,最低25%。修正诊断为:重度OSAHS;继发性红细胞增多症;高血压病;双眼CRVO;右眼黑矇。处理:无创呼吸机治疗。
六诊(2014年2月19日):呼吸机通气治疗7 d后复查,平均SO295.44%,最低86%。视力右眼无光感,左眼0.01。OCT示:双眼视网膜萎缩(图11);FFA示:左眼视盘毛细血管扩张及视网膜静脉扩张、迂曲等较前明显减轻,右眼同前,双眼可见视网膜毛细血管无灌注区(图12)。血常规检查:单核细胞绝对值0.83×109/L↑、红细胞压积52.1%↑、红细胞平均体积122.6 fL↑、平均红细胞血红蛋白含量39.5 pg↑,红细胞4.25×1012/L↓。
讨论
黄斑水肿(macular edema,ME)是视网膜中央静脉阻塞(central retinal vein occlusion,CRVO)中心视力下降的主要原因。抗-VEGF(血管内皮生长因子)疗法是目前临床治疗CRVO ME的专家共识,具有较好的疗效,2015年美国、加拿大和英国眼科医师学会发布的RVO指南均推荐其为首选疗法。临床上确诊CRVO ME后,行抗-VEGF多取得较好疗效。多数患者注射3~5 d后,眼底情况会出现不同程度的好转,维持1个月左右,1个月后根据复查OCT黄斑水肿情况,选择是否继续注射抗-VEGF药物治疗。同时,CRVO有许多风险因素,除年龄外,高血压、青光眼、颈动脉狭窄等均可影响CRVO的发生发展,临床医生亦会关注,并予以辅助治疗。本案患者初次注射抗-VEGF药物后,双眼ME明显消退,2个月后再次出现ME,行常规第二次注药。第二次注药2周后即出现视力减退和黄斑水肿,并持续进展。血常规多次复查亦一直存在异常,因此怀疑除高血压外,患者存在其他疾病或风险影响CRVO进展。详细询问患者病史,患者自述易疲劳,家属诉患者夜间打鼾严重,结合患者BMI和血常规异常,怀疑为OSAHS,请呼吸科会诊并予以对症治疗后患者CRVO进展得到控制,但由于患者视网膜已出现萎缩,故视力较难以恢复。OSAHS发病症状不明显,患者常难自行发现,但其导致的低血氧、血液高碳酸状态、激素异常等病理状态会诱发或加重眼部疾病,因此,了解OSAHS与眼病的关系对临床诊疗具有参考意义。
OSAHS与RVO研究发现,重度RVO患者OSAHS发病率更高,OSAHS至少是RVO常见的引发因子相关因素,甚至可能是在RVO发病中起重要作用的额外危险因子。OSAHS与RVO两者的相关性可以解释为什么许多患者在醒后出现视力丧失[5]。OSAHS会导致夜间低血氧症、高碳酸血症、胸内压改变、夜间惊醒和睡眠破碎等效应。血氧不足和夜间颅内压增高继发的循环血流速减慢会引发RVO。OSAHS导致的夜间惊醒会引发额外的动脉血压急性增高,附带血小板聚集增加、交感神经兴奋、氧化应激、血管内皮功能障碍、炎症和代谢失调等效应,上述因素也可能诱发或加重RVO[6]。
OSAHS与眼表异常研究发现,眼睑松弛综合征、乳头状结膜炎、角膜上皮点状病变、复发性角膜糜烂、角膜炎、圆锥角膜等眼表疾病均与OSAHS有关,其中,眼睑松弛综合征(FES)较常见,且常伴有易外翻的松弛眼睑、乳头状结膜炎、复发性角膜上皮糜烂等表现[7]。OSAHS患者FES的发病机制尚不清楚,可能与摩擦造成的机械性压迫,卧床的姿势,张力导致的眼睑缺血,组织炎症导致的松弛有关[7]。除此之外,OSAHS与泪液分泌试验(Schirmer test,ST)和泪膜破裂时间(BUT)数值降低、高眼表疾病指数、高角膜染色也存在相关性。研究发现,非OSAHS患者在FES患病率、ST、BUT、角膜染色(cornea staining,CT)、眼表疾病指数(ocular suface disease index, OSDI)等指标上均显著优于OSAHS患者,并且,随着OSAHS严重程度的增加,ST、BUT数值显著降低,而CT和OSDI则显著增高[8]。
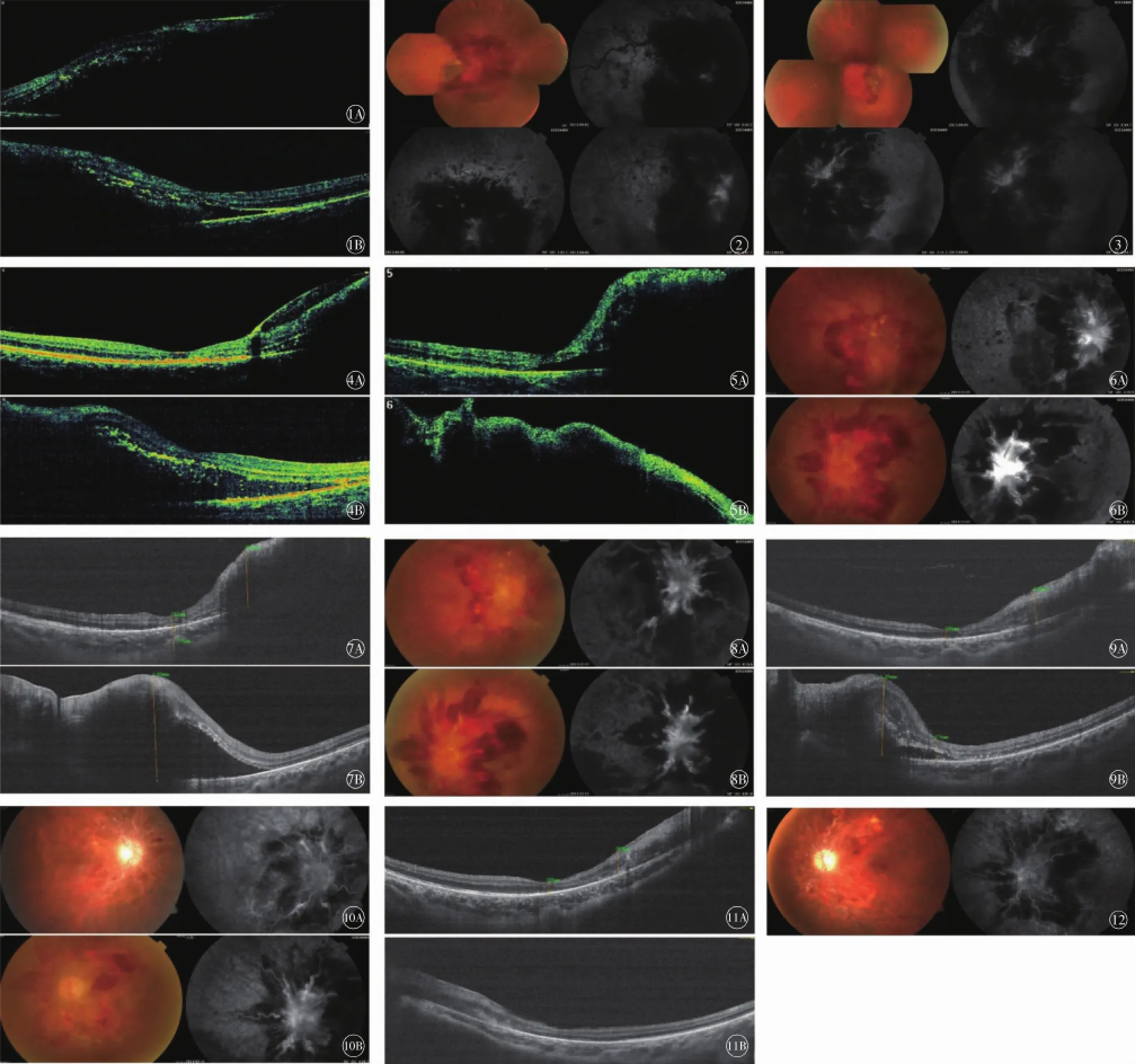
图1 OSAHS合并CRVO患者初诊OCT像(2013年9月5日)。1A.右眼,视力0.2,1B.左眼,视力0.1。双眼黄斑区神经上皮脱离,黄斑水肿图2、图3图1同期眼底及FFA像。图2右眼,图3左眼,双眼视网膜循环时间延长,视盘边界不清,其上毛细血管扩张、渗漏。静脉显著扩张、迂曲,管壁着染,黄斑周围毛细血管渗漏(水肿),造影晚期呈花瓣样染料积存。图4二诊OCT像(2013年10月10日)。4A.右眼,视力0.5,4B.左眼,视力0.1。双眼黄斑水肿,右眼黄斑中心凹处水肿基本消退,黄斑旁仍有少量水肿,左眼水肿基本同前。图5三诊OCT像(2013年11月21日)。5A.右眼,视力0.05,5B.左眼,视力0.2。双眼黄斑区神经上皮脱离,黄斑水肿较前加重。图6三诊FFA像。6A.右眼,6B.左眼,眼底出血、渗出和黄斑水肿渗漏较前加重。图7四诊OCT像(2013年12月17日)。7A.右眼,视力光感,7B.左眼,视力0.05。双眼黄斑水肿大致同前。图8四诊FFA像。8A.右眼,8B.左眼,视网膜毛细血管扩张、渗漏,静脉迂曲扩张,管壁着染,可见无灌注区较前加重。图9五诊OCT像(2014年2月11日)。9A.右眼视力无光感,黄斑区视网膜厚度变薄,9B.左眼视力0.01,黄斑区水肿大致同前。图10五诊FFA像。10A.右眼,10B.左眼,视网膜出血较前减少,可见视网膜毛细血管无灌注区,小动脉狭窄,动脉短路。图11六诊OCT像(2014年2月19日)。11A.右眼,视力无光感,11B.左眼,视力0.01。双眼视网膜萎缩。图12六诊左眼FFA像。左眼视盘毛细血管扩张及视网膜静脉扩张、迂曲等较前明显减轻,可见视网膜毛细血管无灌注区OSAHS:阻塞性睡眠呼吸暂停低通气综合征CRVO:视网膜中央静脉阻塞OCT:光学相干断层扫描FFA:荧光素眼底血管造影
OSAHS与青光眼目前普遍认为OSAHS是青光眼的危险因素。有越来越多的证据表明,OSAHS患者青光眼的发病率更高,特别是在那些睡眠呼吸暂停低通气指数(apnea-hypopnea index,AHI)>30的严重疾病,并且还认为青光眼患者更易有睡眠障碍,特别是在正常眼压性青光眼(normal tension glaucoma,NTG)更显著。已有研究表明,OSAHS患者最终有角膜变薄,可疑青光眼视盘变化和视网膜电图(ERG)异常,即使是视神经和视野正常的患者亦会有常规眼科检查无法发现的亚临床视神经变化[4]。目前认为,OSAHS患者视神经受累涉及血管及机械因素。血管因素包括,血管阻力增加导致的反复缺氧,植物神经失调,缺氧和随后的再灌注有关的氧化应激和炎症,脑灌注压降低和视神经直接缺氧性损伤。机械因素包括,晚上与仰卧位和肥胖有关的夜间高眼压,颅内压升高、筛板和/或小梁弹性纤维枯竭[8]。有研究发现,在OSAHS患者视网膜神经纤维层(RNFL)厚度较非OSAHS对照组明显减少[9]。因此,有学者认为,OSAHS患者应推荐眼科检查,青光眼患者应进行睡眠障碍检测,特别是NTG患者和那些尽管眼压控制但还有进展性视神经损伤的患者,持续气道正压通气(continuous positive airway pressure, CPAP)治疗可能有助于稳定青光眼进展性损伤[8]。
OSAHS与CSC小样本研究发现,急慢性CSC患者OSAHS患病率显著增加,为22%,而普通人群中OSAHS患病率为2%!4%。目前CSC的病因和发病机制尚不明确,近年研究表明其与机体糖皮质激素和儿茶酚胺浓度改变有关,睡眠不足、压力大、情绪波动等是其常见的诱发因素。已研究表明,严重的CSC患者交感神经兴奋性增加,同时,此类患者尚会有皮质醇和儿茶酚胺水平的增高。而OS" AHS患者随其严重程度的不同会有相应的交感神经活动的改变。呼吸障碍会提高尿儿茶酚胺分泌量,引发剂量依赖性高血压[10]。由此可见OSAHS与CSC存在着共同的病理生理机制,OSAHS被认为是CSC的危险因素。
OSAHS与糖尿病性视网膜病变(DR)DR是一种由于血糖异常导致视网膜血管改变的眼病,OS" AHS的主要特征为睡眠过程中反复发作的低通气及呼吸暂停,而呼吸暂停可能会引起低氧,肝糖原的释放增多,糖的有氧代谢减少,胰岛素抵抗增多,儿茶酚胺分泌增多使胰岛素分泌相对不足,糖代谢功能的紊乱,从而导致糖尿病发病几率增大。研究发现,血糖状态与OSAHS的严重程度呈正相关。相较于空腹血糖,糖负荷后1 h血糖、糖负荷后2 h血糖受OSAHS的影响显著增大,且独立于肥胖因素。相对于睡眠结构和睡眠效率的异常改变,睡眠低氧血症与糖代谢紊乱的相关性可能更大[11]。
OSAHS与上述眼病在发病上的联系目前尚不完全清楚,但大量研究表明,低通气或呼气暂停会导致低氧、高碳酸血症、交感神经兴奋、糖皮质激素和儿茶酚胺分泌异常等病理改变,进而引起或加重机体其他脏器功能的损害。同时,许多眼部疾病,特别是未发现明显诱因、治疗过程中存在反复的双眼发病的眼病,要警惕全身系统性疾病的可能性。针对此类眼病不能只对症治疗,需要查找其他全身疾病治病的可能性,积极治疗原发病,解除诱因,往往能够取得较好的疗效。
[1]Stradling JR,Davies RJ.Sleep.1:Obstructive sleep apnoea/hypop" noea syndrome:definitions,epidemiology,and natural history[J]. Thorax,59(1):73-78.
[2]Young T,Palta M,Dempsey J,et al.The occurrence of sleep-disor" dered breathing among middle-aged adults[J].N Engl J Med,1993, 328(17):1230-1235.
[3]Partinen M.Epidemiology of obstructive sleep apnea syndrome[J]. Curr Ooin Pulm Med,1995,1(6):482-487.
[4]P#rez-Rico C,Guti$rrez-D%az E,Menc%a-Guti$rrez E,et al.Ob" structive sleep apnea-hypopnea syndrome(OSAHS)and glaucoma" tous optic neuropathy[J].Graefes Arch Clin Exp Ophthalmol,2014, 252(9):1345-1357.
[5]Glacet-Bernard A,Leroux les Jardins G,Lasry S,et al.Obstructive sleep apnea among patients with retinal vein occlusion.Obstructive sleep apnea among patients with retinal vein occlusion[J].Arch Ophthalmol,2010,128(12):1533-1538.
[6]Leroux les Jardins G,Glacet-Bernard A,Lasry S,et al.Retinal vein occlusion and obstructive sleep apnea syndrome[J].J Fr Ophtalmol, 2009,32(6):420-424.
[7]Mutlu Acar,Hikmet Firat,Ugur Acar,et al.Ocular surface assess" ment in patients with obstructive sleep apnea-hypopnea syndrome [J].Sleep Breath,2013,17(2):583-588.
[8]Acar M,Firat H,Yuceege M,et al.Long-term effects of PAP on oc" ular surface in obstructive sleep apnea syndrome[J].Can J Ophthal" mol,2014,49(2):217-221.
[9]Kargi SH,Altin R,Koksal M,et al.Retinal nerve fibre layer mea" surements are reduced in patients with obstructive sleep apnoea syndrome[J].Eye(Lond),2005,19(5):575-579.
[10]Kloos P,Laube I,Thoelen A.Obstructive sleep apnea?in patients with central serous chorioretinopathy[J].Graefes Arch Clin Exp Ophthalmol,2008,246(9):1225-1228.
[11]冯媛郭东英彭辉,等.阻塞性睡眠呼吸暂停低通气综合征患者糖代谢状况的研究[J].中华内科杂志,2015,54(8):691-694.
R774.1
B
1002-4379(2016)06-0396-05
10.13444/j.cnki.zgzyykzz.2016.06.013
1.中国中医科学院眼科医院,北京100040 2.北京大学人民医院,北京100044
谢立科,E-mail:bjxielike@sina.com

