新型八元噻吩-乙炔-乙烯环状共轭低聚物的合成及其超分子行为
王小祥,张雪鹏,魏诗瑶,徐云彦,张前炎,谢素原,黄荣彬,郑兰荪
(厦门大学化学化工学院,固体表面物理化学国家重点实验室,福建 厦门361005)
新型八元噻吩-乙炔-乙烯环状共轭低聚物的合成及其超分子行为
王小祥,张雪鹏,魏诗瑶,徐云彦,张前炎*,谢素原,黄荣彬,郑兰荪
(厦门大学化学化工学院,固体表面物理化学国家重点实验室,福建 厦门361005)
通过噻吩-乙炔-乙烯交替构建的环状共轭低聚物,因其具有独特的π共轭体系和内部空腔,表现出非线性光学、双光子吸收等特殊光电性质.通过引入联噻吩基团,制备出一种新型的八元噻吩-乙炔-乙烯环状共轭低聚物,其晶体结构表明,该大环分子之间存在不常见的S-π弱相互作用,并且存在有序的分子内通道和分子间通道.扫描电镜显示该环状共轭低聚物能自组装成纤维状固体,长度可达几厘米.荧光光谱研究证实了C60对该环状共轭低聚物具有显著的荧光淬灭作用,说明作为电子给体的该环状共轭低聚物与作为电子受体的C60之间存在超分子行为和电子转移现象.
噻吩-乙炔-乙烯环状共轭低聚物;S-π相互作用;自组装;富勒烯;超分子行为
共轭聚合物是指主链由连续离域的π键组成的不饱和聚合物.根据形状的不同,通常有线性和环状2种聚合物[1-2].代表性的线性共轭聚合物有聚乙烯[3]、聚吡咯[4]、聚苯胺[5]、聚噻吩[6]等高分子聚合物.环状共轭低聚物由于具有独特的共轭结构,引起了科学家们广泛的兴趣,目前已合成的主要有苯环型、苯环-乙炔型、噻吩型、噻吩-乙炔型和苯环-噻吩混合型环状共轭低聚物.
苯环-乙炔型环状共轭低聚物是环状共轭低聚物中研究最早的,1974年,Staab课题组[7]利用间位的碘代芳基炔铜通过分子间的Stephen-Castro偶联反应成功实现了间位的苯环-乙炔型环状共轭低聚物的合成.后来Kawase课题组[8]通过Mc Murry环化反应合成得到了对位的苯环-乙炔型环状共轭低聚物,与间位结构不同的是,对位的苯环-乙炔型环状共轭低聚物结构中苯环是垂直的,因此其苯环-乙炔大共轭π体系呈辐射状.Bertozzi课题组[9]在苯环-乙炔型的基础上省略了炔碳基团,首次合成了对位苯环型环状共轭低聚物(CPPs).Yamago[10]、Itami[11-12]和Jasti[13-14]课题组相继利用不同的合成方法制备得到许多不同孔径的CPPs,研究发现不同孔径的CPPs具有不一样的光电性质.因为CPPs本身就是碳纳米管的最小单元,所以它可以作为直径统一的单壁碳纳米管生长的模板[15]. 2000年,Bäuerle课题组[16]首次合成了一系列噻吩型环状共轭低聚物,其结构中的所有噻吩单元几乎处于同一平面并且S原子都朝向环心.2003年他们又通过引入二价钯作为连接模板高产率地合成了一系列超大噻吩型环状共轭低聚物[17].在噻吩-乙炔型环状共轭低聚物研究方面,Iyoda课题组[18-20]做出了巨大贡献,他们利用Mc Murry环化反应合成得到一系列不同尺寸的噻吩-乙炔型环状共轭低聚物;研究发现随着噻吩结构单元数量的增加,其环的尺寸和π共轭体系也随之变大;另外,噻吩-乙炔-乙烯型的环状共轭低聚物随着噻吩结构单元的增加,并不是所有的S原子都朝向环心,因此具有特殊的双光子吸收性能.近期,Itami课题组[21]在CPPs研究的基础上又成功合成了苯环-噻吩交替连接的环状共轭低聚物(CPTs),由于苯环的引入,其中的噻吩环受其影响被部分竖立起来,所以CPTs的共轭π体系也是呈辐射状的;另外研究还发现随着大环数量的增加,其荧光发生显著的蓝移现象.
此外,由于环状共轭低聚物具有较大的空腔结构和共轭体系,其自组装和超分子作用引起众多科学家的关注.Höger课题组[22]报道了由噻吩-乙炔-苯结构交替组成的大环共轭分子,通过扫描隧道电子显微镜(STM)发现富勒烯和大环噻吩排列规则,形成大环噻吩与C60的复合物结构(大环噻吩与C60的个数比为1∶2),说明了作为给电子体的大环噻吩与作为吸电子受体的富勒烯存在相互作用.Yamago[23]和Jasti[24]课题组发现十元CPPs可以和富勒烯C60分别在溶液和固体状态下形成超分子络合物.Iyoda课题组[25]合成的八元噻吩-乙炔型环状共轭低聚物利用其合适的内腔直径也可以捕获富勒烯C60形成复合物,单晶结构显示,噻吩上的S原子与富勒烯存在相互作用.此外,噻吩型环状共轭低聚物分子的自主装和纳米级的内孔性质还可能用于合成微观反应器,并在其内进行某些化学反应,也可以应用于有机小分子分离吸附.因此,噻吩型环状共轭低聚物与超分子化学、纳米化学、有机光电领域结合将会有潜在的应用前景[28-31].
本文中通过引入联噻吩基团构建了新型的八元噻吩-乙炔-乙烯环状共轭低聚物,制备过程主要使用了Sonogashira交叉偶联反应和Mc Murry环化反应.利用单晶X射线衍射仪分析发现该大环分子之间存在不常见的S-π弱相互作用,并通过扫描电镜观察该环状共轭低聚物的自组装形貌,最后通过荧光光谱研究证实了该环状共轭低聚物与C60之间存在超分子行为和电子转移现象.
1 实验部分
1.1试 剂
5,5′-二溴-2,2′-联噻吩(99%)、四(三苯基膦)钯(99.8%)、碘化亚铜(99.99%)、正丁基锂(Bu Li,2.4 mol/L正己烷溶液)、N,N-二甲基甲酰胺(DMF, 99.9%)、四氯化钛(1.0 mol/L二氯甲烷溶液)、吡啶(分析纯),购自百灵威公司;锌粉(99.9%,600目)、四氢呋喃(THF,分析纯)、三乙胺(分析纯)、无水乙醚(分析纯)、正己烷(分析纯)、二氯甲烷(分析纯)、无水硫酸镁(分析纯)、石油醚(60~90℃)、甲苯(分析纯)、氘代三氯甲烷(CDCl3,99.8%)、硅胶(300~400目),购自厦门绿茵试剂玻仪公司;氩气(99.999%)购自新航气体有限公司.
1.2主要仪器
核磁共振仪:Bruker AV400和AV500核磁谱仪,氘代试剂为CDCl3,内标物为四甲基硅烷(TMS). Bruker基质辅助激光解吸-飞行质谱分析(MALDITOF)仪、安捷伦Agilent6500系列四级杆飞行时间串联质谱仪、HITACHI S-4800扫描电镜(SEM)、F7000荧光光谱仪、Bruker Smart APEX CCD单晶X射线衍射仪、IKA RCT bas磁力搅拌器和EYELA OSB-2100旋转蒸发仪.
1.3制备合成
1.3.1合成路线设计
八元噻吩-乙炔-乙烯环状共轭低聚物3的合成路线如图1所示:首先使用3,4-丁基-2-乙炔基噻吩和5, 5′-二溴-2,2′-联噻吩为原料通过Sonogashira交叉偶联反应合成化合物1,其中3,4-丁基-2-乙炔基噻吩参照Raymond课题组[26]的合成方法制备;再将化合物1在低温下与Bu Li和DMF反应得到化合物2;最后将化合物2通过关键的Mc Murry环化反应得到环状共轭低聚物3.
1.3.2化合物1的合成与表征
在三口圆底烧瓶中加入3,4-丁基-2-乙炔基噻吩(1.32 g,6.00 mmol)、5,5′-二溴-2,2′-联噻吩(844 mg,2.60 mmol)、四(三苯基膦)钯(300 mg,0.26 mmol)和碘化亚铜(98 mg,0.52 mmol),氮气保护和搅拌条件下,加入15 m L THF,缓慢滴入10 m L三乙胺溶液,室温搅拌过夜.加入饱和氯化铵溶液淬灭反应,采用无水乙醚萃取,有机层用无水硫酸镁干燥,低压旋干.最后用硅胶柱层析方法纯化,使用石油醚为洗脱剂,得到浅黄色的固体1(1.22 g,产率78%).1H-NMR(500 MHz,CDCl3):δ=7.15(d,J=4.0 Hz, 2 H),7.10(d,J=4.0 Hz,2 H),6.91(s,2 H),2.73(t, J=7.5 Hz,4 H),2.55(t,J=7.5 Hz,4 H),1.55~1.65(m,8H),1.40~1.49(m,8H),0.97~1.02(m, 12H).13C-NMR(500 MHz,CDCl3):δ=147.51, 142.20,138.03,132.41,124.02,122.85,122.17, 118.13,88.66,87.84,32.29,31.98,28.80,28.06, 22.74,22.70,14.11,14.09.MS(大气压化学电离(APCI)正离子模式),[M]+:m/z=603.224 2.
1.3.3化合物2的合成与表征
在三口圆底烧瓶中加入化合物1(1.00 g,1.66 mmol),氮气保护和搅拌条件下,加入25 m L THF,在0℃下缓慢滴入Bu Li(1.60 m L,2.4 mol/L),反应1 h之后,缓慢滴加DMF(0.4 m L).薄层色谱法(TLC)监测反应进程,室温反应30 min.之后加入饱和氯化铵溶液淬灭反应,加入甲苯和乙醚萃取,有机层用无水硫酸镁干燥,低压旋干.最后用硅胶柱层析方法纯化,使用V(石油醚)∶V(甲苯)=1∶2为洗脱剂,得到黄色的固体2(0.82 g,产率75%).1H-NMR(500 MHz, CDCl3):δ=10.01(s,2H),7.25(d,J=4.0 Hz,2H), 7.16(d,J=4.0 Hz,2 H),2.91(t,J=7.5 Hz,4 H), 2.72(t,J=7.5 Hz,4H),1.56~1.65(m,8H),1.42~1.50(m,8 H),0.97~1.03(m,12 H).13C-NMR(500 MHz,CDCl3):δ=181.88,151.02,143.66,138.96, 137.85,133.59,127.30,124.52,121.63,92.33, 87.83,34.34,32.32,27.64,27.02,22.75,22.68, 13.96,13.84.MS(APCI正离子模式),[M]+:m/z =659.214 6.
1.3.4环状共轭低聚物3的合成与表征
在三口圆底烧瓶中加入锌粉(1.47 g,22.4 mmol)后,加入90 m L THF,在0℃下缓慢滴入四氯化钛(10 m L,1 mol/L),80℃回流3 h,之后与化合物2(672 mg,1.02 mmol)和吡啶(0.2 m L)的THF溶液(90 m L)混合,继续回流反应12 h.待反应物冷却至室温,加入饱和碳酸氢钠溶液淬灭反应,先用甲苯和乙醚萃取,再用10%(质量分数)盐酸和蒸馏水各萃取1次.有机层用无水硫酸镁干燥,低压旋干.最后用硅胶柱层析方法纯化,使用V(石油醚)∶V(甲苯)=10∶1为洗脱剂,得到红色的环状共轭低聚物3(60.5 mg,产率9.5%).1H-NMR(500 MHz,CDCl3):δ=7.14(m, 8H),6.64(s,4H),2.70(t,J=7.5 Hz,8H),2.54(t, J=7.5 Hz,8H),1.59~1.65(m,16H),1.39~1.50 (m,16 H),0.90~1.02(m,24 H).13C-NMR(500 MHz,CDCl3):δ=147.84,141.53,138.09,134.80, 132.42,123.42,123.10,122.95,118.56,88.97, 88.56,32.93,32.48,28.27,27.39,22.76,22.61, 14.07,13.91.MALDI-TOF,[M]:m/z=1 252.
1.3.5扩散法培养环状共轭低聚物3晶体
将合成得到的环状共轭低聚物3(5 mg)溶解在2 m L二氯甲烷中,缓慢加入10 m L的正己烷,用透明封口膜封住瓶口,一周之后环状共轭低聚物3缓慢扩散到正己烷溶液中,得到环状共轭低聚物3单晶.

图1 环状共轭低聚物3的合成路线Fig.1 Synthetic route for cyclic conjugated oligomer 3
2 结果与讨论
2.1环状共轭低聚物3的晶体结构分析
环状共轭低聚物3的晶体数据通过X射线单晶衍射仪测试得到.表1的晶体参数显示该分子属于从三斜晶系,P-1空间群,晶胞参数a=0.624 nm,b= 1.238 nm,c=2.210 nm,α=86.63°,β=81.98°,γ= 96.07°.晶体结构如图2(a)(为了便于观察,省去H原子)所示,晶体结构中不包含溶剂分子,乙烯部分呈顺式结构,这是由于顺式结构相对于反式结构张力较小,所以顺式产物更容易形成的缘故.另外,环状共轭低聚物3分子具有椭圆形空腔结构,中间最短的S—S距离为0.716 nm,两端最长的C—C距离为1.982 nm,所形成的骨架呈略微的椅形,且环上原子和取代基等的位置及朝向都是固定的,因此电子可以在整个环骨架上离域而形成大的π共轭体系.图2(b)和(c)分别是环状共轭低聚物3晶体沿a轴和c轴的堆积图,可以看出,相邻大环分子交错堆积,沿a轴和c轴分别具有分子内部通道和分子间通道,通过调控这种孔道结构的尺寸有可能在主客体络合、吸附等领域得到应用.

表1 环状共轭低聚物3的晶体参数(CCDC 1456810)Tab.1 Crystallographic data of cyclic conjugated oligomer 3(CCDC 1456810)
图3是晶体结构中相邻2个大环分子3的正面和侧面视图(噻吩上的丁基链省去).从图3(a)和(b)2个视角观察晶体堆积,2个噻吩环之间的距离为0.425 nm,已经超过正常π-π相互作用的距离,而其中S原子和另一分子的噻吩中心的距离为0.338 nm,Mak等[27]认为S原子到芳环π的距离小于0.42 nm时,存在S-π弱相互作用,且距离越短作用力越强.这表明两大环分子之间存在不常见的双重S-π弱相互作用,而不是常见的π-π相互作用,相对于Iyoda报道的噻吩-乙炔-乙烯构建的共轭大环噻吩化合物,由于引入联噻吩基团,该大环分子3晶体内部由π-π相互作用变成S-π相互作用.S-π相互作用是一种不常见的孤对电子和芳环之间的相互作用,这种弱相互作用力在蛋白质晶体、有机小分子晶体生长中可以起到非常关键的作用,它使得分子在空间结构上规则排列而实现高度有序的自组装.
2.2环状共轭低聚物3的形貌分析
从扫描电镜图4可以看出,环状共轭低聚物3在溶液中自组装形成纤维状固体,其长度可以达到几厘米.这是由于在高浓度的环状共轭低聚物3溶液中,溶质分子形成了分子间缔合状态,而不是常规的单分子分散状态,使得分子间自行组装形成棒状晶体.由于环状共轭低聚物3分子间靠S-π弱相互作用力堆积,这种弱的相互作用导致环状共轭低聚物3的晶体不易长大,容易断裂,最终形成这种互相交叉生长的微纤维束.
2.3环状共轭低聚物3与C60主客体作用分析
将环状共轭低聚物3配置成一定浓度(50μmol/ L)的甲苯溶液,将C60配成不同浓度的甲苯溶液(0, 0.16,0.32,0.64,1.28 mmol/L),然后将环状共轭低聚物3和C60的甲苯溶液等体积混合,混合后溶液的荧光强度如图5所示.随着C60浓度的不断增加,环状共轭低聚物3和C60的甲苯混合溶液的荧光强度不断下降,说明C60对环状共轭低聚物3具有明显的荧光猝灭作用.由此可以推断C60和环状共轭低聚物3分子之间存在一定的相互作用,存在超分子行为.从机理上讲,这是由于环状共轭低聚物3分子中包含8个富电子的噻吩环,充当了电子给体,C60由于缺电子作为电子受体,二者相互作用形成了电子转移络合物.
3 结 论
本文中通过引入联噻吩基团构建了新型的八元噻吩-乙炔-乙烯环状共轭低聚物,制备过程主要使用了Sonogashira交叉偶联反应和Mc Murry环化反应.晶体结构显示该环状共轭低聚物的骨架呈略微椅式状,分子间通过不常见的S-π相互作用堆积(不同于常见的π-π相互作用),形成了分子内部通道和分子间通道,使其在复杂体系分离纯化方面有着潜在的应用前景.另外,荧光光谱证实该环状共轭低聚物与C60存在超分子行为和电子转移现象,使其在有机聚合物太阳能电池中有望作为空穴材料使用.
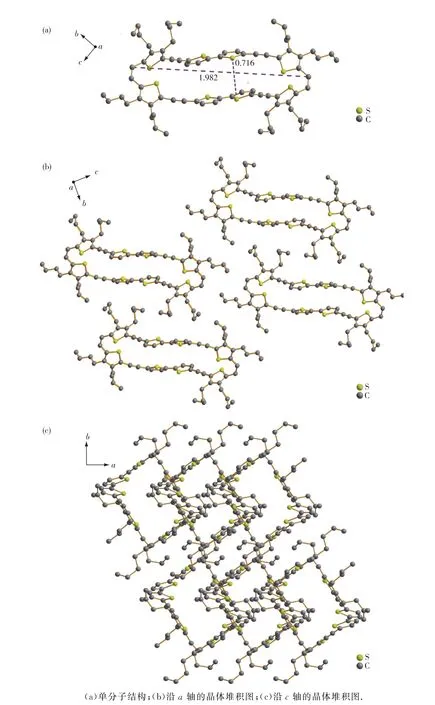
图2 环状共轭低聚物3的晶体结构图Fig.2 Crystal structure of cyclic conjugated oligomer 3

图3 两大环分子的晶体结构图Fig.3 Crystal structures of two macrocycle molecules

图4 环状共轭低聚物3的扫描电镜图Fig.4 SEM of cyclic conjugated oligomer 3

图5 环状共轭低聚物3与C60混合溶液的荧光谱图Fig.5 Emission spectra of cyclic conjugated oligomer 3 with different concentration of C60
[1] SIRRINGHAUS H B P J.Two-dimensional charge transport in self-organized,high-mobility conjugated polymers [J].Nature,1999,401(6754):685.
[2] IYODA M,YAMAKAWA J,RAHMAN M J.Conjugated macrocycles:concepts and applications[J].Angew Chem Int Ed,2011,50(45):10522-10553.
[3] KURTZ S M,MURATOGLU O K,EVANS M,et al.Advances in the processing,sterilization,and crosslinking of ultra-high molecular weight polyethylene for total joint arthroplasty[J].Biomaterials,1999,20(18):1659-1688.
[4] BERLIN A,VERCELLI B,ZOTTI G.Polythiophene-and polypyrrole-based mono-and multilayers[J].Poly Rev, 2008,48(3):493-530.
[5] KANG E T,NEOH K G,TAN K L.Polyaniline:a polymer with many interesting intrinsic redox states[J].Prog Polym Sci,1998,23(2):277-324.
[6] DUVAIL J L,RETHO P,FERNANDEZ V,et al.Effects of the confined synthesis on conjugated polymer transport properties[J].J Phys Chem B,2004,108(48): 18552-18556.
[7] STAAB H A,NEUNHOEFFER K.[2.2.2.2.2.2]Metacyclophane-1,9,17,25,33,41-hexayne from m-iodophenylacetylene by sixfold stephens-castro coupling[J]. Synthesis,1974(6):424.
[8] KAWASE T,FUJIWARA N,TSUTUMI M,et al.Supramolecular dynamics of cyclic[6]paraphenyleneacetylene complexes with[60]-and[70]fullerene derivatives:electronic and structural effects on complexation[J].Angew Chem Int Ed,2004,43(38):5060-5062.
[9] JASTI R,BHATTACHARJEE J,NEATON J B,et al. Synthesis,characterization,and theory of[9]-,[12]-,and [18]cycloparaphenylene:carbon nanohoop structures[J].J Am Chem Soc,2008,130(52):17646-17647.
[10] YAMAGO S,WATANABE Y,IWAMOTO T. Synthesis of[8]cycloparaphenylene from a squareshaped tetranuclear platinum complex[J].Angew Chem Int Ed,2010,49(4):757-759.
[11] TAKABA H,OMACHI H,YAMAMOTO Y,et al.Selective synthesis of[12]cycloparaphenylene[J].Angew Chem Int Ed,2009,121(33):6228-6232.
[12] OMACHI H,MATSUURA S,SEGAWA Y,et al.A modular and size-selective synthesis of[n]cycloparaphenylenes:a step toward the selective synthesis of[n, n]single-walled carbon nanotubes[J].Angew Chem Int Ed,2010,49(52):10202-10205.
[13] EVANS P J,DARZI E R,JASTI R.Efficient room-temperature synthesis of a highly strained carbon nanohoop fragment of buckminsterfullerene[J].Nat Chem,2014,6 (5):404-408.
[14] JASTI R,BERTOZZI C R.Progress and challenges for the bottom-up synthesis of carbon nanotubes with discrete chirality[J].Chem Phys Lett,2010,494(1/2/ 3):1-7.
[15] OMACHI H,NAKAYAMA T,TAKAHASHI E,et al. Initiation of carbon nanotube growth by well-defined carbon nanorings[J].Nat Chem,2013,5(7):572-576.
[16] KROMER J,RIOS-CARRERAS I,FUHRMANN G,et al. Synthesis of the first fullyα-conjugated macrocyclic oligothiophenes:cyclo[n]thiophenes with tunable cavities in the nanometer regime[J].Angew Chem Int Ed,2000,39(19): 3481-3486.
[17] FUHRMANN G,DEBAERDEMAEKER T,BÄUERLE P.C—C bond formation through oxidatively induced elimination of platinum complexes:a novel approach towards conjugated macrocycles[J].Chem Commun,2003 (8):948-949.
[18] NAKAO K,NISHIMURA M,TAMACHI T,et al. Giant macrocycles composed of thiophene,acetylene,and ethylene building blocks[J].J Am Chem Soc,2006,128 (51):16740-16747.
[19] WILLIAMS-HARRY M,BHASKAR A,RAMAKRISHNA G,et al.Giant thienylene-acetylene-ethylene macrocycles with large two-photon absorption cross section and semishapepersistence[J].J Am Chem Soc,2008,130(11):3252-3253.
[20] DONEHUE J E,VARNAVSKI O P,CEMBORSKI R, et al.Probing coherence in synthetic cyclic lightharvesting pigments[J].J Am Chem Soc,2011,133 (13):4819-4828.
[21] ITO H,MITAMURA Y,SEGAWA Y,et al.Thiophenebased,radialπ-conjugation:synthesis,structure,and photophysical properties of cyclo-1,4-phenylene-2,5-thienylenes[J].Angew Chem Int Ed,2015,54(1): 159-163.
[22] PAN G B,CHENG X H,HÖGER S,et al.2D Supramolecular structures of a shape-persistent macrocycle and Co-deposition with fullerene on HOPG[J].J Am Chem Soc,2006,128(13):4218-4219.
[23] IWAMOTO T,WATANABE Y,SADAHIRO T,et al. Size-selective encapsulation of C60by[10]cycloparaphenylene:formation of the shortest fullerene-peapod [J].Angew Chem Int Ed,2011,50(36):8342-8344.
[24] XIA J,BACON J W,JASTI R.Gram-scale synthesis and crystal structures of[8]-and[10]CPP,and the solidstate structure of C60@[10]CPP[J].Chem Sci,2012,3 (10):3018-3021.
[25] SHIMIZU H,COJAL GONZALEZ J D,HASEGAWA M,et al.Synthesis,structures,and photophysical properties ofπ-expanded oligothiophene 8-mers and their Saturn-like C60complexes[J].J Am Chem Soc, 2015,137(11):3877-3885.
[26] RINGENBACH C,DE NICOLA A,ZIESSEL R.A concise modular synthesis of 2,5-diethynyl-3,4-dibutylthiophene-bridged back-to-back terpyridine ligands[J].J Org Chem,2003,68(12):4708-4719.
[27] WAN C Q,HAN J,MAK T C W.Intermolecular S-πinteractions in crystalline sulfanyl-triazine derivatives[J]. New J Chem,2009,33(4):707-712.
[28] YU G,GAO J,HUMMELEN J C,et al.Polymer photovoltaic cells:enhanced efficiencies via a network of internal donor-acceptor heterojunctions[J].Science,1995,270 (5243):1789-1791.
[29] ZHU Z,WALLER D,GAUDIANA R,et al. Panchromatic conjugated polymers containing alternating donor/acceptor units for photovoltaic applications[J].Macromolecules,2007,40(6):1981-1986.
[30] DI MARIA F,OLIVELLI P,GAZZANO M,et al.A successful chemical strategy to induce oligothiophene selfassembly into fibers with tunable shape and function[J]. J Am Chem Soc,2011,133(22):8654-8661.
[31] HE C,HE Q,HE Y,et al.Organic solar cells based on the spin-coated blend films of TPA-th-TPA and PCBM [J].Sol Energy Mater Sol Cells,2006,90(12): 1815-1827.
Synthesis and Supramolecular Performance of a New Type of Eight-membered Thiophene-acetylene-ethylene Cyclic Conjugated Oligomer
WANG Xiaoxiang,ZHANG Xuepeng,WEI Shiyao,XU Yunyan, ZHANG Qianyan*,XIE Suyuan,HUANG Rongbin,ZHENG Lansun
(State Key Laboratory of Physical Chemistry of Solid Surfaces, College of Chemistry and Chemical Engineering,Xiamen University,Xiamen 361005,China)
In recent years,Masahiko Iyoda reported a series of macrocyclic compounds composed of thiophene,acetylene,and ethylene building blocks.These macrocyclic compounds own unusualπconjugated systems and inner cavity structure,which bring about some unique photoelectric performances,such as the two-photon properties and nonlinear optical responses.Here we synthesized a new cyclo[8]thiophene-acetylene-ethylene compound by introducing bithiophene groups.As shown in the crystal structure,uncommon S-πweak interactions play key roles during the crystal growth of thiophene rings,intramolecular and intermolecular channel are formed as the result of molecular cavity and perfect crystal packing.Scanning electron microscope(SEM)data show that the macrocyclic compound forms several centimeters long acicular fiber cluster by self-assembling.Furthermore,fluorescence emission spectrum shows that fluorescence intensities of macrocyclic compound dramatically quench with an increase of the fullerene(C60),which confirms the supramolecular and electronic transfer performance between the electron donor of the macrocyclic compound and the electron acceptor of the fullerene molecule.
thiophene-acetylene-ethylene cyclic conjugated oligomer;S-πinteractions;self-assembling;fullerenes; supramolecular performance
O 613.2;O 613.51;O 613.71
A
0438-0479(2016)06-0802-08
10.6043/j.issn.0438-0479.201603035
2016-03-23 录用日期:2016-05-10
国家自然科学基金(U1205111,21390390,21301143,51572231);中央高校基本科研业务费专项(20720140512,20720160084, 2013121014);高等学校博士学科点专项科研基金(20130121120001)
xmuzhangqy@xmu.edu.cn
王小祥,张雪鹏,魏诗瑶,等.新型八元噻吩-乙炔-乙烯环状共轭低聚物的合成及其超分子行为[J].厦门大学学报(自然科学版),2016,55(6):802-809.
WANG X X,ZHANG X P,WEI S Y,et al.Synthesis and supramolecular performance of a new type of eight-membered thiophene-acetylene-ethylene cyclic conjugated oligomers[J].Journal of Xiamen University(Natural Science),2016,55 (6):802-809.(in Chinese)

