乌鳢消化道黏膜 6种重要酶的组织化学定位
谢毓玲,王锦乙,袁保勤,张海燕,彭迁迁,张盛周
(安徽师范大学生命科学学院,安徽省重要生物资源保护与利用重点实验室,芜湖 241000)
乌鳢消化道黏膜6种重要酶的组织化学定位
谢毓玲,王锦乙,袁保勤,张海燕,彭迁迁,张盛周*
(安徽师范大学生命科学学院,安徽省重要生物资源保护与利用重点实验室,芜湖 241000)
目的 研究乌鳢消化道黏膜酸性磷酸酶(ACP)、碱性磷酸酶(ALP)、腺苷三磷酸酶(ATPase)、非特异性酯酶(NSE)、过氧化物酶(POX)、琥珀酸脱氢酶(SDH)等6种重要酶的分布与组织定位。方法 从乌鳢食道、胃贲门、胃体、胃幽门、幽门盲囊、前肠、中肠和后肠等8个部位取材,利用冰冻切片进行酶组织化学染色和光密度定量分析。结果 ACP主要分布于中肠和后肠黏膜上皮细胞底部,食道、贲门和胃体酶活力微弱。ALP主要分布于前肠和中肠黏膜上皮细胞顶部和基底部,胃中酶活力明显较弱。ATPase主要分布于胃腺中,食道中酶活力明显较弱。NSE主要分布于胃体上皮细胞和腺体中,后肠中酶活力明显较弱。POX在贲门和胃体的腺上皮细胞中活力最强,食道和胃幽门中活力明显较弱。SDH在贲门和胃体的腺体中活力最强,食道中活力微弱。结论 乌鳢消化道黏膜6种酶的分布表明其中肠和后肠有较强吸收蛋白质和细胞内消化功能,胃体是脂类的主要消化部位,前肠和中肠是营养物质吸收的主要部位。
乌鳢;消化道;酶组织化学
乌鳢(Ophiocephalus argus)俗名黑鱼,隶属鲈形目鳢科鳢属,是中国的土著鱼类之一。乌鳢肉质鲜美,营养价值高,生长迅速,适应能力强,且具有较强的繁殖能力,其人工养殖已在我国各地大规模推广[1-3]。乌鳢的人工繁殖和饲养相关基础研究也随之不断深入开展[1,3,4]。消化酶的活力是反映动物消化吸收功能的重要指标,乌鳢消化液中蛋白酶、淀粉酶和脂肪酶的活力已有研究报道[5,6],酸性磷酸酶(ACP)、碱性磷酸酶(ALP)、腺苷三磷酸酶(ATPase)、非特异性酯酶(NSE)、过氧化物酶(POX)和琥珀酸脱氢酶(SDH)等6种酶在动物的消化和吸收过程中发挥重要作用,但这些消化道黏膜的重要酶的活性分布尚未见报道。本文采用酶的组织化学方法对乌鳢消化道黏膜该6种重要酶的分布和组织定位进行了研究,旨在增进对乌鳢消化生理功能的认识,为其人工养殖提供基础资料。
材料和方法
1 实验材料
人工养殖乌鳢12条,重600~700g,均购自芜湖市菜市场,健康活体,解剖前于清水中暂养3~4h。用大解剖剪柄部用力迅速敲打其头部至其脑死亡后立即解剖取出完整的消化道,于冰袋上将食道、胃贲门、胃体、胃幽门、幽门盲囊、前肠、中肠和后肠等8部分进行精确分离取样。各个部位样品经0.01mol/L磷酸盐缓冲液(PBS,pH7.2)溶液漂洗片刻后,OCT包埋剂包埋,于-26℃下制作冰冻切片,厚度为6μm,置于4℃冰箱保存备用。
2 酶组织化学染色
酶组织化学染色参照吕大成等[7]的方法进行,在反应条件和时间上略有改变。
2.1酸性磷酸酶(ACP)
采用铅法显色。取12ml 0.1mol/L醋酸缓冲液(pH5.2),12ml 0.24%硝酸铅溶液和3ml 3%β-甘油磷酸钠溶液,混匀后置于37℃水浴内30min,过滤制成孵育液。将冰冻切片置于湿盒中,在切片上滴加孵育液并放入37℃恒温箱中反应40min。取出用蒸馏水洗净,再滴加1%硫化铵溶液反应1min,立即用蒸馏水冲洗,烘干后用树胶封片。
2.2碱性磷酸酶(ALP)
采用NBT/BCIP法显色。取9.9 μl 5%硝基蓝四唑(NBT)溶液与1.5ml 0.1mol/L碱性磷酸缓冲液(PB,pH9.5)混匀,再加入4.95 μl 5%5-溴-4-氯-3-吲哚-磷酸盐(BCIP)溶液,制成孵育液,现配现用,滴加于冰冻切片上,室温反应10min,用蒸馏水洗净,烘干后用树胶封片。
2.3腺苷三磷酸酶(ATPase)
采用钙-钴法显色。取腺苷三磷酸二钠盐(ATP钠盐)12 mg溶于4 ml蒸馏水中,用NaOH调节 pH至9.2,加入2 ml 2%巴比妥钠溶液和1ml 2%无水CaCl2溶液,混匀,再加入 5mg 2,4-二硝基苯酚(DNP)和3ml蒸馏水,调节pH至9.0,置于37℃水浴中12min,取出过滤制成孵育液。将冰冻切片置于湿盒中,先滴加1%CaCl2溶液于37℃反应5min,蒸馏水洗净;再滴加孵育液于37℃作用1.5h,蒸馏水洗净;滴加2%硝酸钴溶液室温下显色5min,蒸馏水洗净;放入4%中性甲醛溶液内室温下固定2min,蒸馏水洗净。最后滴加 1%硫化铵溶液反应1min,蒸馏水洗净,烘干后用树胶封片。
2.4非特异性酯酶(NSE)
采用偶氮法显色。取0.4g碱性品红粉末,溶于0.6ml浓盐酸中用玻璃棒迅速搅拌呈棕紫糊状,加入8ml蒸馏水溶解后过滤,取1.2ml溶液与等量的4% NaNO2水溶液混合制成六偶氮副品红溶液。取0.01g醋酸-1-萘酯溶于0.4ml丙酮中,加入40μl PBS,再加入2.4ml六偶氮副品红混合,滴加于冰冻切片上,室温下反应30min。蒸馏水洗净,烘干后用树胶封片。
2.5过氧化物酶(POX)
采用DAB法显色。取15mg二氨基联苯胺(DAB)粉末溶于 1.5ml 0.1mol/L Tris-HCl缓冲液(TBS)中,待完全溶解后分装于30个小管内并保存于-20℃的冰箱中备用。每次实验取一小管DAB溶液,加入1ml TBS,再加入 3μl H2O2混合后制成孵育液。将冰冻切片置于湿盒中,滴加孵育液后于37℃恒温箱中反应1h,取出后用蒸馏水冲洗,再用PBS溶液作用5min,蒸馏水洗净,烘干后用树胶封片。
2.6琥珀酸脱氢酶(SDH)
采用四唑盐法显色。取12μl 5%硝基蓝四唑(NBT)溶液,1.5ml 0.1mol/L PB和0.03g琥珀酸钠盐混匀制成孵育液。将冰冻切片置于湿盒中,滴加孵育液于37℃恒温箱中反应30min,蒸馏水洗净,烘干后用树胶封片。
3 酶活性光密度测定与数据统计分析
在Olympus BX61型显微镜下观察,10×40倍视野下显微拍照。利用Image-Pro Plus图像分析软件,对所选取的8个部位6种酶的组织化学染色部位进行光密度分析,同时测出切片中阳性部位的累积光密度(integrated optical density,IOD)和面积(Area),计算出平均光密度(MOD)以示酶活力大小。利用软件IBM SPSS Statistics 20进行单因素方差分析(one-way ANOVA),显示各种酶在消化道不同部位的活力差异显著性,P<0.05表示差异显著。
结 果
1 ACP的组织化学定位
ACP酶组织化学染色阳性反应产物呈棕黄色,在胃中主要分布于胃腺部,上皮细胞顶部及基底部有少量分布(图1A1),在幽门盲囊和前肠主要分布于黏膜上皮细胞顶部,固有层中有少量分布(图1A2),在中肠和后肠中密集分布于黏膜上皮细胞底部(图1A3)。光密度分析和各部位间两两比较显示,中肠和后肠酶活力最强,其次为胃幽门、前肠和幽门盲囊,胃体、胃贲门和食道酶活力微弱(表1)。
2 ALP的组织化学定位
ALP酶组织化学染色阳性反应产物呈蓝紫色,在食道和胃中主要分布于固有层中,在肠道和幽门盲囊中主要分布于上皮细胞顶部和底部,其中前肠上皮细胞顶部纹状缘酶活力较高(图1B1),中肠上皮细胞基底部酶活力较高(图1B2)。光密度分析和各部位间两两比较显示,前肠和中肠酶活力最强,其次为后肠、幽门盲囊和食道,胃各部位酶活力较弱。
3 ATPase的分布与组织定位
ATPase酶组织化学染色阳性部位呈棕黑色,在胃的各部位均主要分布于腺体和固有层中(图1C1),在幽门盲囊和肠道各部位均主要分布于上皮细胞顶部、底部和固有层中(图1C2)。光密度分析和各部位间两两比较显示,胃体酶活力最强,其次为胃幽门、胃贲门和幽门盲囊,肠道各部位酶活力较弱,食道中酶活力最弱。
4 NSE的分布与组织定位
NSE酶组织化学染色阳性部位呈橘红色,在食道中主要分布于上皮细胞顶部和底部(图1D1),胃贲门和胃幽门中酶活力很弱,分布于上皮细胞底部,腺体中无明显酶活力,在胃体的上皮细胞底部和腺体中则有较高的酶活力(图1D2),在幽门盲囊和肠道各部位主要分布于纹状缘,上皮细胞的底部有少量分布(图1D3)光密度分析和各部位间两两比较显示,胃体酶活力最强,其次为食道和幽门盲囊,胃贲门、胃幽门和肠道各部位酶活力较弱。
5 POX的分布与组织定位
POX酶组织化学染色阳性部位呈棕黄色颗粒状分布,在胃体和贲门中主要分布于上皮细胞、固有层和腺体中(图1E1),在幽门盲囊和肠道各部位的黏膜上皮细胞和固有层中呈不规则的颗粒状分布(图1E2)。光密度分析和各部位间两两比较显示,胃体和贲门酶活力最强,其次为幽门盲囊和肠道,胃幽门和食道酶活力最弱。
6 SDH的分布与组织定位
SDH酶组织化学染色阳性部位呈蓝紫色,主要分布于胃体腺和贲门腺中(图1F1);在食道黏膜上皮和胃幽门上皮细胞顶部有少量分布(图1F2);幽门盲囊和肠道中SDH主要分布于黏膜上皮细胞顶部,上皮细胞底部酶活力相对较弱(图1F3)。光密度分析和各部位间两两比较显示,胃体和胃贲门酶活力最强,其次为幽门盲囊、前肠和胃幽门,后肠和中肠酶活力较弱,食道酶活力最弱。
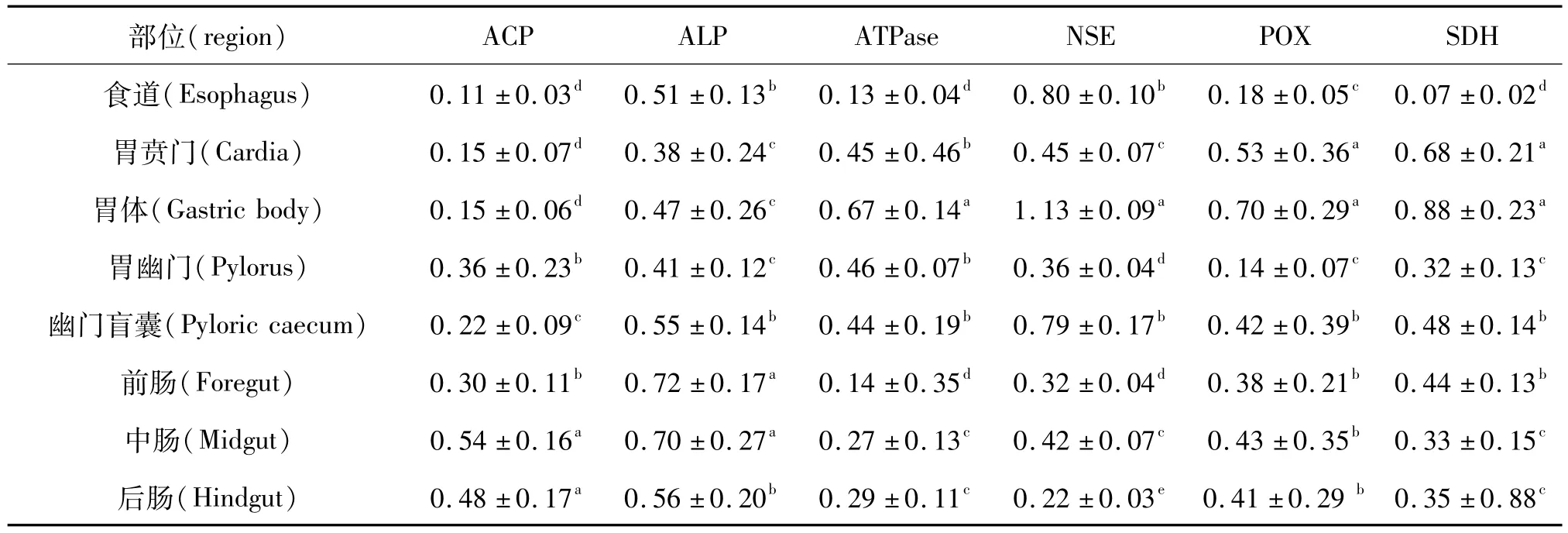
表1 乌鳢消化道黏膜6种酶的分布Table 1 The distribution of six types of enzymes in the digestive mucosa of Ophiocephalus argus
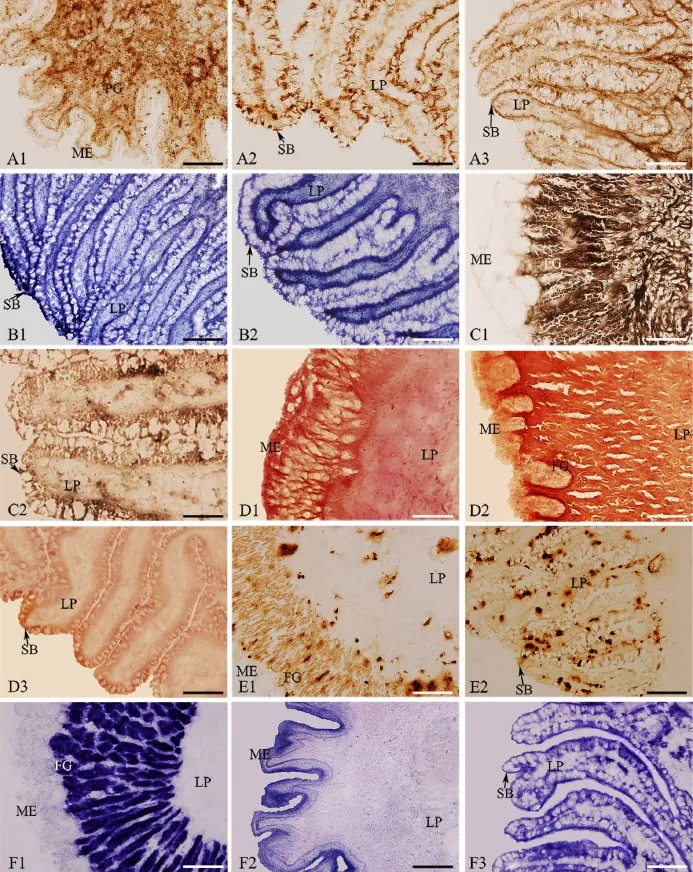
图1 6种重要酶在乌鳢消化道黏膜中的组织化学定位。A,酸性磷酸酶在胃幽门(A1)、幽门盲囊(A2)和后肠(A3)的分布;B,碱性磷酸酶在前肠(B1)和中肠(B2)的分布;C,腺苷三磷酸酶在胃体(C1)和中肠(C2)的分布;D,非特异性酯酶在食道(D1)、胃体(D2)和中肠(D3)的分布;E,过氧化物酶在胃体(E1)和中肠(E2)的分布;F,琥珀酸脱氢酶在胃体(F1)、胃幽门(F2)和前肠(F3)的分布;LP,固有层;ME,黏膜表皮;FG,胃底腺;PG,幽门腺;SB,纹状缘;比例尺,50μmFig.1 Histochemical localization of six essential enzymes in the digestive mucosa of Ophiocephalus argus.A,distribution of ACP in the pylorus(A1),pyloric caecum(A2)and hindgut(A3);B,distribution of ALP in the foregut(B1)and midgut(B2);C,distribution of ATPase in the gastric body(C1)and midgut(C2);D,distribution of NES in the esophagus(D1),gastric body(D2)and midgut(D3);E,distribution of POX in the gastric body(E1)and midgut(E2);F,distribution of SDH in the gastric body(F1),pylorus(F2)and foregut(F3);LP,lamina propria;ME,mucosal epithelia;FG,fundic glands;PG,pyloric glands;SB,striated border;Scale bar,50μm
讨 论
磷酸酶是一类能够催化各类含磷化合物水解的酶,根据其最适pH值不同常将其分为酸性磷酸酶和碱性磷酸酶。酸性磷酸酶是溶酶体的标志酶,是参与细胞内消化的重要水解酶。鱼类消化道细胞可通过内吞作用将食糜吞入细胞内,在溶酶体的作用下进行胞内消化和营养物质的吸收[8]。本研究显示,乌鳢消化道中酸性磷酸酶主要分布于中肠和后肠,其次为前肠和胃幽门。与许氏平鲉(Sebastes schlegeli)[9]主要分布于中肠基本一致,与褐菖鲉(Sebastiscus marmoratus)[10]主要分布于胃幽门,其次分布于幽门盲囊和肠道中有一定差异,而与项带重牙鲷(Diplodus vulgaris)[11]主要分布在直肠,而较少分布于中肠和后肠明显不同。可见,酸性磷酸酶在鱼类消化道内的分布存在一定的物种特异性。乌鳢消化道酸性磷酸酶的分布表明其中肠和后肠有较强吸收营养物质和细胞内消化功能。
碱性磷酸酶能催化一系列磷酸单酯的水解反应,产生无机磷酸和相应的醇、酚或糖,亦能够催化磷酸基团的转移反应[12]。碱性磷酸酶在消化道中主要参与营养物质吸收、离子分泌和机体防御等作用[12]。本研究显示,乌鳢消化道碱性磷酸酶主要分布于前肠和中肠,其次为后肠、幽门盲囊和食道,极少分布于胃中;与许氏平鲉[9]和褐菖鲉[10]碱性磷酸酶主要分布于前肠和中肠,少分布于胃中相一致;与项带重牙鲷[11]主要分布于幽门盲囊和前肠,其次分布在中肠、后肠和直肠亦相似。可见,前肠和中肠是肉食性鱼类行使消化吸收功能的主要部位。
ATPase位于动物细胞质膜上,可催化ATP水解为ADP和无机磷酸并释放能量进行物质转运[13]。本研究显示,乌鳢消化道ATPase主要分布于胃体中,其次为胃幽门、胃贲门和幽门盲囊,食道和肠道较少。鳜鱼(Siniperca chautsi)[14]ATPase主要分布食道、胃、前肠和后肠,其次为幽门盲囊和中肠;两栖类虎纹蛙(Rana rugulosa)[7]ATPase主要分布于胃贲门部,其次为胃幽门部、胃体和食管,较少分布于空肠、十二指肠、直肠和回肠中。可见,ATPase在不同动物消化道内的分布存在一定的物种特异性。乌鳢消化道ATPase主要分布于胃体,且定位于胃腺部,与胃酸和胃蛋白酶的分泌需要消耗较多ATP能量相适应。
非特异性酯酶是一种羧酸水解酶,与动物消化道内脂肪和酯类的消化吸收有关[15]。本研究显示,乌鳢消化道非特异性酯酶主要分布于胃体,其次为食道和幽门盲囊,较少分布于胃贲门、胃幽门和肠道中;与褐菖鲉[10]主要分布于胃幽门,其次为胃体、幽门盲囊和胃贲门,较少分布于食道和肠道中有一定的相似性;与项带重牙鲷[11]主要分布于前肠、中肠和直肠中则有明显差异;与红娘鱼(Lepidotrigla cavillone)[16]主要分布于后肠,其次为前肠,较少分布于中肠和幽门盲囊亦明显不同。可见,非特异性酯酶在鱼类消化道中的分布有明显的物种特异性。乌鳢消化道NSE的分布表明胃体是其消化脂类的主要部位。
过氧化物酶在动物细胞内过氧化物酶体中执行解毒作用,通过催化过氧化氢与氢供体之间的氧化反应,将过氧化氢、酚、甲醛和醇类等有毒物质氧化[17]。此外,过氧化物酶还参与脂肪酸的β氧化[18]。本研究显示,乌鳢消化道的过氧化物酶主要分布于胃体和贲门,其次为幽门盲囊和肠道,极少分布于胃幽门和食道中;与鳜鱼[14]过氧化物酶主要分布于胃幽门,其次为胃贲门、幽门盲囊和肠道,较少分布于食道和胃体中有一定的相似性;与两栖类虎纹蛙[7]过氧化物酶主要分布于胃体和食管,其次为胃贲门、胃幽门、直肠和十二指肠,较少分布于空肠和回肠中有明显差异。乌鳢消化道内过氧化物酶的分布表明胃体和贲门是其消化道代谢作用旺盛,产生有毒物质较多的部位。本研究还显示,乌鳢胃中过氧化物酶的分布与非特异性酯酶有较高的相似性,这可能与其参与脂质的代谢有关。
琥珀酸脱氢酶是三羧酸循环和有氧呼吸过程中的功能性成分,在细胞内串联线粒体基质中的琥珀酸到延胡索酸的氧化和泛醌在线粒体膜上的还原两个过程[19]。本研究显示,乌鳢消化道琥珀酸脱氢酶主要分布于胃贲门和胃体,其次为幽门盲囊、前肠和胃幽门,较少分布于后肠、中肠和食道中;与鳜鱼[14]琥珀酸脱氢酶在消化道的主要分布一致;与两栖类虎纹蛙[7]琥珀酸脱氢酶主要分布于直肠、食管和胃体,其次为空肠、回肠、十二指肠和胃贲门,较少分布于胃幽门中有一定的差异。乌鳢消化道琥珀酸脱氢酶集中分布于胃腺部,同ATPase的定位相一致,与胃腺分泌胃酸、胃蛋白酶需要消耗较多ATP能量相适应。
总之,乌鳢消化道黏膜6种酶的分布与其他物种既有相似性也有其自身特点。乌鳢中肠和后肠有较强吸收蛋白质和细胞内消化功能,胃体是脂类的主要消化部位,前肠和中肠是营养物质吸收的主要部位。
[1]Yu H,Zhang Q,Cao H,et al.Replacement of fish meal by meat and bone meal in diets for juvenile snakehead Ophiocephalus argus.Fisheries Sci,2015,81(4):1-7.
[2]李小勤,刘贤敏,冷向军,等.盐度对乌鳢生长和肌肉品质的影响.海洋与湖沼,2008,39(5):505-510.
[3]张新铖,陈昆慈,朱新平.乌鳢、斑鳢及杂交种养殖研究现状.广东农业科学,2011,38(22):132-134.
[4]Yu HR,Zhang Q,Cao H,et al.Apparent digestibility coefficients of selected feed ingredients for juvenile snakehead Ophiocephalus argus.Aquacult Nutr,2013,19(2): 139-147.
[5]吕子君,谢少林,王超,等.九种交配组合鳢生长和消化酶指标的比较分析.饲料工业,2015,36(6):25-30.
[6]张海宾.pH对乌鳢胃、肠、肝胰脏蛋白酶活性的影响.水生态学杂志,2006,26(2):4-5.
[7]吕大成,祝小琴,张敏,等.虎纹蛙消化道黏膜6种酶的组织化学定位.中国组织化学与细胞化学杂志,2015,24(1):66-71.
[8]Yúfera M,Pascual E,Polo A,et al.Effect of starvation on the feeding ability of gilthead seabream(Sparus aurata L.) larvae at first feeding.J Exp Mar Biol Ecol,1993,169(2): 259-272.
[9]冯晓燕,郑家声,王梅林.许氏平鲉消化道的组织化学研究.青岛海洋大学学报,2003,33(3):399-404.
[10]石戈,王健鑫,刘雪珠,等.褐菖鲉消化道的组织学和组织化学.水产学报,2007,31(3):293-302.
[11]Tlak Gajger I,Nejedli S,Kozaric'Z.Histochemical distribution of digestive enzymes in the intestine of the common two-banded seabream,Diplodus vulgaris,Geoffroy St-Hilaire 1817.Anat Histol Embryol,2013,42(3):161-167.
[12]Lallès JP.Intestinal alkaline phosphatase:novel functions and protective effects.Nutr Rev,2014,72(2):82-94.
[13]Liquori GE,Zizza S,Mastrodonato M,et a1.Pepsinogen and H,K-ATPase mediate acid secretion in gastric glands of Triturus carnifex(Amphibia,Caudata).Acta Histochem, 2005,107(2):133-141.
[14]彭迁迁,权梦雪,罗莹,等.鳜鱼消化道黏液细胞和6种酶的组织化学定位.激光生物学报,2016,25(2):28-36.
[15]Kozaric'Z,Kuzˇir S,Nejedli S,et al.Histochemical distribution of digestive enzymes in hake,Merluccius merluccius L.1758.Vet Arhiv,2004,74(4):299-308.
[16]Kozaric'Z,Petrinec Z,Kuzˇir S,et al.Histochemical analyses of digestive enzymes in the intestine of adult large-scaled gurnard(Lepidotrigla cavillone,Lacepe de,1801).Anat Histol Embryol,2011,40(4):314-320.
[17]许燕,杨洁,孙静秋,等.凡纳滨对虾不同组织内SOD、POD酶的细胞化学定位.水生生物学报,2010,34(2):402-409.
[18]Yang X,Yang L,Zheng H.Hypolipidemic and antioxidant effects of mulberry(Morus alba L.)fruit in hyperlipidaemia rats.Food Chem Toxicol,2010,48(8-9):2374-2379.
[19]Rutter J,Winge DR,Schiffman JD.Succinate dehydrogenase-assembly,regulation and role in human disease.Mitochondrion,2010,10(4):393-401.
Histochemical localization of six essential enzymes in the mucosa of digestive tracts of the Ophiocephalus argus
Xie Yuling,Wang Jinyi,Yuan Baoqin,Zhang Haiyan,Peng Qianqian,Zhang Shengzhou*
(College of Life Sciences,Anhui Normal University,Key Laboratory for Conservation and Use of Important Biological Resources of Anhui Province,Wuhu 241000,China)
Objective To investigate the distribution and histological localization of acid phosphatase(ACP),alkaline phosphatase(ALP),adenosine triphophatase(ATPase),nonspecific esterase(NSE),peroxidase(POX),and succinate dehydrogenase (SDH)in the digestive mucosa of Ophiocephalus argus.Methods Tissue samples from eight parts(esophagus,stomachus cardiacus, stomachus corpus,stomachus pyloricus,pyloriccaeca,pre-intestine,mid-intestine,hind-intestine)of the digestive tract were studied by enzyme histochemical staining on frozen sections,and quantitative analysis of results with optical density.Results ACP is mainly located at the bottom of the epithelial cells of the midgut and hindgut;the enzymatic activity is weak in the esophagus,cardia and gastric body.ALP is mainly located at the top and bottom of the epithelial cells of the foregut and midgut;the enzymatic activity is weaker in the stomach.ATPase is mainly distributed in the epithelial cells of gastric glands;the enzymatic activity is significantly weaker in the esophagus.NSE is mainly distributed in the cells of epithelium and glands of the gastric body;the enzymatic activityis significantly weaker in the hindgut.The activity of POX is highest in the glandular epithelial cells of the gastric body and cardia,and significantly weaker in those of esophagus and pylorus.The activity of SDH is highest in the glandular epithelial cells of the gastric body and cardia, and weakest in the esophagus.Conclusion The distribution of six types of enzymes in the digestive mucosa of Ophiocephalus argus indicates that the midgut and hindgut have a strong ability of protein absorption and intracellular digestion,the gastric body is the main site for lipid digestion,and that the foregut and midgut are the main parts for nutrient absorption.
Ophiocephalus argus;digestive tract;enzyme histochemistry
Q174
A
10.16705/j.cnki.1004-1850.2016.05.007
2016-07-16
2016-10-09
安徽省自然科学基金(11040606M75);国家级大学生创新创业训练计划项目(201510370058);安徽省重要生物资源保护与利用重点实验室建设基金
谢毓玲,女(1994年),汉族,本科
(To whom correspondence should be addressed):szzhang@mail.ahnu.edu.cn

