SH-SY5Y细胞p38 MAPK信号转导通路对α7尼古丁受体蛋白水平的影响
周 飞 齐晓岚 吴昌学 官志忠 李 毅
(贵州医科大学 贵州省医学分子生物学重点实验室,贵州 贵阳 550025)
SH-SY5Y细胞p38 MAPK信号转导通路对α7尼古丁受体蛋白水平的影响
周 飞1齐晓岚1吴昌学1官志忠1李 毅1
(贵州医科大学 贵州省医学分子生物学重点实验室,贵州 贵阳 550025)
目的 研究p38 MAPK信号传导通路激动及抑制对SH-SY5Y细胞α7神经型乙酰胆碱受体 (nAChR) 蛋白水平的影响并探讨受体蛋白与p38通路之间的关系。方法 分别用p38 MAPK激活剂Anisomycin和p38 MAPK阻断剂SB203580激动和阻断SH-SY5Y细胞p38 MAPK通路蛋白的活化及其表达,Western印迹方法检测α7 nAChR蛋白水平。结果 细胞经Anisomycin处理后,p38 MAPK蛋白表达不变,p-p38 MAPK(Thr180/Tyr182)蛋白水平升高了71%(P<0.01),同时细胞α7 nAChR蛋白表达升高了80%(P<0.01).细胞经SB203580处理后,p38 MAPK蛋白表达不变,p-p38 MAPK(Thr180/Tyr182)蛋白水平降低了62%(P<0.01),提示p38 MAPK信号通路被抑制,同时细胞α7 nAChR蛋白表达降低了80%(P<0.01)。结论 Anisomycin能激动SH-SY5Y细胞p38 MAPK信号转导通路,引起α7 nAChR蛋白表达明显增强;SB203580能阻断SH-SY5Y细胞p38 MAPK信号转导通路,引起α7 nAChR蛋白水平显著降低。
阿尔茨海默病;α7 nAChR;p38 MAPK
神经型乙酰胆碱受体(nAChR)在阿尔茨海默病(AD)中研究较多,α7 nAChR是分布最广的亚单位之一〔1〕,具有调节认知、学习、记忆等功能〔2,3〕,胆碱能系统障碍和神经损伤可能与α7 nAChR基因、结构及其功能异常有一定关联〔4〕。 α7 nAChR表达增加能降低Tau蛋白磷酸化水平发挥神经保护作用〔5〕,尼古丁作为胆碱受体兴奋剂,可明显改善认知功能损害〔6〕,因此α7 nAChR激动剂与其阳性变构调节剂结合后对AD治疗有重要作用〔7〕。丝裂原活化蛋白激酶(MAPK)信号转导通路由相关激动的丝/苏氨酸蛋白激酶组成,其中p38 MAPK参加调节神经细胞存活的整个生命过程,在神经受损及细胞坏死中涉及较多。通过体外激动α7 nAChR可以促进nAChR 离子通道对Ca2+通透性,伴随Ca2+水平升高MAPK信号系统中的p38通路可被激活并发挥作用〔8〕,调节神经细胞受损后基因的表达。研究显示激活p38 MAPK可引起神经系统Tau过度磷酸化〔9〕。因此,本实验将针对AD中影响Tau蛋白磷酸化水平的α7尼古丁受体蛋白及p38 MAPK信号转导通路展开研究,探索二者之间的关系,为α7 nAChR调节Tau蛋白作用机制研究提供理论依据。
1 材料与方法
1.1 材料 源于人脑的SH-SY5Y神经细胞由本课题组保存;DMEM培养基、血清、0.25%胰酶均来源于Hyclone公司;兔抗人p38 MAPK单克隆抗体(8690s)、兔抗人p-p38 MAPK (Thr180/Tyr182) 单克隆抗体(4511s)、辣根过氧化物酶(HRP)标记的羊抗兔二抗(7074s)、SB203580(5633s)均购于美国Cell Signaling公司;兔抗人α7 nAChR多克隆抗体(sc-5544)购于美国Santa公司;鼠抗人β-actin 单克隆抗体(m20010)购于美国Abmart公司;辣根酶标记的羊抗鼠二抗(ZB2305)来源于中杉金桥公司;Anisomycin(A9789-25mg)源于美国Sigma公司;蛋白marker来源于美国Thermo公司;5倍蛋白上样缓冲液、SDS-PAGE凝胶配制试剂盒、PMSF蛋白酶抑制剂、显影液、定影液均购自上海碧云天生物技术有限公司;细胞计数试剂盒-8(CCK-8)购自日本Dojindo公司;蛋白磷酸酶抑制剂混合物、RIPA高效裂解液均来源于北京索莱宝公司;PVDF膜、ECL-Plus发光试剂购自美国Millipoe公司;胶片购于中国柯达公司。
1.2 方法
1.2.1 细胞培养及处理 SH-SY5Y细胞以DMEM为培养基,其中添加10%血清、1%双抗 (青霉素100 U/ml,链霉素100 U/ml),放入37℃含5% CO2恒温箱中进行孵育。细胞经0.25%胰酶消化后接种于六孔板中进行培养,待细胞生长至85%~90%时,更换未添加血清及抗生素的DMEM培养基饥饿处理12 h,再分别加入2 ng/ml Anisomycin〔10〕、160 μmol/L SB203580(CCK-8筛选条件),均处理1 h后收集细胞。
1.2.2 CCK-8法检测SH-SY5Y细胞活力 用含10%胎牛血清的DMEM培养基将经胰酶消化后的SH-SY5Y细胞吹打混匀成单细胞悬液,以密度为104/孔接种于96孔板中(边缘孔用单纯DMEM培养基填充,可作为空白孔),每孔定容100 μl,每组6个复孔,放入培养箱孵育,待细胞生长至孔底80%~85%时,吸掉培养基,每孔加入DMEM培养液100 μl进行饥饿处理,12 h后吸掉单纯培养基,根据实验设计每组加入浓度分别为0、20、40、80、160、320和640 μmol/L的SB203580(用DMEM稀释),孵育1 h后吸掉培养基,终止药物作用,同时周边空白孔也吸掉原DMEM培养液,最后均加入含10%CCK-8的DMEM培养基,每孔100 μl,于恒温箱中继续孵育,1 h后用酶标仪检测各孔在540 nm处的吸光度(A)值并根据公式:细胞活力=(实验组-空白组)/(对照组-空白组)计算各组细胞存活率。
1.2.3 Western印迹法检测SH-SY5Y细胞中p38、p-p38及α7 nAChR蛋白水平 细胞加药处理后,按RIPA∶PMSF∶蛋白磷酸酶抑制剂混合物=100∶1∶1配制细胞裂解液,分别收集细胞、提取蛋白质并定量蛋白浓度;运用Western印迹方法检测细胞中p38、p-p38蛋白表达情况,以验证相应药物对SH-SY5Y细胞作用条件的筛选;检测细胞中α7 nAChR蛋白表达情况,观察药物作用p38 MAPK通路蛋白后对α7 nAChR蛋白水平的影响。运用Image J 软件进行图片像素灰度值处理,以β-actin条带作为内对照,分别计算p38、p-p38、α7 nAChR蛋白条带相对其内参的灰度比值并作为目的蛋白的相对表达水平。每组蛋白3个复孔,至少重复3次独立实验。
1.3 统计学分析 运用SPSS22.0软件行t检验。
2 结 果
2.1 不同浓度SB203580对SH-SY5Y细胞活力的影响 经不同浓度的SB203580处理后,细胞活力值逐渐下降且呈现剂量依赖关系,在20、40和80 μmol/L SB203580作用时,细胞活力(90±2、86±12、85±6)降低,但与对照组(100±0.8)相比无统计学差异(P>0.05);随着SB203580浓度增加,细胞活力明显下降,160、320和640 μmol/L组的细胞活力(83±7、51±7、5±1)分别是对照组的83%(P<0.05)、50%(P<0.01)和5%(P<0.01)。因为160 μmol/L是使细胞活力下降最低即相对存活率最高的浓度,因此后续实验使用的SB203580浓度均为160 μmol/L。
2.2 SB203580对p38 MAPK信号通路蛋白水平的影响 与对照组相比(92±8),SB203580组p38蛋白质水平(92±8)保持不变,p-p38蛋白质水平降低了62%(对照组105±6,SB203580组40±7)(P<0.01),说明160 μmol/L的SB203580作用SH-SY5Y细胞1 h后p38 MAPK通路被明显抑制。见图1。
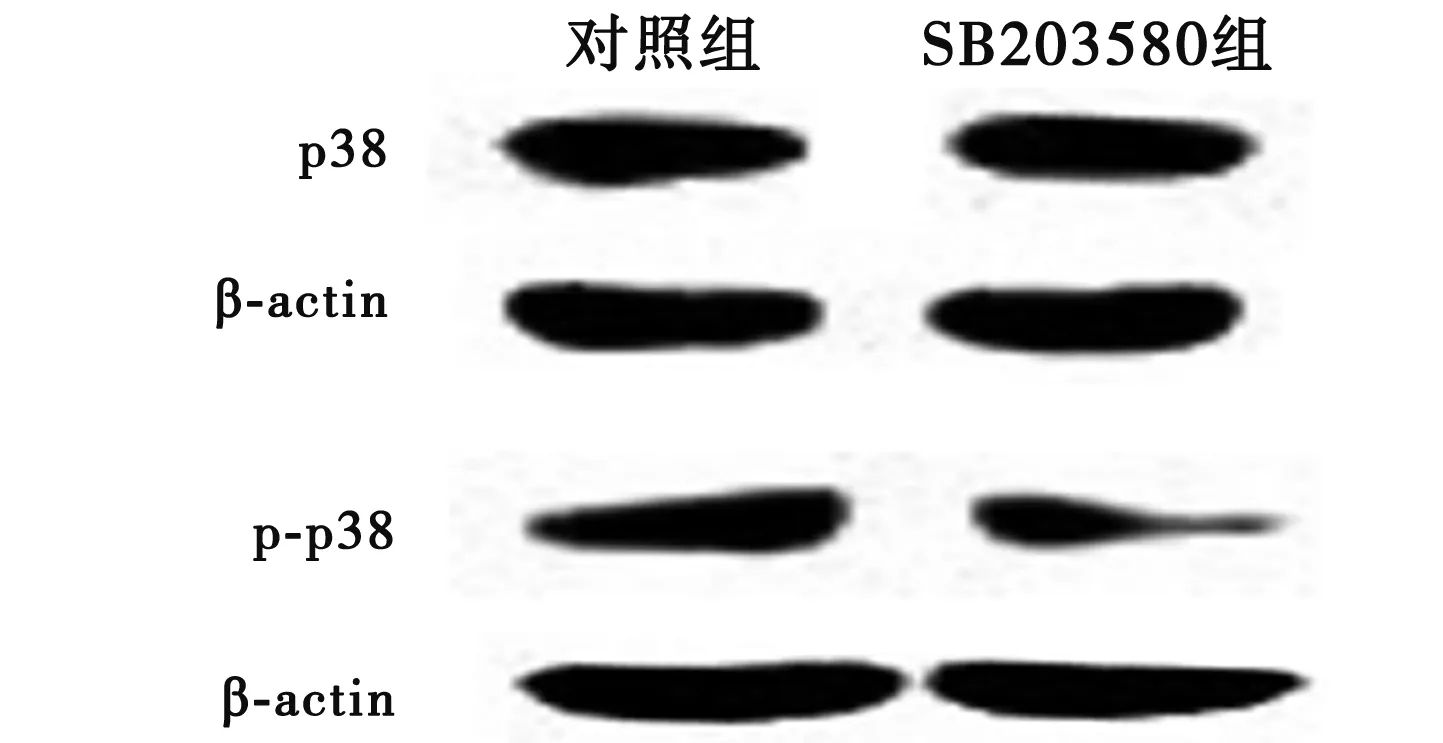
图1 SB203580对细胞p38、p-p38蛋白水平的影响
2.3 Anisomycin对p38 MAPK信号通路蛋白水平的影响 与对照组(p38:94±6,p-p38:105±9)相比,p38蛋白质水平(93±7)保持不变,p-p38蛋白质水平(30±8)升高了71%(P<0.01),说明2 ng/ml的Anisomycin作用SH-SY5Y细胞1 h后p38 MAPK通路被显著激活。见图2。

图2 Anisomycin对细胞p38、p-p38蛋白水平影响
2.4 p38 MAPK信号通路对α7 nAChR蛋白水平的影响 与对照组(102±7、104±11)相比,Anisomycin处理组细胞α7 nAChR蛋白水平(184±7)升高了80%(P<0.01),SB203580处理组细胞α7 nAChR蛋白水平(20±5)降低了80%(P<0.01),说明p38 MAPK通路激活引起α7 nAChR蛋白表达升高,p38通路抑制引起α7 nAChR蛋白水平降低。见图3。

图3 Anisomycin及SB203580对细胞α7 nAChR蛋白水平影响
3 讨 论
目前AD发病年龄逐步提前且发病率逐年上升,加快对该病的探索及有效的防治研究已迫在眉睫〔11〕。在AD的病程发展中nAChR数目明显减少〔12,13〕,α7 nAChR是其重要组成部分,研究表明,降低α7 nAChR活力可增强Aβ诱导的胆碱系统紊乱及神经毒性〔14,15〕,激活α7 nAChR不仅可以促进神经元兴奋〔16〕,还可对抗神经毒性,减弱Aβ诱导的神经细胞凋亡〔13〕,发挥一定的神经保护作用,还能提高AD患者的认知水平及其空间学习记忆能力〔17〕。因此,α7 nAChR激动剂已被证实为一种前景较好的AD治疗药〔18〕。
MAPK传导通路是体内的一条基本信息传递链,参与调节细胞生长、分化、凋亡等整个生命过程〔19〕,p38 MAPK是其重要成员。研究表明,Aβ可通过激活p38 MAPK信号途径引起细胞凋亡〔20〕,Tau蛋白磷酸化可促进MAPK激动,通过细胞周期活化机制引起神经损伤〔21〕,因此tau蛋白及Aβ引起的神经毒性都与p38 MAPK激活存在一定联系〔22〕,在AD的预防与治疗研究中发现,抑制p38信号传导通路可抵抗Aβ毒性〔23〕,p38 MAPK阻断剂可能会成为治疗认知功能障碍性疾病的新靶点〔24〕。
本实验结果显示,p38 MAPK通路被阻断时α7 nAChR蛋白表达明显降低,可能与神经损伤机制减少需降低保护机制以维持机体平衡有关;p38 MAPK通路被激活后α7 nAChR蛋白表达明显升高,可增强机体抵抗力发挥一定的神经保护作用抵抗毒性损伤。综上所述,α7 nAChR蛋白水平可受p38 MAPK通路的影响,并与通路蛋白水平变化呈正相关,说明p38 MAPK信号传导通路对α7 nAChR具有非常强的调控作用,在尼古丁受体调节AD的机制研究中p38 MAPK可能会成为一个新的关键和重要突破点。
1 Di Cesare ML,Pacini A,Matera C,etal.Involvement of alpha7 nAChR subtype in rat oxaliplatin-induced neuropahty:effects of selective activation〔J〕.Neuropharmacology,2014;79(1):37-48.
2 Fan H,Gu R,Wei D.The alpha7 nAChR selective agonists as drug candidates for Alzheimer′s disease〔J〕.Adv Exp Med Biol,2015;827(3):353-65.
3 Russo P,Del BA,Frustaci A,etal.Beyond acetylcholinesterase inhibitors for treating Alzheimer′s disease:alpha7-nAChR agonists in human clinical trials〔J〕.Curr Pharm Des,2014;20:6014-21.
4 Hurst R,Rollema H,Bertrand D.Nicotinic acetylcholine receptors:from basic science to therapeutics〔J〕.Pharmacol Ther,2013;137(1):22-54.
5 Del Barrio L,Martín-de-Saavedra MD,Romero A,etal.Neurotoxicity induced by okadaic acid in the human neuroblastoma SH-SY5Y line can bi differentially prevented by α7 and β2*nicotinic stimulation〔J〕.Toxicol Sci,2011;123(1):193-205.
6 Guo CN,Sun L,Liu GL,etal.Protective effect of nicotine on the cultured rat basal forebrain neurons damaged by β-Amyloid(Aβ)25-35 protein cytotoxicity〔J〕.Eur Rev Med Pharmacol Sci,2015;19(16):2964-72.
7 Ibrahim AF,Zickri MB,Aal LA,etal.The effect of thymoquinone,α7 receptor agonist and α7 receptor allosteric modulator on the cerebral cortex in experimentally induced alzheimer′s disease in relation to MSCs activation〔J〕.Int J Stem Cells,2016;9(2):230-8.
8 Ween H,Thorin-Hagene K,Andersen E,etal.Alpha3* and alpha 7 nAChR-mediated Ca2+ transient generation in IMR-32 neuroblastoma cells〔J〕.Neurochem Int,2010;57(3):269-77.
9 Cao M,Liu F,Ji F,etal.Effect of c-Jun N-terminal kinase (JNK)/p38 mitogen-activated protein kinase (p38 MAPK) in morphine-induced tau protein hyperphosphorylation〔J〕.Behavi Brain Res,2013;237(2):249-55.
10 Guo X,Wu X,Ren L,etal.Epigenetic mechanisms of amyloid-β production in anisomycin-treated SH-SY5Y cells〔J〕.Neuroscience,2011;194(2):272-81.
11 Rhinn H,Fujita R,Qiang L,etal.Integrative genomics identifies APOE 4 effectors in Alzheimer′s disease〔J〕.Nature,2013;500(7460):45-50.
12 Araya JA,Ramírez AE,Figueraa-Aroca D,etal.Modulation of neuronal nicotinic receptor by quinolizidine alkaloids causes neuroprotection on a cellular Alzheimer model〔J〕.J Alzheimers Dis,2014;42(1):143-55.
13 Oz M,Lorke DE,Yang KH,etal.On the interaction of β-amyloid peptides and α7-nicotinic acetylcholine receptors in Alzheimer’s disease〔J〕.Curr Alzheimer Res,2013;10(5):618-30.
14 Jin Y,Tsuchiya A,Kanno T.Amyloid-β peptide increases cell surface localization of α7 ACh receptor to protect neurons from amyloid β-induced damage〔J〕.Biochem Biophys Res Commun,2015;468(1-2):157-60.
15 Liu Q,Xie X,Emadi S,etal.A novel nicotinic mechanism underlies β-amyloid-induced neurotoxicity〔J〕.Neuropharmacology,2015;97(4):457-63.
16 Komal P,Gudavicius G,Nelson C,etal.T-cell receptor activation decreases excitability of cortical interneurons by inhibiting α7 nicotinic receptors〔J〕.J Neurosci,2014;34(1):124-33.
17 Medeiros R,Castello NA,Cheng D,etal.α7 nicotinic receptor agonist enhances cognition in aged 3xTg-AD mice with robust plaques and tangles〔J〕.Am J Pathol,2014;184(2):520-9.
18 Fan H,Gu R,Wei D.The α7 nAChR selective agonists as drug candidates for Alzheimer′s disease〔J〕.Adv Exp Med Biol,2015;827(3):353-65.
19 Cargnello M,Roux PP.Activation and function of the MAPKs and their substrates,the MAPK-activated protein kinases〔J〕.Microbiol Mol Biol Rev,2011;75(1):50-83.
20 Xu Y,Cao DH,Wu GM,etal.Involvement of P38 MAPK activation by NMDA receptors and non-NMDA receptors in amyloid-β peptide-induced neuronal loss in rat hippocampal CA1 and CA3 subfields〔J〕.Neurosci Res,2014;85(1):51-7.
21 Leugers CJ,Koh JY,Hong W,etal.Tau in MAPK activation〔J〕.Front Neurol,2013;4(4):161.
22 Giraldo E,Lloret A,Fuchsberger T,etal.Aβ and tau toxicities in Alzheimer′s are linked via oxidative stress-induced p38 activation.Protective role of vitamin E〔J〕.Redox Biology,2014;2(7):873-7.
23 Xu W,Yang L,Li J.Protection against β-amyloid-induced neurotoxicity by naturally occurring Z-ligustilide through the concurrent regulation of p38 and PI3-K/Akt pathways〔J〕.Neurochem Int,2016;100:44-51.
24 Dai HL,Hu WY,Jiang LH,etal.p38 MAPK inhibition improves synaptic plasticity and memory in angiotensin Ⅱ-dependent hypertensive mice〔J〕.Sci Rep,2016;6:27600.
〔2016-12-20修回〕
(编辑 郭 菁)
国家自然科学基金资助项目(81360178);贵州省教育厅“2011协同创新中心”(黔教合协同创新中心〔2014〕06);贵州省科技厅重大专项(黔科合重大专项字2014〔6008〕);贵州省科技厅项目(黔科合SY字〔2013〕3020;黔科合LH字〔2016〕7365;
李 毅(1978-),男,中级实验师,硕士,主要从事老年性痴呆研究。
周 飞(1990-),女,硕士,主要从事神经分子生物学研究。
R749.01
A
1005-9202(2017)05-1047-03;
10.3969/j.issn.1005-9202.2017.05.003
1 贵州医科大学 地方病与少数民族疾病教育部重点实验室

