术前血小板与淋巴细胞比值对肝细胞癌患者预后影响的Meta分析
李志斌, 肖冬生, 宋 伟
(1 江西省共青城市人民医院 普通外科, 江西 共青城 332020;2 南昌大学第二附属医院 肝胆外科, 南昌 330000)
术前血小板与淋巴细胞比值对肝细胞癌患者预后影响的Meta分析
李志斌1, 肖冬生1, 宋 伟2
(1 江西省共青城市人民医院 普通外科, 江西 共青城 332020;2 南昌大学第二附属医院 肝胆外科, 南昌 330000)
目的系统评价术前外周血血小板/淋巴细胞比值(PLR)对肝细胞癌(HCC)患者预后的影响。方法计算机检索Medline、EMBASE、Cochrane Library、中国知网、中国生物医学文献数据库、维普及万方数据库,收集关于术前PLR与HCC预后相关性的研究。检索时限截至2017年1月,由2名研究者根据纳入与排除标准对文献进行独立筛选、提取资料和评价质量后,采用RevMan5.3软件进行Meta分析,各研究间的异质性分析采用χ2检验。结果纳入符合标准的文献18篇,共4193例患者。Meta分析结果显示,高PLR组患者的总生存率明显低于低PLR组[HR=1.74,95%可信区间(95%CI): 1.42~2.14,P<0.001] ,高PLR组患者的无瘤生存率或无复发生存率明显低于低PLR组(HR=1.76, 95%CI: 1.56~1.98,P<0.001)。亚组分析结果显示,在种族(亚洲人、高加索人)、治疗方法(手术、化疗、综合治疗)、样本量(≥200、<200)、PLR截断值(≥150、<150)及NOS评分(≥7、<7)等方面,高PLR组患者均明显低于低PLR组(P值均<0.05)。结论术前外周血高PLR与HCC患者的不良预后密切相关,PLR可作为评价HCC患者预后的指标。
肝肿瘤; 血小板与淋巴细胞比值; 预后; Meta分析
肝细胞癌(HCC)是目前临床上最常见的恶性肿瘤之一,据统计,在全球范围内,每年大约有692 000例新发HCC,占癌症相关死亡的第3位[1]。尽管目前治疗HCC的手段多样,包括肝切除术、肝动脉化疗栓塞术、射频消融、肝移植及以索拉非尼为代表的靶向治疗药物等,其中肝切除和肝移植是主要的根治方法,但其总体生存率仍较低,主要由于术后较高的复发率和肝内转移[2]。因此,寻找有效的HCC预后指标,有助于实行个体化治疗,改善HCC患者的预后,也是目前临床上亟需解决的问题。
系统性炎症反应在肿瘤发生和发展中起重要作用[3]。近年来,一系列炎症因子如CRP、格拉斯哥预后评分、中性粒细胞与淋巴细胞比值、血小板与淋巴细胞比值(platelet lymphocyte ratio, PLR)和淋巴细胞与单核细胞比值被证实与肝癌、胰腺癌等多种实体肿瘤的预后相关[4-7]。PLR作为反映全身炎性反应严重程度的有效指标,已成为近年来的研究热点。研究[8]表明,血小板在炎症反应过程中发挥多种作用。血小板升高可通过促进新血管形成和黏附分子的产生而促进肿瘤的进展[9]。相反,淋巴细胞则是抗肿瘤免疫的重要组成部分,可释放一系列细胞因子,从而激活抗肿瘤免疫。此外,PLR升高与多种肿瘤患者的不良预后密切相关[10-12]。然而,PLR在HCC患者预后中的作用尚存在争议。一些研究[13-14]表明术前PLR并不能预测HCC患者的术后总生存率(overall survival, OS)和无复发生存率(recurrence-free survival, RFS)。因此,本研究旨在通过Meta分析明确术前外周血PLR与HCC患者预后的关系。
1 材料与方法
1.1 文献纳入与排除标准
1.1.1 纳入标准 (1)研究对象为经病理确诊的HCC患者;(2)涉及术前PLR与HCC预后关系的研究;(3)提供研究所需的预后指标:OS、无瘤生存率(disease-free survival, DFS)或RFS;(4)提供足够的数据直接获取或者间接计算出风险比(HR)及95%可信区间(95%CI);(5)提供PLR的截断值(cut-off值)。
1.1.2 排除标准 (1)综述、评论、病例报告及会议摘要;(2)研究未提供足够的数据计算HR及95%CI;(3)重复发表的文献。
1.2 检索策略 计算机检索Medline、EMBASE、Cochrane Library、中国知网、中国生物医学文献数据库、维普及万方数据库,收集2017年1月以前发表的关于术前PLR与HCC预后相关性的文献。英文检索词包括:“hepatocellular carcinoma” or “HCC” or “liver cancer” or “liver tumor” or “liver neoplasms” or “liver cell carcinoma”, “platelet lymphocyte ratio” or “PLR” or “platelet to lymphocyte ratio” or “platelet-lymphocyte ratio”, “prognostic” or “prognosis” or “survival” or “recurrence” or “outcome”;中文检索词包括:“肝癌”、“血小板与淋巴细胞比值”。检索遵循Cochrane Handbook,采用主题词与自由词相结合的方式。此外,通过参考文献手工检索相关文献。
1.3 资料提取 由2名研究者独立提取相关信息,并交叉核对结果。如遇分歧,通过协商解决。提取内容主要包括:研究的基本信息(第一作者、发表日期、研究设计、研究地区、研究人群的种族、分析方法)、研究对象特征(样本量、年龄、性别、肿瘤分期、治疗方法、PLR截断值、随访时间)以及结局指标(OS、DFS和RFS的HR及其95%CI)。
1.4 文献质量评价 参照纽卡斯尔-渥太华量表 (Newcastle-Ottawa scale, NOS) 对文献的质量进行评价。包括研究对象选择(0~4分)、组间可比性(0~2分)和结果评价(0~3分)3个部分,共计9分。NOS量表评分≥7分为高质量研究。2名研究者独立进行质量评价,如遇分歧则通过讨论或第3名研究者评价。
1.5 统计学方法 采用RevMan5.3软件进行Meta分析。分析各研究间的异质性采用χ2检验,如研究结果间无异质性(P>0.05,I2<50%),采用固定效应模型;如研究结果间存在异质性(P<0.05,I2>50%),采用随机效应模型,并探索其异质性的来源,必要时行亚组分析或敏感性分析。对于HR及95%CI的获取,通过从纳入研究中直接获取或根据Kaplan-Meier生存曲线计算[15-16];采用log(HR)及标准误合并HR。当纳入的研究较多时(>11篇),通过漏斗图检验发表偏倚。
2 结果
2.1 文献纳入结果 初步检出相关文献119篇。通过剔除重复文献、阅读文题、摘要以及全文后,最终纳入18篇文献[14,17-33],其中英文文献17篇,中文文献1篇。文献筛选情况详见图1。
2.2 纳入文献的基本特征 纳入的18篇文献共包含4193例HCC患者,样本量在80~434不等。发表年限主要为2012年-2016年,12篇来自中国,2篇来自英国,2篇来自美国,1篇来自日本,1篇来自新加坡。18篇文献中,17篇文献评价了PLR与OS的关系,10篇文献评价了PLR与DFS/RFS的关系。各项研究中的PLR截断值在87.87~300不等。在方法学质量方面,NOS评分≥7分10篇,<7分7篇。纳入研究的基本特征及质量评价见表1。
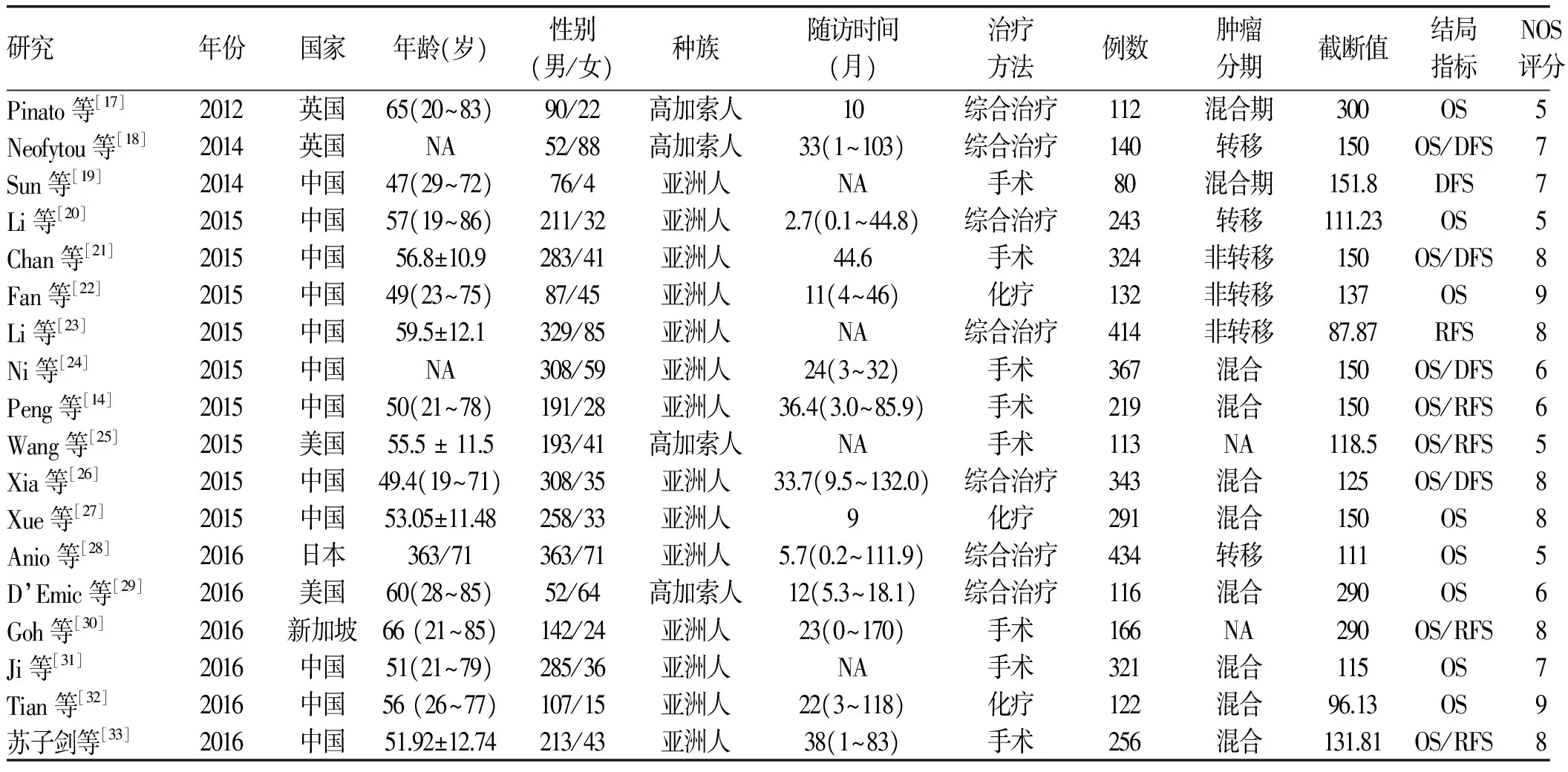
表1 纳入文献的一般特征
注:NA,未提供

图1 文献筛选流程图
2.3 Meta分析结果
2.3.1 HCC患者PLR和OS的相关性 共有17篇文献[14,17-22,24-33]报道了外周血PLR与HCC患者OS的数据,共纳入3779例HCC患者。由于各研究结果间存在明显的异质性(I2=87%,P<0.001),采用随机效应模型对数据进行合并。结果显示:高PLR组患者的OS明显低于低PLR组(HR=1.74,95% CI:
1.42~2.14,P<0.001)(图2)。为了探索异质性的来源,对种族、治疗方法、样本量、不同研究的PLR截断值以及NOS评分进行了亚组分析。结果显示,不论种族(亚洲人、高加索人)、治疗方法(手术、化疗、综合治疗)、样本量(≥200、<200)、PLR截断值(≥150、<150)及NOS评分(≥7、<7),高PLR组患者OS均明显低于低PLR组(P值均<0.05)(表2)。
2.3.2 HCC患者PLR和DFS/RFS的相关性 共有10篇文献[14, 18, 19, 21, 23-26, 30, 33]报道了外周血PLR与HCC患者DFS/RFS的数据。各研究结果间无明显异质性(I2=25%,P=0.21),采用固定效应模型对数据进行合成。结果显示:高PLR组患者的DFS/RFS明显低于低PLR组(HR=1.76,95%CI:1.56~1.98,P<0.001)(图3)。
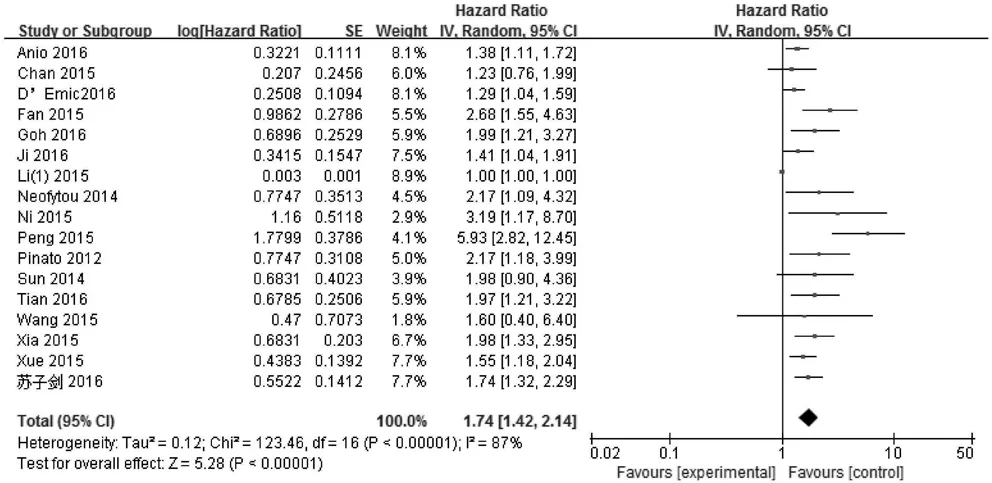
图2 PLR与HCC患者OS关系的Meta分析森林图
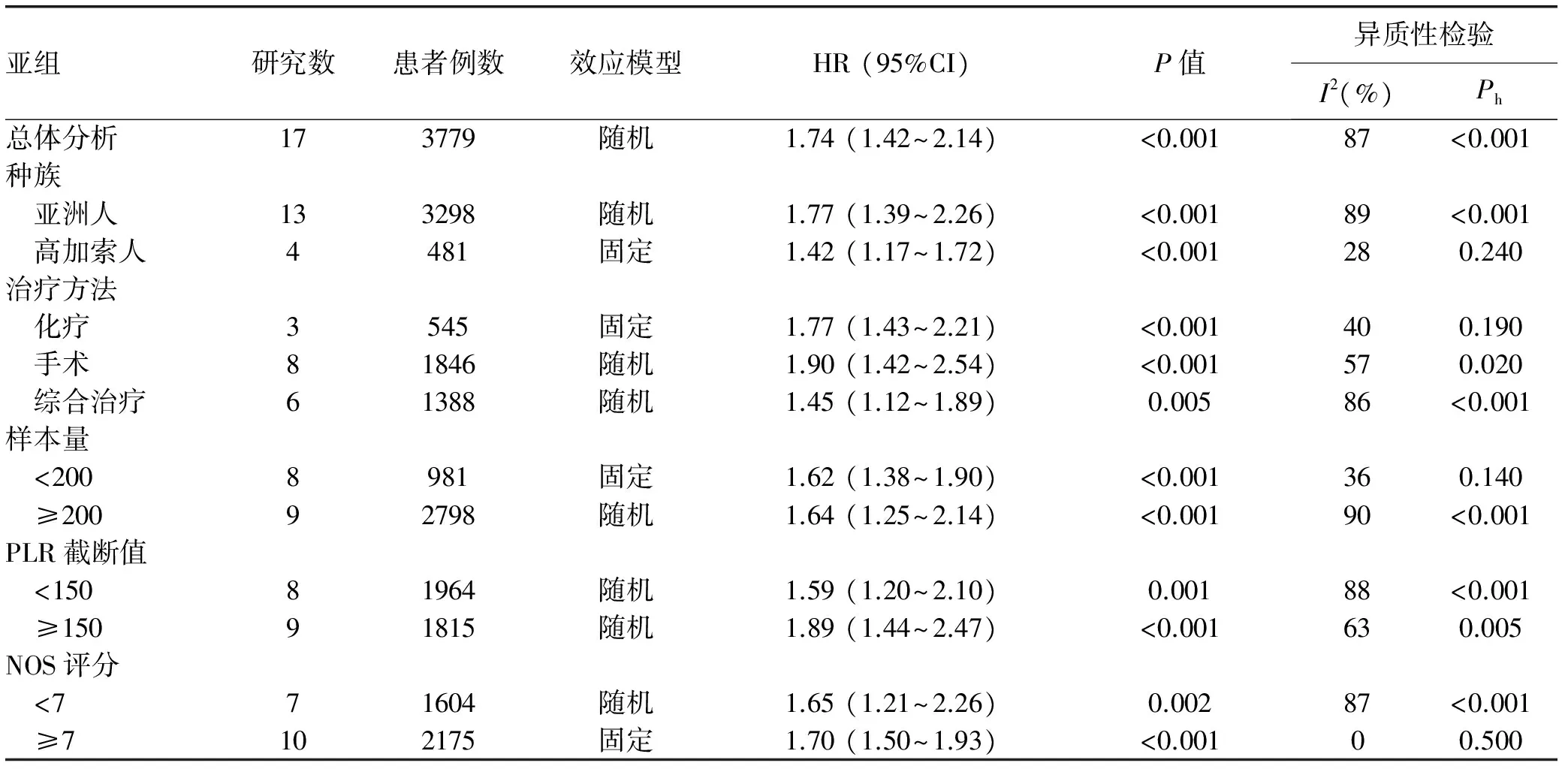
亚组研究数患者例数效应模型HR(95%CI)P值异质性检验I2(%)Ph总体分析173779随机1.74(1.42~2.14)<0.00187<0.001种族 亚洲人133298随机1.77(1.39~2.26)<0.00189<0.001 高加索人4481固定1.42(1.17~1.72)<0.001280.240治疗方法 化疗3545固定1.77(1.43~2.21)<0.001400.190 手术81846随机1.90(1.42~2.54)<0.001570.020 综合治疗61388随机1.45(1.12~1.89)0.00586<0.001样本量 <2008981固定1.62(1.38~1.90)<0.001360.140 ≥20092798随机1.64(1.25~2.14)<0.00190<0.001PLR截断值 <15081964随机1.59(1.20~2.10)0.00188<0.001 ≥15091815随机1.89(1.44~2.47)<0.001630.005NOS评分 <771604随机1.65(1.21~2.26)0.00287<0.001 ≥7102175固定1.70(1.50~1.93)<0.00100.500

图3 PLR与HCC患者DFS或RFS关系的Meta分析森林图
2.4 敏感性分析和发表偏倚 为了评价单个研究对整体结果的影响,进行了敏感性分析,即每次剔除一个研究,并观察其是否会影响整体结果。结果显示,没有研究会显著影响整体结果,证实结果具有稳定性。对OS进行漏斗图分析,图像左右不对称。提示纳入的研究潜在发表偏倚的风险较大(图4)。

图4 HCC患者OS的发表偏倚漏斗图
3 讨论
炎症是肿瘤的十大特征之一。肿瘤相关炎性细胞作为肿瘤微环境的构成因素之一,能够促进肿瘤细胞增殖、侵袭及转移,在肿瘤发生发展中起着重要作用。肿瘤相关炎性细胞的改变反映了机体对肿瘤引起的炎性反应的程度,而较高的全身炎性反应往往是预后不良的标志[3]。HCC已被证实为一种炎症诱导的肿瘤,约80%的HCC与慢性HBV或HCV感染有关[34],其发生过程主要包括3个阶段,即肝炎、肝硬化和HCC。目前认为,肿瘤大小、肿瘤浸润深度(T分期)、淋巴结情况(N分期)、TNM 分期、肿瘤分化程度、肿瘤切缘和血清AFP均是HCC预后的影响因素。然而,大部分评价指标均取决于HCC术后的病理结果,因此,目前的研究重点是试图通过术前发现新的标志物来预测HCC患者预后。
研究表明,术前高PLR与HCC患者的不良预后和临床病理特征密切相关。Tian等[32]研究表明术前PLR水平升高是HBV相关HCC患者的低OS的独立预测因子。同样,Fan等[22]发现高PLR与经肝动脉化疗栓塞术治疗的HCC患者的不良预后和转移明显相关。此外,由于PLR只需血常规结果即可计算得出,具有廉价、更稳定及可重复性等特点,因此,有望成为判断HCC预后的标志物和治疗的靶点。本研究首次探索了术前PLR与HCC患者预后的相关性。
本研究纳入18篇文献共4193例HCC患者。结果表明术前高PLR与HCC患者的低OS和DFS/RFS密切相关。亚组分析显示,不论种族、治疗方法、样本量、PLR截断值及NOS评分,与低PLR的HCC患者相比,高PLR往往预示着不良的OS。
高PLR和HCC不良预后的具体机制尚不清楚。然而,越来越多的证据表明全身性炎症通过遗传突变、基因组不稳定性、表观遗传修饰、肿瘤转移、癌细胞增殖、血管生成和血源性转移在肿瘤发生和进展中发挥重要作用[35-36]。癌症相关炎症可通过募集免疫抑制细胞如调节性T淋巴细胞和骨髓衍生的抑制细胞来抑制抗肿瘤免疫,导致肿瘤进展[37]。大量研究[38]表明微环境的炎症可影响肿瘤的细胞增殖和存活。由于大多数HCC患者与慢性HBV或HCV感染有关,因此,患者会经历慢性的炎症过程。PLT作为细胞因子的重要来源,可以保护肿瘤细胞免受自然杀伤介导的裂解,从而促进肿瘤的转移[39]。此外,血小板衍生生长因子、碱性成纤维细胞生长因子和肝细胞生长因子可以增强肿瘤细胞的转移能力[40]。相反,淋巴细胞在抗肿瘤免疫应答中发挥重要作用。肿瘤浸润淋巴细胞作为重要的免疫细胞,在抗肿瘤免疫应答中发挥重要作用[41]。在HCC患者中,CD4+T淋巴细胞浸润增加与较低的复发率和更好的预后相关[42]。然而,Schreiber等[43]报道了肿瘤细胞可以通过分泌免疫抑制性细胞因子如血管内皮生长因子、TGFβ、IL-10来减少细胞毒性T淋巴细胞浸润。总之,PLR联合PLT和淋巴细胞的效应可以预测HCC患者的预后。
然而,本研究仍存在一定的局限性:(1)存在显著的异质性,对种族、治疗方法、样本量、PLR截断值及NOS评分进行亚组分析,未找出异质性的来源,因此,这种异质性的来源可能是多种因素的联合效应;(2)不同研究中PLR的截断值不同,不能达成统一的标准,可能会影响本研究的结果;(3)所有纳入研究均为回顾性研究,可能存在一定的偏倚风险; (4)部分研究无法直接获取HR及95%CI,而是通过其生存曲线提取HR估计。
综上,术前外周血高PLR与HCC患者的不良预后密切相关。因此,术前PLR可作为判断HCC预后的潜在标志物。然而,鉴于此结论仍存在一定的局限性,在今后的研究中,还需设计完善、前瞻性大样本的研究来进一步证实。
[1] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1): 11-30.
[2] BRUIX J, SHERMAN M. Management of hepatocellular carcinoma: an update[J]. Hepatology, 2011, 53(3): 1020-1022.
[3] GRIVENNIKOV SI, GRETEN FR, KARIN M. Immunity, inflammation, and cancer[J]. Cell, 2010, 140(6): 883-899.
[4] ZHANG TT, ZHAO XQ, LIU Z, et al. Preoperative neutrophil-lymphocyte ratio is an independent prognostic factor for hepatocellular carcinoma after radical resection[J]. J Clin Hepatol, 2015, 31(6): 927-931. (in Chinese) 张婷婷, 赵向前, 刘哲, 等. 术前中性粒细胞与淋巴细胞比值对行根治性切除术的肝细胞癌患者预后的影响[J]. 临床肝胆病杂志, 2015, 31(6): 927-931.
[5] WANG XB, GAO FY, LIU Y. Neutrophil-lymphocyte ratio: a novel predictor of clinical outcome of patients with hepatocellular carcinoma[J]. J Clin Hepatol, 2016, 32(4): 649-652. (in Chinese) 王宪波, 高方媛, 刘尧. 中性粒细胞与淋巴细胞比值:一项评价肝细胞癌患者预后的新指标 [J]. 临床肝胆病杂志, 2016, 32(4): 649-652.
[6] SZKANDERA J, STOTZ M, ABSENGER G, et al. Validation of C-reactive protein levels as a prognostic indicator for survival in a large cohort of pancreatic cancer patients[J]. Br J Cancer, 2014, 110(1): 183-188.
[7] QI Q, GENG Y, SUN M, et al. Clinical implications of systemic inflammatory response markers as independent prognostic factors for advanced pancreatic cancer[J]. Pancreatology, 2015, 15(2): 145-150.
[8] LABELLE M, BEGUM S, HYNES RO. Direct signaling between platelets and cancer cells induces an epithelial-mesenchymal-like transition and promotes metastasis[J]. Cancer Cell, 2011, 20(5): 576-590.
[9] LABELLE M, BEGUM S, HYNES RO. Platelets guide the formation of early metastatic niches[J]. Proc Natl Acad Sci U S A, 2014, 111(30): e3053-e3061.
[10] GU X, GAO XS, CUI M, et al. Clinicopathological and prognostic significance of platelet to lymphocyte ratio in patients with gastric cancer[J]. Oncotarget, 2016, 7(31): 49878-49887.
[11] ASANO Y, KASHIWAGI S, ONODA N, et al. Platelet-lymphocyte ratio as a useful predictor of the therapeutic effect of neoadjuvant chemotherapy in breast cancer[J]. PLoS One, 2016, 11(7): e0153459.
[12] YOU J, ZHU GQ, XIE L, et al. Preoperative platelet to lymphocyte ratio is a valuable prognostic biomarker in patients with colorectal cancer[J]. Oncotarget, 2016, 7(18): 25516-25527.
[13] KABIR T, MOHD NOOR NA, JUNNARKAR SP, et al. Does preoperative platelet-lymphocyte ratio or prognostic nutritional index predict survival after surgical resection for hepatocellular carcinoma?[J]. HPB, 2016, 18: e709-e710.
[14] PENG W, LI C, ZHU WJ, et al. Prognostic value of the platelet to lymphocyte ratio change in liver cancer[J]. J Surg Res, 2015, 194(2): 464-470.
[15] PARMAR MK, TORRI V, STEWART L. Extracting summary statistics to perform meta-analyses of the published literature for survival endpoints[J]. Stat Med, 1998, 17(24): 2815-2834.
[16] TIERNEY JF, STEWART LA, GHERSI D, et al. Practical methods for incorporating summary time-to-event data into meta-analysis[J]. Trials, 2007, 8: 16.
[17] PINATO DJ, STEBBING J, ISHIZUKA M, et al. A novel and validated prognostic index in hepatocellular carcinoma: the inflammation based index (IBI)[J]. J Hepatol, 2012, 57(5): 1013-1020.
[18] NEOFYTOU K, SMYTH EC, GIAKOUSTIDIS A, et al. Elevated platelet to lymphocyte ratio predicts poor prognosis after hepatectomy for liver-only colorectal metastases, and it is superior to neutrophil to lymphocyte ratio as an adverse prognostic factor[J]. Med Oncol, 2014, 31(10): 239.
[19] SUN Q, JIAO SC, WU JY, et al. Pretreatment haematological laboratory values: the new prognostic factors in patients undergoing hepatectomy for hepatocellular carcinoma[J]. Biomed Res, 2014, 25(4): 580-587.
[20] LI X, CHEN ZH, XING YF, et al. Platelet-to-lymphocyte ratio acts as a prognostic factor for patients with advanced hepatocellular carcinoma[J]. Tumour Biol, 2015, 36(4): 2263-2269.
[21] CHAN AW, CHAN SL, WONG GL, et al. Prognostic Nutritional Index (PNI) predicts tumor recurrence of very early/early stage hepatocellular carcinoma after surgical resection[J]. Ann Surg Oncol, 2015, 22(13): 4138-4148.
[22] FAN W, ZHANG Y, WANG Y, et al. Neutrophil-to-lymphocyte and platelet-to-lymphocyte ratios as predictors of survival and metastasis for recurrent hepatocellular carcinoma after transarterial chemoembolization[J]. PLoS One, 2015, 10(3): e0119312.
[23] LI X, HAN Z, CHENG Z, et al. Clinical significance of preoperative platelet-to-lymphocyte ratio in recurrent hepatocellular carcinoma after thermal ablation: a retrospective analysis[J]. Int J Hyperthermia, 2015, 31(7): 758-763.
[24] NI XC, YI Y, FU YP, et al. Prognostic value of the modified glasgow prognostic score in patients undergoing radical surgery for hepatocellular carcinoma[J]. Medicine(Baltimore), 2015, 94(36): e1486.
[25] WANG Q, BLANK S, FIEL MI, et al. The severity of liver fibrosis influences the prognostic value of inflammation-based scores in hepatitis B-associated hepatocellular carcinoma[J]. Ann Surg Oncol, 2015, 22 (Suppl 3): s1125-s1132.
[26] XIA W, KE Q, WANG Y, et al. Predictive value of pre-transplant platelet to lymphocyte ratio for hepatocellular carcinoma recurrence after liver transplantation[J]. World J Surg Oncol, 2015, 13: 60.
[27] XUE TC, JIA QA, GE NL, et al. The platelet-to-lymphocyte ratio predicts poor survival in patients with huge hepatocellular carcinoma that received transarterial chemoembolization[J]. Tumour Biol, 2015, 36(8): 6045-6051.
[28] AINO H, SUMIE S, NIIZEKI T, et al. The systemic inflammatory response as a prognostic factor for advanced hepatocellular carcinoma with extrahepatic metastasis[J]. Mol Clin Oncol, 2016, 5(1): 83-88.
[29] D′EMIC N, ENGELMAN A, MOLITORIS J, et al. Prognostic significance of neutrophil-lymphocyte ratio and platelet-lymphocyte ratio in patients treated with selective internal radiation therapy[J]. J Gastrointest Oncol, 2016, 7(2): 269-277.
[30] GOH BK, KAM JH, LEE SY, et al. Significance of neutrophil-to-lymphocyte ratio, platelet-to-lymphocyte ratio and prognostic nutrition index as preoperative predictors of early mortality after liver resection for huge (>/=10 cm) hepatocellular carcinoma[J]. J Surg Oncol, 2016, 113(6): 621-627.
[31] JI F, LIANG Y, FU SJ, et al. A novel and accurate predictor of survival for patients with hepatocellular carcinoma after surgical resection: the neutrophil to lymphocyte ratio (NLR) combined with the aspartate aminotransferase/platelet count ratio index (APRI)[J]. BMC Cancer, 2016, 16: 137.
[32] TIAN XC, LIU XL, ZENG FR, et al. Platelet-to-lymphocyte ratio acts as an independent risk factor for patients with hepatitis B virus-related hepatocellular carcinoma who received transarterial chemoembolization[J]. Eur Rev Med Pharmacol Sci, 2016, 20(11): 2302-2309.
[33] SU ZJ, ZHAI JW, PAN QX, et al. Relationship between platelet-to-lymphocyte ratio and prognosis in patients with hepatocellular carcinom[J]. Chin J Gen Surg, 2016, 25(1): 12-18. (in Chinese) 苏子剑, 翟军伟, 潘群雄, 等. 术前血小板/淋巴细胞比值与肝癌预后的关系[J]. 中国普通外科杂志, 2016, 25(1): 12-18.
[34] PERZ JF, ARMSTRONG GL, FARRINGTON LA, et al. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide[J]. J Hepatol, 2006, 45(4): 529-538.
[35] SIDERAS K, KWEKKEBOOM J. Cancer inflammation and inflammatory biomarkers: can neutrophil, lymphocyte, and platelet counts represent the complexity of the immune system?[J]. Transpl Int, 2014, 27(1): 28-31.
[36] MANTOVANI A, ALLAVENA P, SICA A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-444.
[37] WANG G, LU X, DEY P, et al. Targeting YAP-dependent MDSC infiltration impairs tumor progression[J]. Cancer Discov, 2016, 6(1): 80-95.
[38] MANTOVANI A, ROMERO P, PALUCKA AK, et al. Tumour immunity: effector response to tumour and role of the microenvironment[J]. Lancet, 2008, 371(9614): 771-783.
[39] NIESWANDT B, HAFNER M, ECHTENACHER B, et al. Lysis of tumor cells by natural killer cells in mice is impeded by platelets[J]. Cancer Res, 1999, 59(6): 1295-1300.
[40] SIERKO E, WOJTUKIEWICZ MZ. Platelets and angiogenesis in malignancy[J]. Semin Thromb Hemost, 2004, 30(1): 95-108.
[41] MAN YG, STOJADINOVIC A, MASON J, et al. Tumor-infiltrating immune cells promoting tumor invasion and metastasis: existing theories[J]. J Cancer, 2013, 4(1): 84-95.
[42] WADA Y, NAKASHIMA O, KUTAMI R, et al. Clinicopathological study on hepatocellular carcinoma with lymphocytic infiltration[J]. Hepatology, 1998, 27(2): 407-414.
[43] SCHREIBER RD, OLD LJ, SMYTH MJ. Cancer immunoediting: integrating immunity's roles in cancer suppression and promotion[J]. Science, 2011, 331(6024): 1565-1570.
引证本文:LI ZB, XIAO DS, SONG W. Prognostic value of preoperative platelet-to-lymphocyte ratio in patients with hepatocellular carcinoma: a Meta-analysis[J]. J Clin Hepatol, 2017, 33(9): 1734-1739. (in Chinese) 李志斌, 肖冬生, 宋伟. 术前血小板与淋巴细胞比值对肝细胞癌患者预后影响的Meta分析[J]. 临床肝胆病杂志, 2017, 33(9): 1734-1739.
(本文编辑:王 莹)
Prognosticvalueofpreoperativeplatelet-to-lymphocyteratioinpatientswithhepatocellularcarcinoma:aMeta-analysis
LIZhibin,XIAODongsheng,SONGWei.
(DepartmentofGeneralSurgery,GongqingchengPeople′sHospital,Gongqingcheng332020,China)
ObjectiveTo systematically investigate the prognostic value of preoperative platelet-to-lymphocyte ratio (PLR) in patients with hepatocellular carcinoma (HCC).MethodsMedline, EMBASE, Cochrane Library, CNKI, CBM, VIP, and Wanfang Data were searched for studies assessing the association between preoperative PLR and prognosis of HCC published up to January 2017. Two reviewers independently screened the articles according to the inclusion and exclusion criteria, extracted data, and assessed methodological quality, and then a meta-analysis was performed using RevMan 5.3 software. The chi-square test was used for the analysis of heterogeneity between studies.ResultsA total of 18 articles with 4193 patients were included. The meta-analysis showed that compared with those with low PLR, patients with high PLR had significantly lower overall survival (OS) rate (hazard ratio [HR]=1.74, 95% confidence interval [CI] 1.42-2.14,P<0.001) and disease-free survival rate or relapse-free survival rate (HR=1.76, 95%CI: 1.56-1.98,P<0.001). The subgroup analysis revealed that patients with high PLR had significantly shorter OS than those with low PLR, regardless of race (Asian or Caucasian), treatment method (surgery, chemotherapy, or multimodality therapy), sample size (≥200 or <200), cut-off value of PLR (≥150 or <150), and NOS score (≥7 or <7) (allP<0.05).ConclusionHigh preoperative PLR is closely associated with poor prognosis of HCC patients, suggesting that PLR might be a prognostic factor in HCC patients.
liver neoplasms; platelet to lymphocyte ratio; prognosis; Meta-analysis
10.3969/j.issn.1001-5256.2017.09.021
2017-03-27;
:2017-04-13。
李志斌(1979-),男,主治医师,主要从事普通外科疾病诊治方面的研究。
肖冬生,电子信箱:419252594@qq.com。
R735.7
:A
:1001-5256(2017)09-1734-06

