非甾体油菜素内酯类化合物NSBR1的开发
筱 禾 编译
非甾体油菜素内酯类化合物NSBR1的开发
筱 禾 编译
(上海市农药研究所,上海 200032)
油菜素内酯(BL)(图1中的1)是植物甾体激素,1979年其化学结构被鉴定。BL及其相关化合物被归类为油菜素甾醇(BRs)。BRs以低浓度广泛存在于植物中,在植物生长发育中发挥着重要作用。迄今为止,已经鉴定了70多个天然BRs,一些BRs已经被化学合成。BRs可引发植物广泛的生理和形态反应:茎伸长,叶弯曲和偏上性生长,诱导乙烯生物合成,活化质子泵,核酸和蛋白质的生物合成,碳水化合物同化和分配的调控以及光合作用的激活。由王志勇等首先鉴定出的BR受体被命名为BR敏感受体激酶1(BRI1),通过X射线晶体结构分析了BRI1的三维结构。同期报道了BRs信号传递所需的体细胞胚发生受体激酶3(SERK3),被称为BRI1相关受体激酶1(BAK1)。几年前,首次公布了拟南芥BRI1-BL-SERK1复合物的晶体结构。
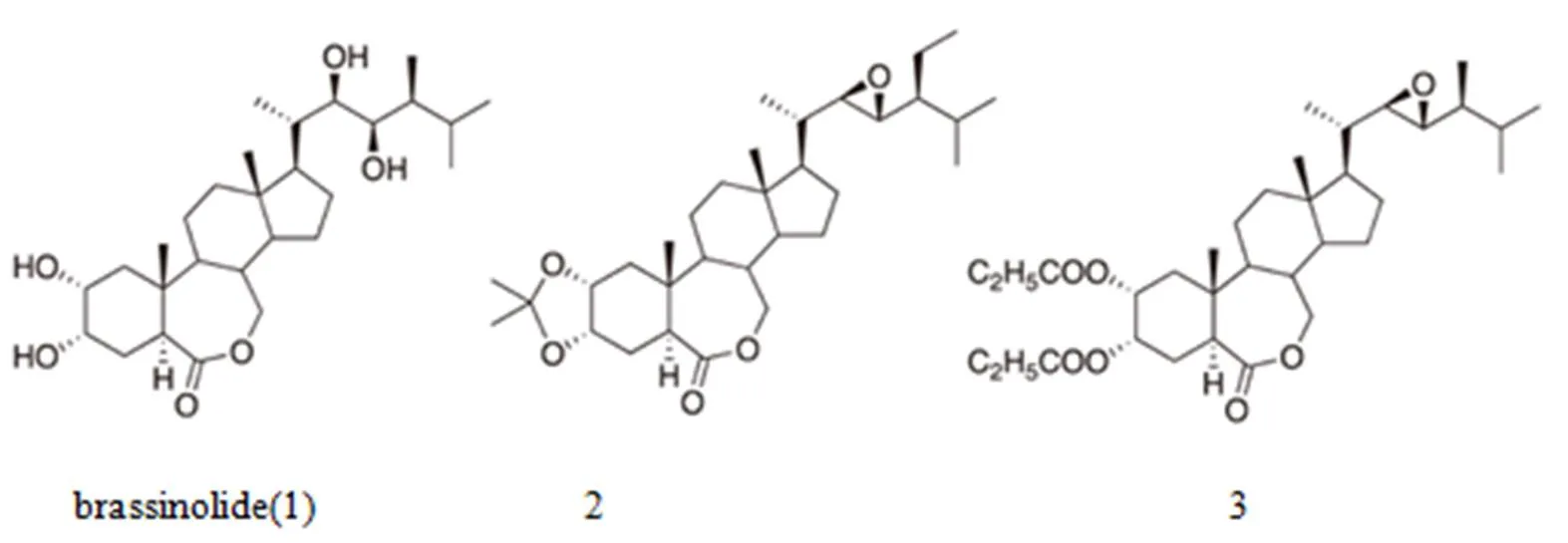
图1 农用BL(1)及BRs的结构
由于BRs可以保护植物免受高盐、高温、重金属和干旱引起的各种非生物胁迫以及细菌、病毒、真菌、寄生虫和昆虫引起的生物胁迫,仿BRs作用的化合物可用作农用化学品。BRs增强作物对除草剂的耐受性及医疗中应用的可能性也引人关注。20世纪后期的若干研究报告表明,BRs将在不久的将来投入实际运用。一些农药公司已经致力于BR(1)、24-BL和(22,23)-28-homo BL等BRs的实际应用研究,但其效果和稳定性降低了。之后,选择化合物2和3(TS303)等改良BL类似物用于实际应用。含有TS303和二氢茉莉酸丙酯的TS303和TNZ303液剂可显著提高作物产量。TNZ303喷雾处理水稻种子可提高产量。俄罗斯和波兰对喷雾施用于小麦、马铃薯和甜菜进行了深入研究。但在过去20年间仅发表了几篇关于BRs应用的科研论文。BRs可用于植物保护和增产,然而,BRs的基本结构(甾体骨架)可能影响BRs在农业中的实际应用。
非甾体类昆虫蜕皮激素激动剂的发现为新颖杀虫剂的开发开辟了道路,因此甾体转化为非甾体十分引人关注。大约20年前,合成了非甾体类BL的化合物,并通过水稻叶倾角测定法(rice lamina inclination assay,RLIA)测定了它们的活性。但这种活性不合情理,所以Takimoto合成了已报道化合物,发现其对经BL生物合成抑制剂——brassinazole (Brz)处理的独行菜无活性。早期利用计算机筛选搜索非甾体类BL化合物,并对筛选的化合物进行RLIA检测。遗憾的是没有发现激动剂化合物,但发现了3种拮抗剂(图2中的4-6)。本研究旨在获得一种新型非甾体BL激动剂。在本研究中,通过使用对接模拟和分子动力学(MD)等计算机技术使BL拮抗剂化合物合理转化为激动剂。对设计合成的化合物进行生物测定以检测BL活性。检测了拟南芥中响应BL处理的标记基因的表达。

图2 BL拮抗剂的结构
1 材料与方法
1.1 化学药剂及其合成
化合物4和6‒8(图2和图3)为实验室自制样品。根据图4的合成路线,由哌嗪和取代苯甲酸化学合成了新颖的-苯甲酰基-'-苯基哌嗪(NBNPP)类似物9-12。通过1H和13C NMR(BRUKER AVANCE 400)以及高分辨质谱(HRMS)鉴定新合成的化合物结构。京都大学合成化学与生物化学系Thermo Fisher Scientific EXACTIVE光谱仪记录HRMS。使用Biotage SNAP Ultra进行色谱纯化。
1.1.1 3,4-二氟--甲氧基--甲基苯甲酰胺
将3,4-二氟苯甲酸(2.5 g,15.8 mmol)和,-二甲基羟胺盐酸盐(2.3 g,22.8 mmol)溶于无水二氯甲烷(100 mL)中,然后加入DCC(3.2 g,16.1 mmol)。在室温下搅拌5 h后,加入水(40 mL)和氯仿(40 mL)。过滤除去固体物质。水层用氯仿(40 mL)萃取3次。合并氯仿层,用50 mL饱和NaCl(盐水)洗涤。将氯仿层用无水Na2SO4干燥,蒸发得到淡黄色油状物(5.82 g)。NMR(400 MHz, CDCl3)7.53(m, 1H), 7.51(m, 1H), 7.21(m, 1H), 3.55(s, 3H), 3.37(m, 2H).
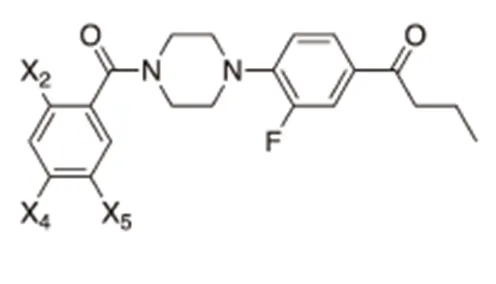
图3 N-苯甲酰基-N′-苯基哌嗪类(NBNPPs)的结构
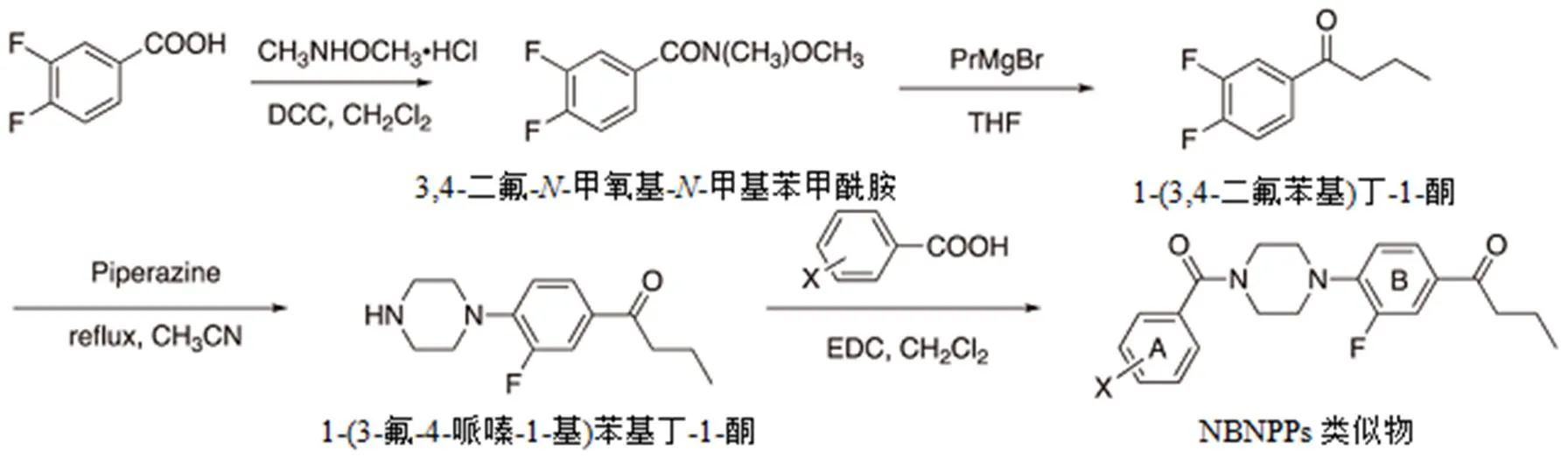
图4 NBNPPs类似物9‒12的合成路线
1.1.2 1-(3,4-二氟苯基)丁-1-酮
在Ar气保护下,将3,4-二氟--甲氧基--甲基苯甲酰胺(1.0 g,6.3 mmol)溶于10 mL无水THF中。向THF (2 mL)中滴加2 M PrMgBr,在室温下搅拌2 h。加入饱和NH4Cl水溶液(10 mL)淬灭反应并搅拌30 min。向混合物中加入水(40 mL)和氯仿(20 mL)。水层用氯仿(30 mL)萃取3次。合并的氯仿层用饱和NaCl(30 mL)洗涤,用无水Na2SO4干燥。过滤除去Na2SO4,蒸发得到粗的淡黄色油状物。将该油状物通过色谱法分离(0.87 g,79%产率)。NMR (400 MHz, CDCl3), 7.74 (m, 1H), 7.72 (m, 1H), 7.25 (m, 1H), 2.90 (t, 2H), 1.75 (sextet, 2H), 1.00 (t, 3H).
1.1.3 1-(3-氟-4-哌嗪-1-基)苯基丁-1-酮
将1-(3,4-二氟苯基)丁-1-酮(0.62 g,3.4 mmol)和哌嗪(1.0 g,11.6 mmol)溶于乙腈(2 mL)中,回流过夜。向反应混合物中加入水(30 mL)和乙酸乙酯(20 mL),水层用乙酸乙酯(20 mL)萃取3次。合并有机层,用饱和NaCl(30 mL)洗涤,用无水Na2SO4干燥。除去Na2SO4后,减压浓缩滤液,得到淡黄色油状物(0.64 g,收率76%)。NMR (400 MHz, CDCl3), 7.66 (dd, 1H), 7.61 (dd, 1H), 6.91 (t, 1H), 3.18 (m, 4H), 3.04 (m, 4H), 2.86 (t, 2H), 1.74 (sextet, 2H), 1.66 (bs, 2H), 0.99 (t, 3H).
1.1.4-(3,4-二羟基苯甲酰基)-'-(4-丁酰基-2-氟苯基)吡嗪(9)
将3,4-二羟基苯甲酸(0.1 g,0.64 mmol)和1-(3,4-二氟苯基)丁-1-酮(0.1 g,0.40 mmol)溶于5 mL无水二氯甲烷中,随后加入EDC[1-乙基-3-(3-二甲基氨基羰基)碳二亚胺盐酸盐;0.2 g,0.8 mmol]。在室温下搅拌混合物2 h后,加入水(10 mL)和氯仿(40 mL),水层用5 mL氯仿萃取3次。合并后氯仿层用饱和NaCl洗涤,用Na2SO4干燥。蒸发溶剂后,残余物用己烷/氯仿结晶,得到无色固体(14 mg,收率9%),熔点147~148 ºC。NMR (400 MHz, CDCl3), 7.71 (dd, 1H), 7.67 (dd, 1H), 7.04 (s, 1H), 6.91 (t, 1H), 3.85 (bs, 4H), 3.23 (bs, 4H), 2.88 (t, 2H), 1.76 (q, 2H), 1.72 (bs, 2H), 0.99 (t, 3H). HRMS/C21H23FN2O4[M-H]-:计算值:385.1564,实测值:385.1563。
可由相应的苯甲酸类——苯甲酸、3,4-二甲基苯甲酸、3-乙酰氨基-4-甲氧基苯甲酸合成其他3种哌嗪衍生物(10-12)。
1.1.5-(4-乙酰氨基(acetlamino)-3-甲氧基苯甲酰基)-'-(4-丁酰基-2-氟苯基)吡嗪(10)
熔点155~156 ºC。NMR (400 MHz, CDCl3), 8.50 (d, 1H), 7.77 (s, 1H), 7.69 (dd, 1H), 7.64 (dd, 1H), 7.26 (m, 1H), 6.94 (m, 2H), 3.94 (s, 3H), 3.63-4.04 (s, 4H), 3.25 (s, 4H), 2.86 (t, 2H), 2.23 (s, 3H), 1.76 (q, 2H), 0.99 (t, 3H). HRMS/C24H28FN3O4[M+Na]+:计算值:464.1962,实测值:464.1950。
1.1.6-苯甲酰基-'-(4-丁酰基-2-氟苯基)吡嗪(11)
熔点95~96 ºC。NMR (400 MHz, CDCl3), 7.67 (dd, 1H), 7.63 (dd, 1H), 7.47 (s, 5H), 6.92 (t, 1H), 3.96 (bs, 2H), 3.93 (bs, 2H), 3.24 (bs, 4H), 2.86 (t, 3H), 1.74 (q, 2H), 0.99 (t, 3H). HRMS/C21H23FN2O2[M+H]+:计算值:355.1822,实测值:355.1812。
1.1.7-(3,4-二甲基苯甲酰基-'-(4-丁酰基-2-氟苯基)吡嗪(12)
熔点138~139 ºC。NMR (400 MHz, CDCl3), 7.67 (dd, 1H), 7.63 (dd, 1H), 7.22 (s, 1H), 7.16 (m, 2H), 6.92 (t, 3H), 3.92 (bs, 2H), 3.74 (bs, 2H), 3.25 (bs, 4H), 2.88 (t, 3H), 2.29 (s, 6H), 1.74 (q, 2H), 0.99 (t, 3H). HRMS/C23H27FN2O2[M+H]+:计算值:383.2135,实测值:383.2124。
1.2 生物测定
1.2.1 拟南芥下胚轴伸长测定
将拟南芥哥伦比亚生态型(Col-0)的种子浸入含有1% Triton X-100的70%乙醇溶液中30 min,然后移入99%乙醇中并搅拌1 min。用无菌滤纸吸除种子表面多余的乙醇。将灭菌的种子种植在含有0.9%琼脂、1.5%蔗糖和测试化合物的1/2 MS培养基中,在4 ℃下于黑暗条件下生长。静置2~3 d后,将种子在22 ℃光照下保持4 h(春化处理)。在22 ℃黑暗条件下生长7 d后,测定下胚轴的长度。运用Image J软件测量下胚轴长度。将测试化合物溶解于DMSO溶液(低于1% DMSO)加入培养基中。将部分(50 mg)植物储存于-80 ℃含有10 μL巯基乙醇的1 mL RLT缓冲液中。研磨冷冻的植物小块材料,使用RNeasy Plant Mini Kit(Qiagen)提取总RNA。使用PrimeScript(Takara)合成第一链cDNA,并将其用作定量RT-PCR模板,使用TaKaRa PrimeScript RT Reagent Kit进行RT-PCR。RT-PCR反应溶液(25 μL)由SYBR Premix Ex Taq II(12.5 μL)、无菌水(7.3 μL)、正向和反向引物(0.1 μL)及cDNA(2.5 μL)组成。以ACT2作为内对照。基因特异性引物见表1。

表1 基因特异性引物
1.2.2 水稻叶倾角测定
选用矮秆水稻(cv. Tan-Ginbozu)秧苗进行稻叶倾角测定,用于测定类BL活性。以2%NaClO水溶液对Tan-ginbozu种子进行灭菌处理,在30 ℃光照条件下于灭菌水中浸泡3 d。将发芽的水稻种子移植到1%琼脂培养基中,在30 ℃光照条件下培养3 d。在施用0.5 μL吲哚-3-乙酸(50 mM乙醇溶液)后,将试验化合物的乙醇溶液施用于秧苗的第二叶。以1μL乙醇和BL溶液(1 μM)处理分别作为阴性和阳性对照。
1.3 MD模拟
之前已报道了MD方法和配体-受体复合物的结合自由能计算。使用AMBER 14 MD package和AMBER Tools 15进行MD模拟。AMBER force field 14SB应用于配体分子的蛋白质和gaff。通过MM-PBSA(Molecular Mechanics Poisson-Boltzmann Surface Area)计算游离能作为ΔGmmpbsa,使用SZYBKI(Ver.1.8.0.1;OpenEye:Santa Fe,USA)的Freeform模块计算配体构象异构体熵。结合自由能ΔGbind校正为ΔGmmpbsa-TΔSligand。每个配体分子的构象集由OMEGA2(Ver.2.5.1.4)生成。移除配体分子BL,由2种晶体结构(PDB︰4LSX和PDB︰4LSA)构建受体蛋白复合物模型。为构建BRI1/SERK1复合体模型,4LSX链A(BRI1)被替换为4LSA,4LSX链C作为SERK1模型。使用OEDocking(Ver.3.2.0.2; OpenEye)的MAKE_RECEPTOR和FRED模块进行对接模拟。
2 结果与讨论
2.1 BL激动剂设计
用前期研究筛选出的14种化合物(包括化合物7、8)处理拟南芥进行生物测定。化合物5因数量不足无法测定。化合物4和6对拟南芥下胚轴伸长无影响。如图4所示,具有一个NBNPP基本结构的化合物7和8在100 μM时可显著抑制下胚轴伸长,效果与1 μM的Brz处理相当。其他筛选化合物在此项测定中无活性。
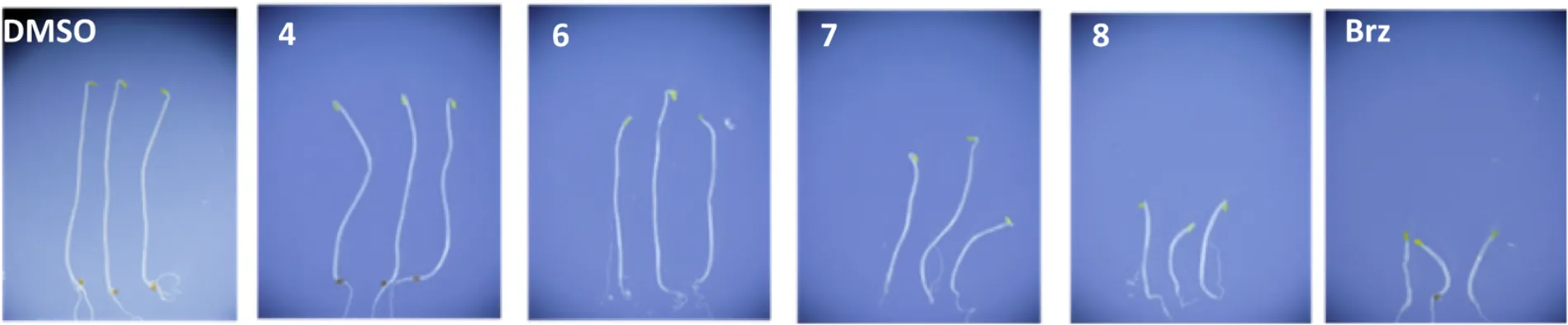
图5 候选化合物(100 μM)和Brz (1 μM)对拟南芥下胚轴伸长的影响
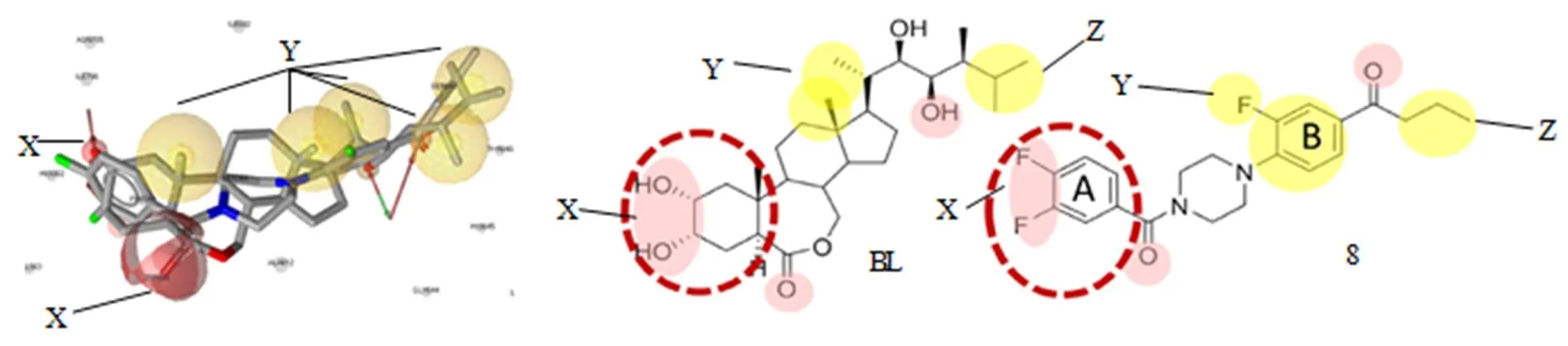
BL和化合物8的结构在前期计算机筛选中使用的药效团模型的叠合情况如图6所示。化合物8的A环F原子周围的X区域相当于BL和SERK1甾体A环的羟基间形成的氢键。化合物8的苯环和哌嗪环之间的羰基相当于BL甾体B环(内酯环)上的羰基。靠近化合物8的B环的另一个羰基氧相当于BL侧链的C-22上OH的氧。BL侧链C-18和C-21周围的Y区域具有疏水性相当于化合物8的氟苯基部分。化合物8的正丙基部分末端周围的其他区域等同于BL侧链异丙基基团末端周围的区域(Z)。
为了比较受体蛋白和配体分子间的相互作用,将BL和化合物8分别使用FRED(OpenEye)进行对接模拟,并使用MD/MM-PBSA计算结合自由能。如图6所示,检测到BL A环的OH和SERK1之间的氢键(HBs)(图7的左图),而拮抗化合物8(图7的中图)没有形成氢键(HB)。在BRI-BL-SERK1复合物(PDB:4LSX)的初始晶体结构中,这2个OH基团对BL与SERK1间的相互作用很重要。因此,用OH替代化合物8的F原子,获得化合物9,以模拟BL的A环部分,与受体对接。正如所预测的,在MD模拟之后,化合物9在OH和SERK1间形成HBs。SERK1的Phe和His残基参与初始晶体结构(4LSX)中BL的A环的2,3-(OH)2的HB形成,而MD后不同氨基酸残基(His、Val、Thr)参与新构建的BRI1/SERK1模型中的HB形成。在化合物9的嵌合模型中,参与HB形成3个氨基酸(Phe、Val、Thr)与BL略有不同,化合物8中没有观察到HBs。有趣的是,BRI1的Thr残基在BL和化合物9的复合物中均可形成HB。可形成HBs的这些氨基酸残基中,Phe和His位于邻近位置。表1为用MM-PBSA和Freeform(OpenEye)计算的候选化合物7-12的配体-受体结合ΔG值。尽管所有化合物的ΔG值均非负值,但化合物9的ΔG值是6个NBNPPs中最低的(表2)。
注:Y区域表示疏水特征,X区域表示静电相互作用特征。箭头表示受体/供体
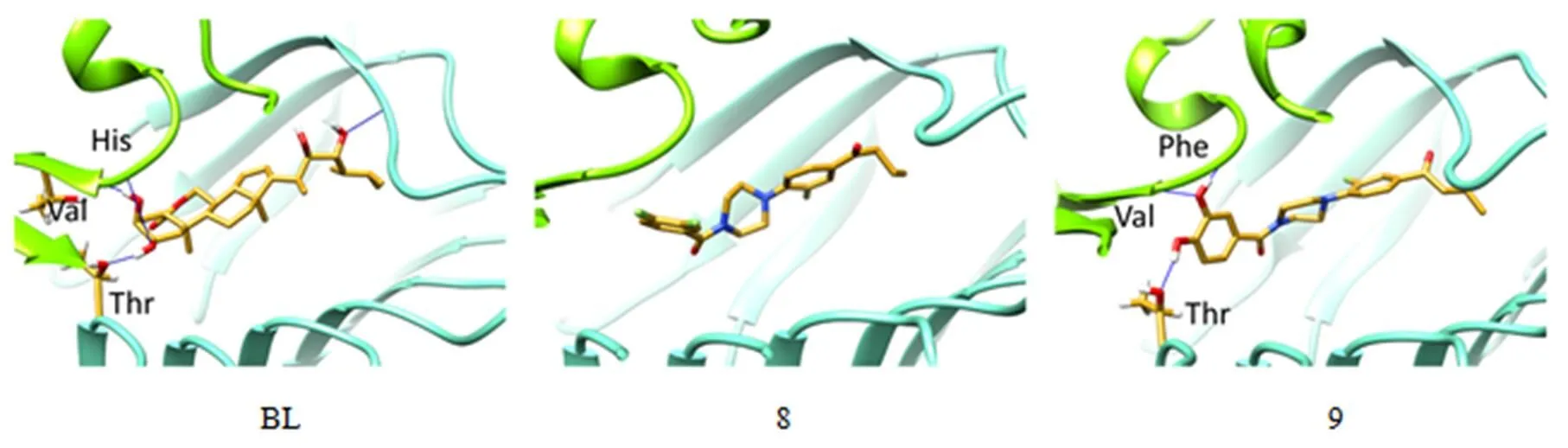
图7 BL及化合物8、9与BRI1/SERK1复合物嵌合模型(docking models)
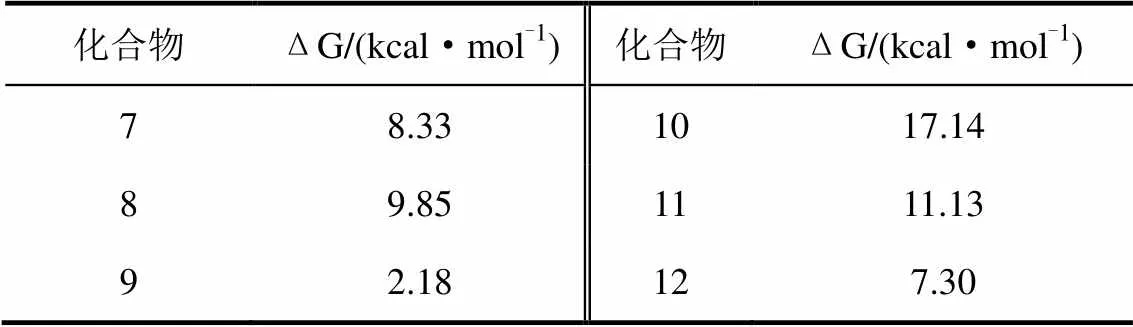
表2 根据MM-PBSA计算的NBNPPs的配体-受体结合能*
注:*ΔG:BL为5.81kcal/mol;CS为5.30kcal/mol。
合成了具有各种羟烷基链的CS类似物(图8的13-16),进一步测定它们的活性以探讨构象对活性的影响。最近合成了具有各种烷基链的CS类似物(图7的17-24),进而测定它们的活性,探讨构效关系。在这2项研究中,均通过RLIA以pED50(ED50= 50%有效剂量)对活性进行定量评价。还计算了CS激动剂(图9以及BL和CS的ΔG值,发现ΔG和pED50之间具有线性相关性。根据该计算条件,一些化合物的ΔG值为正,这在理论上似乎是不可接受的,但如图9所示,这些计算值与体内活性具有良好的相关性。如图9所示,根据ΔG和pED50间的线性相关性预测化合物9(ΔG=2.18 kcal/mol)具有类甾体化合物活性,化合物7、8、10-12因高ΔG (7.30~17.14 kcal/mol)被认为无活性。
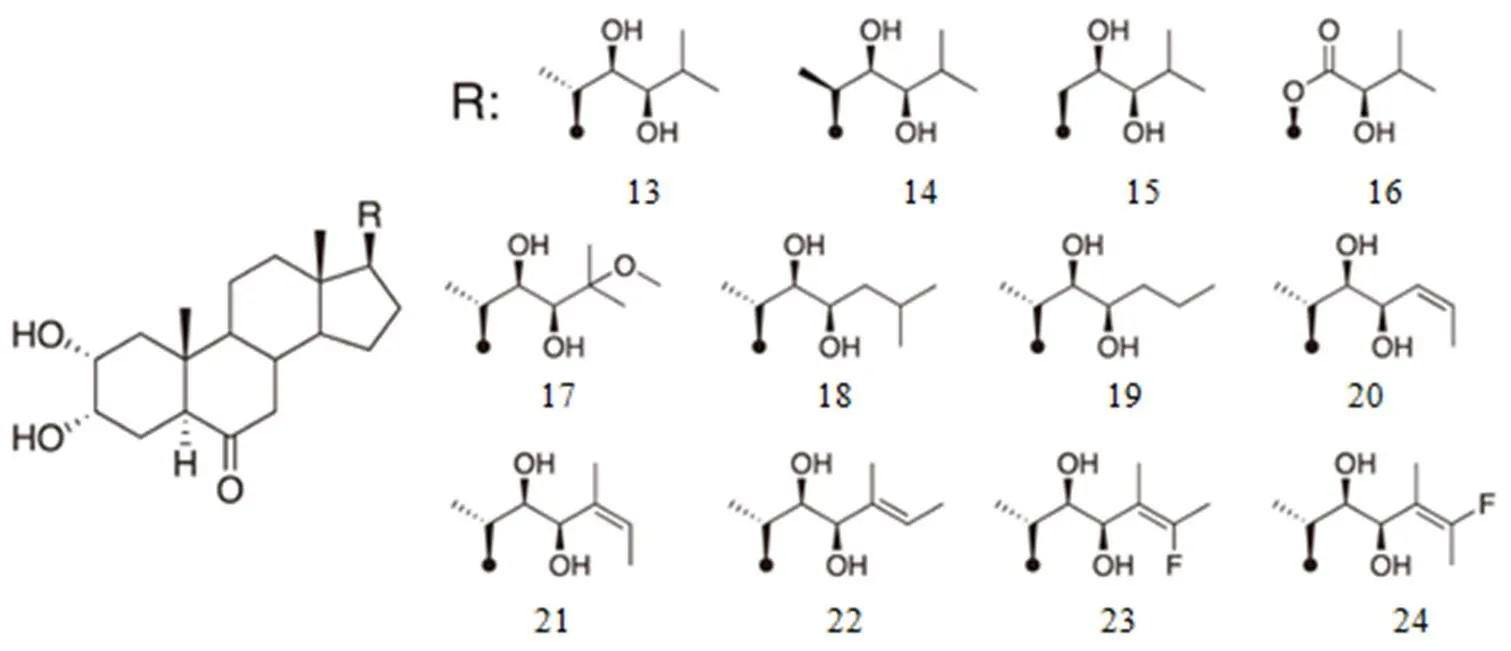
图8 具不同侧链甾酮(castasterone)的类似物结构
由于化合物9为BL激动剂,因此使用拟南芥下胚轴延伸法测定其生物活性。如图10所示,Brz(1 μM)处理可抑制的拟南芥下胚轴伸长,后经化合物9以及BL处理可显著恢复。
2.2 拟南芥中的基因表达
在新合成的NBNPPs(9-12)中,化合物9可使经Brz处理的拟南芥下胚轴显著伸长。因此,评估了其对BR反应基因表达的影响。对在经或未经化合物9处理的1/2 MS琼脂固体培养基中生长的7 d龄野生型拟南芥植物进行定量实时PCR(qPCR)分析。在该测定中化合物9的应用浓度为10 μM和30 μM,可显著诱导拟南芥出现类BL表型。以100 nM的BL和3 μM的Brz作为对照,确定了化合物9对BR响应标记基因的作用。本研究选择了下调BL的BL生物合成基因(D和)。因此,发现化合物9对这些基因的表达水平的下调呈剂量依赖关系,类似BL的作用(图11)。这些结果表明,化合物9为BL激动剂,其通过常见转录元件(commontranscriptional module)激活激素反应。其他化合物(10-12)对标记基因表达没有影响(数据未列出)。

图9 油菜素内酯ΔG和生物活性间(pED50)的线性相关性
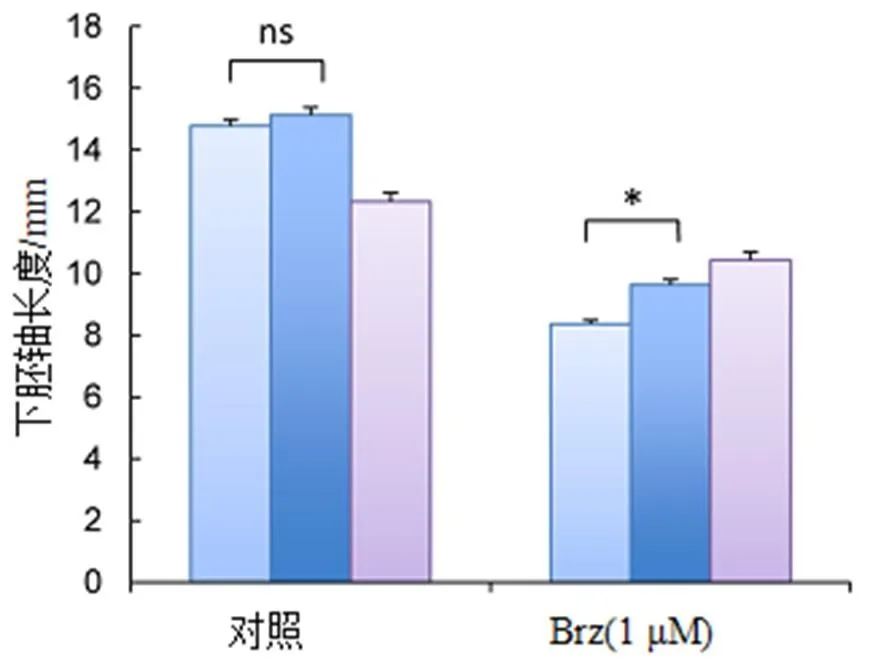
注:数值为±SE的平均值(对照和Brz处理的柱形图从左到右均依次DMSO、化合物9、BL)。*表示与野生型植物相比有显著性差异
2.3 水稻叶倾角测定
由于化合物9在拟南芥中表现了激动剂效应,进而对这些新合成的NBNPPs(9-12)在水稻上也进行了RLIA评估(图12)。仅有化合物9在10 nmol时显示了明显的激动剂活性。进一步研究了化合物9的剂量效应关系(图13)。由剂量效应曲线估算得出化合物9的ED50为0.79 nmol(pED50=9.1)。根据图9中所示的ΔG和pEC50之间的关系,可合理预测化合物活性。
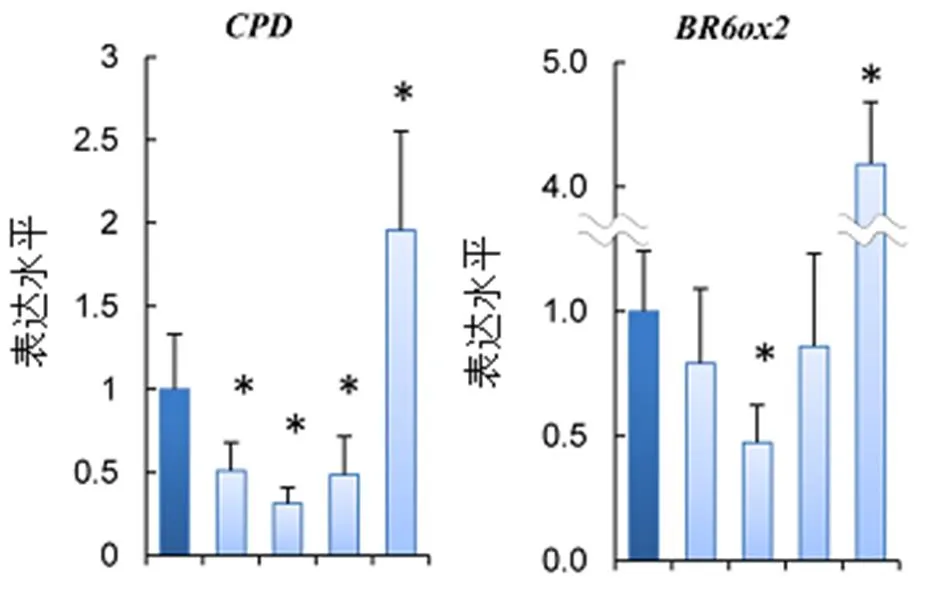
注:CPD和BR6ox2表达的柱形图从左到右均依次为DMSO、10 μM化合物9、30 μM化合物9、BL、Brz;*表示与野生型植物差异显著

注:*表示与对照(乙醇)有显著差异(T检验,p<0.01)
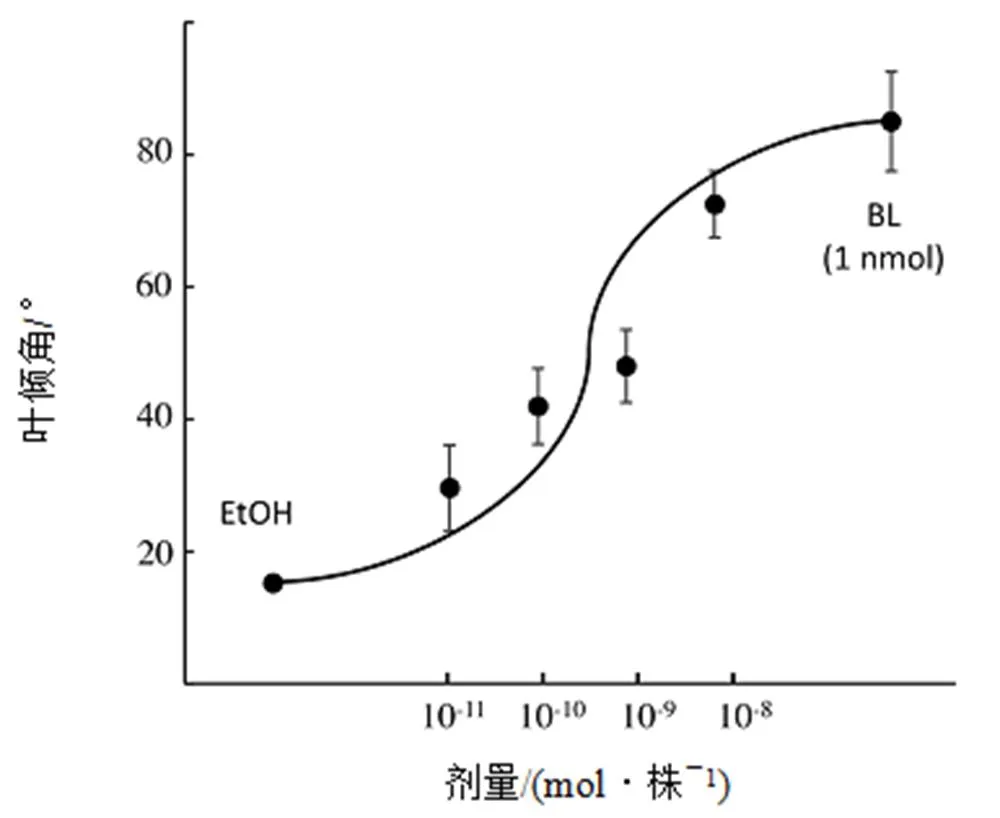
注:横坐标为剂量对数标度(mol)
虽然与BL (pED50=13.6)和CS(pED50=12.3)相比,化合物9 (pED50=9.1)的活性较弱,但是其活性为21-epi-CS (pED50=8.5) 和21-nor-CS (pED50=8.7)的2~3倍,与化合物17(pED50=9.2)相当,也与C-17 位具有酰基侧链的BL类似物(pED50=8.6~10.5)相当。由于这种新的非甾体化合物9在生理和基因水平均表现出类BL活性,因此被称为NSBR1。如图9所示,根据MM-PBSA计算的结合能ΔG(2.13 kcal/mol)是合理的。目前正在研究对NBNPP的A和B环上的取代基进一步修饰以及用更适当的基团取代其哌嗪和苯环,以期提高活性。此结果表明用于计算蜕皮激素激动剂的结合自由能(ΔG)的MMPBSA分析也适用于其他配体-受体结合能计算。
3 结 论
为寻求BL的激动剂/拮抗剂,对自500万种化合物中筛选得到的14种化合物进行了拟南芥试验。研究发现有2种NBNPPs显示了拮抗活性,1种成功转化为激动剂NSBR1。考虑到基于MD模拟的配体-受体结合能,适当进行了从拮抗剂到激动剂的结构转化。NSBR1在拟南芥的基因表达和RLIA中也表现出激动剂活性。
10.16201/j.cnki.cn31-1827/tq.2017.05.05
TQ450
A
1009-6485(2017)05-0028-07
筱禾,女,工程师。Tel: 021-64387891-201。
2017-10-06。

