大鼠骨髓间充质干细胞培养、鉴定及神经样细胞分化
康湘萍 陈 超 梁 超 戴薇薇 龚张斌 金国琴
(上海中医药大学基础医学院,上海 201203)
骨髓间充质干细胞(BMSCs)是一种来源于骨髓基质中具有多向分化潜能的成体干细胞,在一定的诱导条件下可分化为神经外胚层细胞如少突胶质细胞、星形胶质细胞及神经元细胞等〔1,2〕,其向神经样细胞分化潜能为治疗神经系统损伤相关疾病(如早老性痴呆、帕金森病、脑卒中等)提供了新的干细胞来源,具有非常重要的意义及研究价值〔3,4〕。然而BMSCs在骨髓中的含量非常少,占有核细胞总数的0.01%~0.1%。因此,培养、分离足够数量、高纯度的BMSCs可为后续体内、外实验的顺利开展提供必需的种子细胞。本实验旨在探讨BMSCs向神经样细胞分化的可行性,建立稳定的实验体系,为BMSCs移植治疗中枢神经系统相关疾病提供实验基础与依据。
1 材料与方法
1.1实验动物 SD大鼠,SPF级,4周龄,体重(100±20)g,雄性,由上海中医药大学实验动物中心提供〔上海西普尔-必凯实验动物有限公司,SCXK(沪)2013-0016〕。
1.2主要试剂和仪器 试剂:α-MEM培养基、胰蛋白酶、胎牛血清(FBS)、碱性成纤维细胞生长因子(bFGF)购于Gibco公司,β-巯基乙醇购于Genview公司,CD90、CD29、CD34、CD45、神经巢蛋白(Nestin)、胶质纤维酸性蛋白(GFAP)、神经元特异烯醇化酶(NSE)抗体及相关二抗均购于Abcam公司,GAPDH抗体购于CST公司,电化学发光(ECL)试剂盒购自Pierce公司;仪器:台式冷冻离心机(德国Eppendorf公司),垂直式无菌无尘操作台(造鑫企业有限公司),酶标仪(美国BIOTEK公司),倒置相差显微镜(Olympus公司),流式细胞仪(美国BD公司),蛋白电泳仪、电泳槽、转移槽(Bio-Rad公司),凝胶成像分析系统(美国ProteinSimple公司)。
1.3方法
1.3.1大鼠BMSCs的分离、原代培养及传代培养〔5〕将实验大鼠断头处死,置于75%乙醇中浸泡15 min,在无菌条件下分离双侧股骨、胫骨,剪掉两端,用5 ml注射器吸取 α-MEM培养基5 ml反复冲洗骨髓腔3~5次,收集骨髓细胞悬液,吹打分散,1 000 r/min离心5 min弃上清,以10% FBS α-MEM培养基5 ml重悬细胞,混匀,移至6 cm培养皿中,置37℃、5% CO2饱和湿度培养箱中培养,原代培养标记为P0。48 h后首次更换培养基并去除非贴壁细胞,以后每隔3 d换液1次。当贴壁细胞生长融合达培养皿80%左右时用0.25%胰蛋白酶及0.02%EDTA混合消化液消化,1∶3比例进行传代培养,标记为P1,放回培养箱内继续培养,隔天观察细胞生长情况。
1.3.2大鼠BMSCs表面标记物(CD90、CD29为的鉴定BMSCs表面抗原,CD34、CD45为造血干细胞表面抗原)的鉴定
1.3.2.1细胞免疫化学染色 取第3代(P3)细胞接种于24孔板,待细胞生长融合达70%~80%时进行染色实验:弃原培养基,预热的PBS洗细胞2次,加入200 μl预冷的甲醇室温下固定5 min,室温封闭30 min(10%山羊血清),一抗室温孵育1 h(避光,所有一抗的稀释倍数均参考抗体说明书),PBS洗细胞1次,加入荧光标记二抗(1∶800倍稀释),室温避光孵育1 h,PBS洗细胞3次后封片,荧光显微镜观察细胞标记情况。
1.3.2.2流式细胞术检测 细胞传代至P3时消化收集细胞,1.2 ml 3%FBS/PBS重悬细胞,调节细胞浓度至1×106个/ml;各取100 μl细胞悬液,分别加入稀释好的一抗(所有一抗的稀释倍数均参考抗体说明书),室温避光孵育30 min;PBS洗细胞2次,1 200 r/min,离心3 min,预冷的3%FBS/PBS重悬细胞;加入荧光标记二抗(稀释倍数参考抗体说明书),室温避光孵育30 min;PBS洗细胞2次,1 200 r/min,离心5 min,500 μl预冷的3%FBS/PBS重悬细胞;应用流式细胞仪检测细胞表面标记物CD90、CD29、CD34和CD45的表达情况。
1.3.3大鼠BMSCs的诱导分化及神经标志物检测
1.3.3.1定向诱导分化〔6,7〕取第3代细胞以1×105/ml的密度接种于事先放置有消毒盖玻片的12孔板内制备细胞爬片,当细胞贴壁生长达到80%融合时,应用不同方法对其进行诱导,以此分为3组(每组4孔细胞):(1)空白对照组:10%FBS的α-MEM培养基;(2)化学方法诱导组:诱导前培养板孔内加入1 mmol/L的β-巯基乙醇预诱导24 h,更换无血清α-MEM培养基及5 mmol/L的β-巯基乙醇诱导6 h;(3)生长因子诱导组:给予含20 ng/ml bFGF的无血清α-12培养液诱导72 h。
1.3.3.2Western印迹检测神经标志蛋白(Nestin,NSE,GFAP)的表达 加入RIPA缓冲液裂解细胞,双缩脲法测定蛋白浓度。SDS-PAGE电泳,上样量为40 μg蛋白/孔;电泳结束后,300 mA恒流转膜60 min;37℃,5%脱脂奶粉封闭1 h;一抗4℃孵育过夜(所有一抗的稀释比例均参照抗体说明书)。次日,0.1 mol/L PBST(pH7.4)洗膜后加入二抗(1∶10 000倍稀释),37℃孵育45 min;PBST洗膜后ECL显色检测结果,计算积分密度值(IOD)。
1.4统计学处理 采用SPSS17.0统计学软件进行t检验。
2 结 果
2.1细胞形态学观察 原代培养5 d后贴壁细胞呈短梭形、多角形,散在分布,可见核仁;培养至13 d,细胞体狭长,细胞相互融合,出现集落;传代后细胞生长迅速,生长均匀,呈纺锤形、漩涡状分布,核仁清晰,折光性好。见图1。
2.2BMSCs表面标记物的鉴定 细胞免疫化学染色(图2)及流式细胞仪检测(图3)结果显示:CD29、CD90表达阳性(阳性率分别为97.51%、96.85%),CD34和CD45表达阴性(阳性率分别为2.5%、3.8%),故认为体外分离培养的细胞为BMSCs。
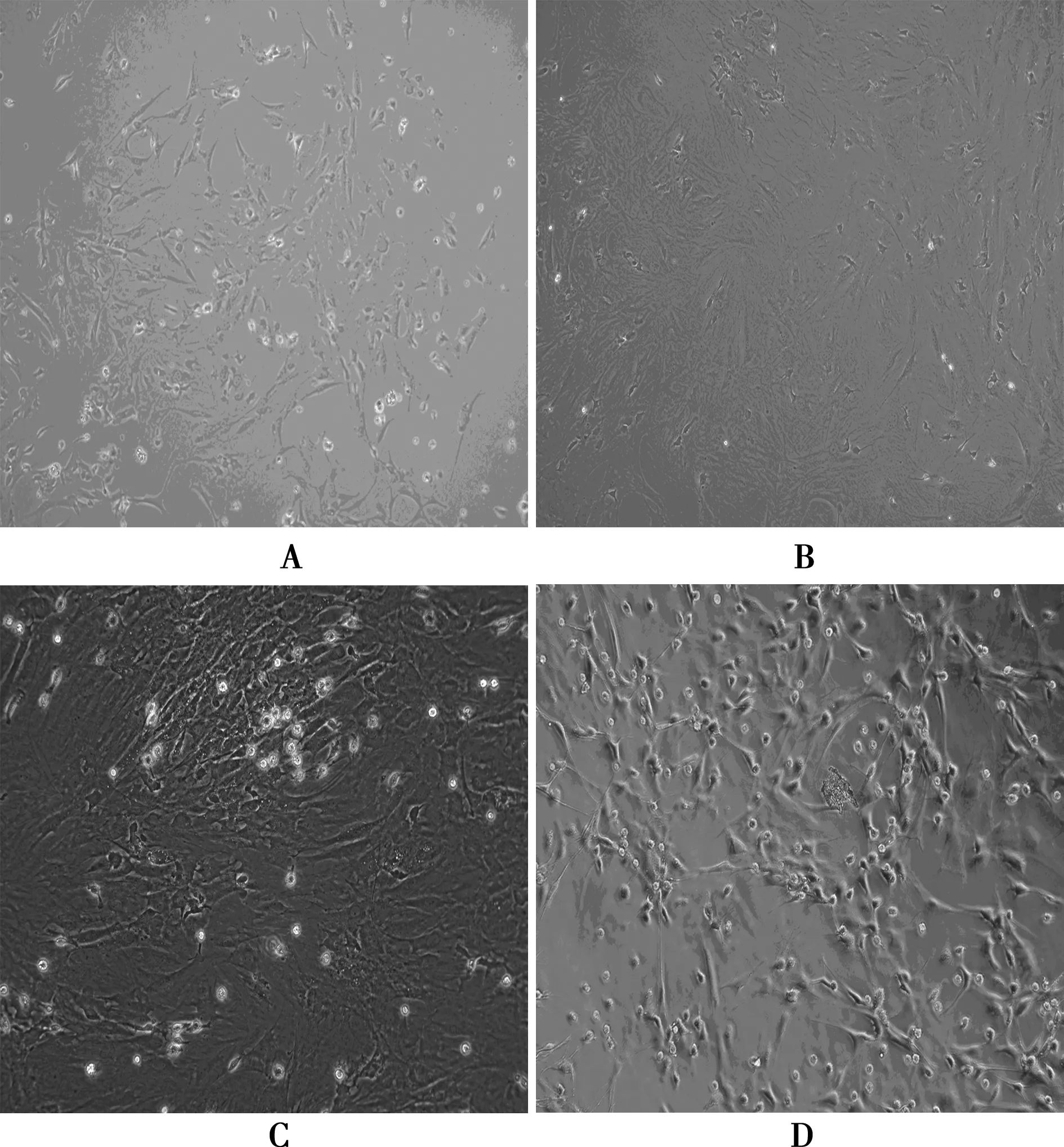
A~C分别为原代细胞5、7、13 d,D为传代细胞P2图1 大鼠BMSCs形态图(×100)

图2 细胞免疫化学染色结果(×200)
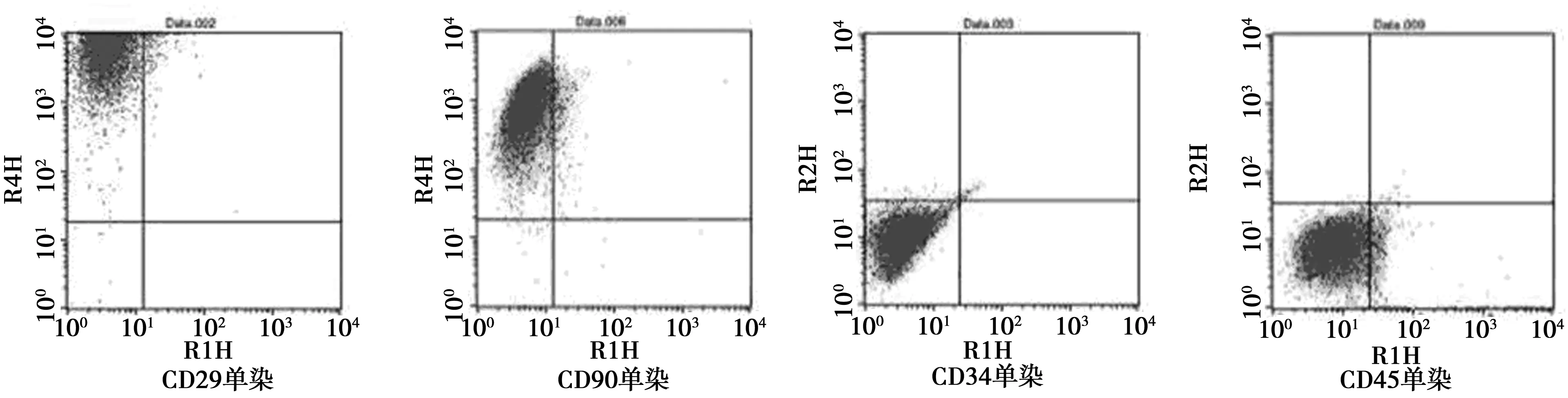
图3 流式细胞仪检测细胞表面标记物
2.3诱导分化后的细胞形态观察 诱导前细胞大部分呈梭形,部分呈现椭圆形或圆形(图4A);β-巯基乙醇诱导2 h后,胞体收缩,折光性增强,个别细胞伸出突起,6 h后出现较典型的神经元细胞形态改变,呈双极或多极,部分突起连成网状(图4B);bFGF诱导24 h后,部分细胞胞体收缩成锥形,折光性增强,72 h后细胞可见明显突起,细长呈树枝状,并交织成网状,为典型的神经样细胞形态改变,呈双极或多极(图4C)。
2.4Western印迹检测神经标志蛋白(Nestin,NSE,GFAP)的表达 Nestin是神经干细胞标志物,NSE是神经元标志物,GFAP是神经胶质细胞标志物。Western印迹检测结果显示:与空白对照组相比,β-巯基乙醇及bFGF诱导后,Nestin、NSE及GFAP蛋白表达均明显升高(P<0.05),两诱导组之间无显著差异,说明在上述诱导剂的作用下,BMSCs可向神经样细胞定向分化,且分化细胞主要为神经干细胞及神经元细胞,见图5,图6。

A.空白对照组;B.β-巯基乙醇诱导分化6 h后;C.bFGF诱导分化72 h后图4 诱导BMSCs分化前后细胞形态图(×200)
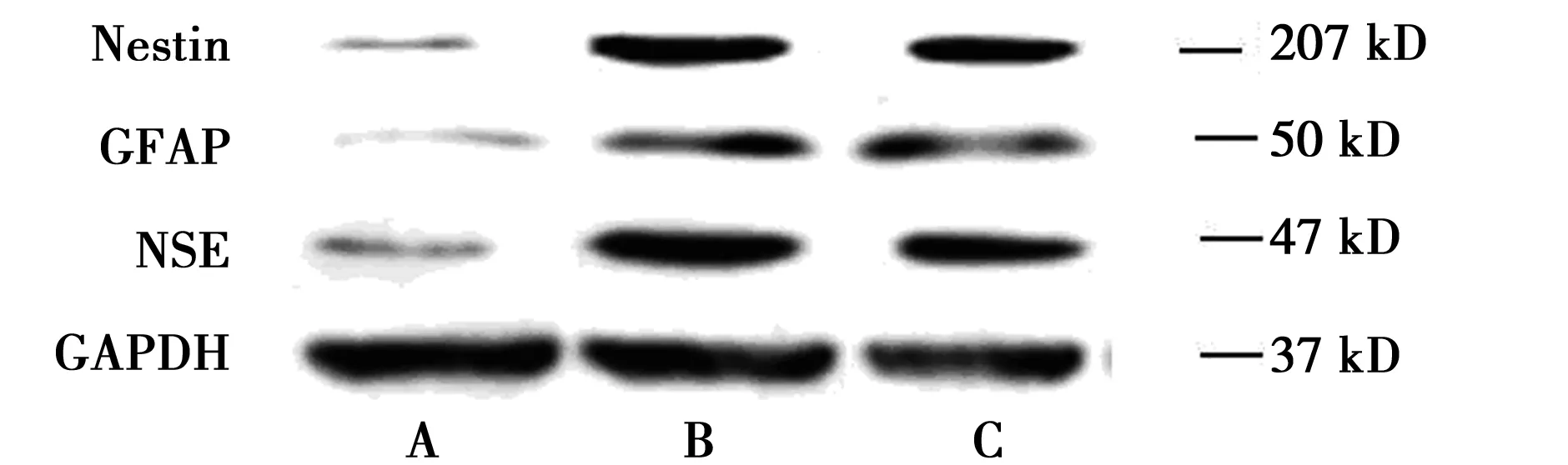
A.空白对照组;B.化学方法诱导组;C.生长因子诱导组图5 Western印迹检测各组细胞神经标志蛋白(Nestin,NSE,GFAP)表达
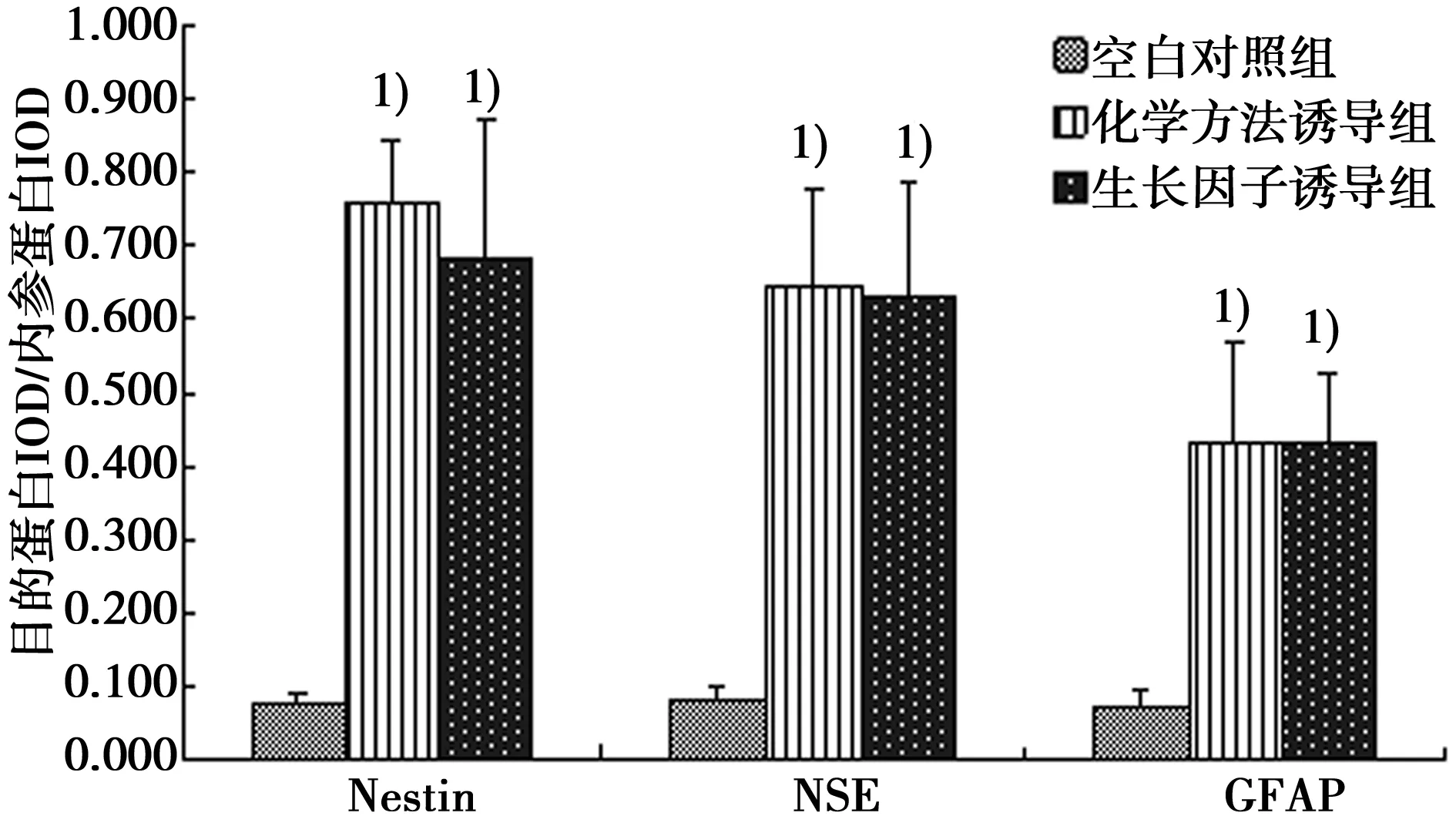
与空白对照组比较:1)P<0.05图6 各组神经标志蛋白表达水平
3 讨 论
神经细胞起源于外胚层,传统认为成体内神经细胞数目恒定不可再生,现在的研究也表明中枢神经系统损伤后自身修复能力非常有限,其损伤与再生一直是困扰医学的难题。BMSCs是一种来源于中胚层但却可以向内、中、外三个胚层分化,具有强大的自我更新能力及多向分化潜能,在特定条件下可诱导分化为多个细胞系,包括成骨细胞、脂肪细胞、心肌细胞、肝细胞、肌成纤维细胞及神经细胞等〔8〕。由于BMSCs来源于骨髓,具有取材容易,易于分离、培养,无免疫排斥反应,可在体外扩增,无伦理问题等特点;因此可作为理想的种子细胞或载体细胞用于细胞移植、基因治疗和细胞治疗等方面。
但是BMSCs在骨髓中的含量非常少,而体外实验及临床治疗一般需要大量高纯度的BMSCs,必须依赖于BMSCs的体外扩增。目前,比较公认的分离培养BMSCs的方法主要有4种:全骨髓贴壁培养法、密度梯度离心法、流式细胞仪分选法及免疫磁珠分选法。其中,全骨髓贴壁培养法是获得BMSCs最为简单的方法,可以很好地保护细胞的活力,经过换液、传代可去除大量杂细胞,获得高纯度、并具备分化潜能的BMSCs。本实验采用全骨髓贴壁法进行大鼠BMSCs的分离、纯化,培养至第3代时应用细胞免疫化学染色和流式细胞术进行细胞表面标志物的检测和鉴定,结果提示分离培养的为纯度较高的BMSCs,且增殖能力比较稳定、适于诱导分化,可选取第3代BMSCs进行后续实验研究。
研究表明,骨髓中的细胞能够分化为神经元和胶质细胞,在脑组织受损伤后尤为明显〔9〕,因此BMSCs是治疗脑外伤、脑梗死、帕金森病及老年痴呆等神经系统疾病的种子细胞〔10~12〕。赵慧新等〔13〕通过移植脑源性神经营养因子(BDNF)转染的BMSCs治疗AD大鼠,发现其对AD大鼠的认知有改善作用,且能促进海马区N-甲基-D-天冬氨酸受体(NMDAR)1的表达。目前,体外诱导BMSCs分化为神经样细胞的方法主要有3种〔14〕:化学诱导、生长因子诱导及抗氧化剂诱导。因诱导后的细胞从形态上看类似于神经细胞,故多称之为“神经元样细胞”或“神经样细胞”。其中化学诱导包括β-巯基乙醇、硫代甘油、维甲酸(RA)等〔15,16〕;生长因子诱导如bFGF、BDNF等〔17〕;抗氧化剂诱导如中药及其有效成分、褪黑素等。本研究分别采用β-巯基乙醇及bFGF诱导BMSCs定向分化,结果表明,在上述诱导剂的作用下,BMSCs可进行分化,且分化细胞具备神经细胞的形态及特征。
本研究成功建立BMSCs的体外培养体系,并可在适当条件下诱导分化为神经样细胞,为BMSCs移植治疗中枢神经系统相关疾病提供实验基础与依据;但是诱导分化过程中的作用机制仍不清楚,有待进一步深入研究。
1de Girolamo L,Lucarelli E,Alessandri G,etal.Mesenchymal stem/stromal cells:a new “cells as drugs” paradigm.Efficacy and Critical Aspects in Cell Therapy 〔J〕.Curr Pharm Des,2013;19(13):2459-73.
2Cunha M,Lima Fda S,Vinolo M,etal.Protein malnutrition induces bone marrow messenchymal stem cells commitment to adipogenic differentiation leading to hepmatopoietic failure 〔J〕.PLoS One,2013;8(3):e58872.
3Wu R,Tang Y,Zang W,etal.MicroRNA-128 regulates the differentiation of rats bone mesenchymal stem cells into neuron-like cells by Wnt signaling 〔J〕.Mol Cell Biochem,2014;87(1-2):151-8.
4Huang W,Mo X,Qin C,etal.Transplantation of differentiated bone marrow stronal cells promotes motor functional recovery in rats with stroke〔J〕.Neurol Res,2013;35(3):320-8.
5Masoud S,Samad N.A protocol for isolation and culture of mesenchymal stem cells from mouse bone marrow 〔J〕.Nat Protoc,2009;4(1):102-6.
6张 进,黄 进,徐志伟.何首乌含药血清促进MSCs增殖的效应及机理研究〔J〕.中药新药与临床药理,2011;22(1):12-5.
7何丁文,殷嫦嫦,殷 明,等.不同血清浓度对bFGF联合EGF诱导BMSCs向神经细胞分化的影响〔J〕.神经解剖学杂志,2013;29(1):18-24.
8Philippe C.Programming differentiation potential in mesenchymal stem cells 〔J〕.Eplgenetics,2010;5(6):476-82.
9Maeda M,Nahi Y,Ahmad A,etal.Production of neural progenitors from bone marrow mesenchymal stem cells 〔J〕.Stem Cell Discov,2016;6(1):1-12.
10Wei L,Fraser JL,Lu ZY,etal.Transplantation of hypoxia preconditioned bone marrow mesenchymal stem cells enhances angiogenesis and neurogenesis after cerebral ischemia in rats 〔J〕.Neurobiol Dis,2012;46(3):635-45.
11Frattini F,Lopes FR,Almedia FM,etal.Mesenchymal stem cells in a polycaprolactone conduit promote sciatic nerve injury 〔J〕.Tissue Eng Part A,2012;18(19-20):2030-9.
12Oh SH,Kim HN,Park HJ,etal.Mesenchymal stem cells increase hippocampal neurogenesis and neuronal differentiation by enhancing the Wnt signaling pathway in an Alzheimer′s disease model〔J〕.Cell Transplantation,2015;24(5):1097-109.
13赵慧新,赵钢勇,张 平.移植脑源性神经营养因子转染的骨髓间充质干细胞对AD大鼠的影响〔J〕.神经损伤与功能重建,2014;10(1):195-8.
14冯烨军,陈 明.骨髓间充质干细胞在神经修复中的研究进展〔J〕.神经损伤与功能重建,2016;11(5):426-8.
15Hofsteter CP,Schwarz EJ,Hess D,etal.Marrow stromal cells form guiding strands in the injured spinal cord and promote recovery 〔J〕.Proc Natl Acad Sci USA,2002;99(4):2199-204.
16项 鹏,夏文杰,张丽蓉,等.成人骨髓间充质干细胞定向诱导为神经元样细胞的研究〔J〕.中国病理生理杂志,2001;17(5):385-7.
17王 冠,李静雅,杨声坪,等.骨髓间充质干细胞向神经元样细胞分化中黄芪多糖的诱导作用〔J〕.中国组织工程研究,2015;19(45):7259-62.

