川芎嗪联合脑源性神经营养因子诱导大鼠骨髓间充质干细胞向神经样细胞分化
苏立宁 宋小青 朱登祥 魏会平 王 睿
(河北北方学院基础医学院,河北 张家口 075000)
干细胞诱导和细胞移植技术的发展为神经系统损伤后的修复、再生和功能恢复提供了新的有潜力的治疗手段。胚胎干细胞具有定向诱导分化难以控制、供体来源困难、异体排斥反应等缺点。神经干细胞是治疗中枢神经系统损伤的良好“种子”细胞,但多从胚胎或成熟的中枢系统取材培养,也制约了细胞的来源,如欧洲已明确规定禁止从人胚胎中获取干细胞。而骨髓间充质干细胞(BMSCs)〔1〕可以解决上述问题,因此间充质干细胞的诱导分化和体内移植成为这一领域的研究热点。已有研究证实BMSCs是治疗缺血性脑疾病、帕金森病、脊髓损伤、坐骨神经损伤等神经系统疾病的种子细胞,这方面研究可为神经系统疾病的临床治疗提供较好的理论和实验依据〔2~5〕。在合适的诱导条件下,BMSCs可向多种细胞及神经样细胞分化〔1,6~10〕。目前国内外对BMSCs分化和神经系统修复的研究主要集中在BMSCs体外诱导分化及体内移植实验,关于BMSCs可定向诱导向神经样细胞分化已经取得了不少成果〔11~15〕。川芎嗪对脑损伤的保护及其作用机制成为研究热点〔16~18〕。有学者还发现川芎嗪可以保护缺血性脑损伤、减轻神经元凋亡,与促进神经营养因子如脑源性神经营养因子(BDNF)的表达有关〔19〕。BDNF高表达于中枢神经系统,在其发育过程中具有调控神经元的存活、分化、生长及保护神经元免受损伤,改善神经元病理状态等作用,是成熟的中枢及周围神经系统的神经元维持生存及正常生理功能所必需〔20~22〕。本研究观察川芎嗪联合BDNF诱导 BMSCs 向神经样细胞分化。
1 材料和方法
1.1材料 健康SD大鼠4只,4周龄,体质量(90±20)g,由中国医学科学院实验动物繁殖中心提供。DMEM/F12(GIBCO公司)、BDNF(GenScript公司)、RNA提取试剂盒、神经元特异性烯醇化酶(NSE)引物(TaKaRa公司)、兔抗巢蛋白(nestin)、兔抗NSE(北京博奥森生物技术有限公司)、川芎嗪(成都植标化纯生物技术有限公司)。
1.2BMSCs的分离及培养 原代培养:无菌条件下取SD大鼠股骨和胫骨,采用D-Hanks液多次冲洗多余血液,采用含1%的双抗(青、链霉素)+10%胎牛血清(FBS)的DMEM培养液冲洗骨髓腔,得到细胞悬液,接种于培养瓶中,置于37℃、5%CO2饱和湿度的培养箱中培养。48 h后首次半换液,以后每2天换液一次。传代培养:待细胞密度达到80%~90%时,0.25%的胰酶消化进行传代。通过传代,细胞逐渐纯化,至第3代后,细胞纯度较高。细胞培养过程中,使用倒置显微镜观察细胞生长情况,并拍照记录。
1.3BMSCs表面标志的检测 取第3代大鼠BMSCs与荧光标记的抗鼠CD29,CD34,CD45,CD90混合,37℃作用30 min后,经流式细胞仪检测细胞纯度。
1.4BDNF和川芎嗪联合诱导BMSCs的分化 取第3代BMSCs,胰酶消化后按 3×105/ml浓度接种于放置有盖玻片的6孔板内,制备细胞爬片分为4组进行诱导。对照组:不加任何诱导剂;BDNF组:加入100 ng/ml BDNF;川芎嗪组:加入1.25 mg/ml川芎嗪;BDNF联合川芎嗪组前2 d加100 ng/ml BDNF,后2 d加1.25 mg/ml川芎嗪。每个实验组均诱导4 d。
1.5免疫细胞化学方法鉴定BMSCs的分化 每个实验组采用免疫细胞化学方法观察nestin、NSE的表达,显微镜下观察结果,并拍照。免疫细胞化学方法如下:取出细胞爬片,磷酸盐缓冲液(PBS)洗1次,冷丙酮固定10 min,PBS洗3次,每次3 min;将盖玻片浸入3%H2O2中,室温孵育20 min,PBS洗3次,每次3 min;用试剂A(正常山羊血清)封闭20 min,吸弃,不予漂洗;分别滴加稀释后的Nestin、NSE抗体(1∶200稀释度)置入湿盒中4℃过夜,PBS漂洗3次,每次3 min;加入试剂B(生物素标记的二抗),37℃孵育15~20 min,PBS漂洗3次,每次3 min;滴入试剂C,室温或37℃孵育15~20 min,PBS漂洗3次,每次3 min;二氨基联苯胺(DAB)溶液显色10 min,自来水冲洗终止反应,中性树胶封片。
1.6实时荧光定量PCR检测诱导前后NSE mRNA表达 根据GenBank公布的基因序列设计引物,由上海生工合成。NSE引物正义链:GTATGGATGTGGCTGCCTCTG,反义链:TCCTGGTCGAATGGGTCTTC。采用 SYBR Green Ⅰ荧光染料法进行实时定量 RT-PCR 扩增的检测。PCR反应体系为20 μl,置于实时荧光定量PCR仪中扩增,反应条件为:95℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃ 30 s,40个循环,72℃检测信号。
1.7统计学方法 应用SPSS13.0软件进行t检验。
2 结 果
2.1诱导前大鼠BMSCs细胞的形态观察 原代培养2 d后倒置显微镜观察,细胞少量呈群落生长,形态大多呈短梭形;4~6 d细胞形态大多呈长梭形或呈多边形,细胞集落不断扩大,呈群落生长。胰酶消化传代,二代、三代细胞生长较稳定,密度较均匀,形态以长梭形为主,符合BMSCs的细胞形态特征(图1)。流式细胞仪检测结果显示:CD29,CD90表达阳性,阳性率分别为99.8%,88.6%;CD34,CD45表达阴性,阳性率分别为1.8%,23.3%。
2.2加入诱导剂后BMSCs的形态学变化 处理4 d后,对照组细胞形态没有任何变化;BDNF联合川芎嗪,4 d后出现较多神经样细胞,细胞体积增大,胞核固缩,核质比降低,细长突起明显,部分细胞间以网络状连接;而BDNF组和BDNF联合川芎嗪组可见到少量神经样细胞(图2)。

图1 诱导前大鼠BMSCs形态(倒置相差显微镜,×100)
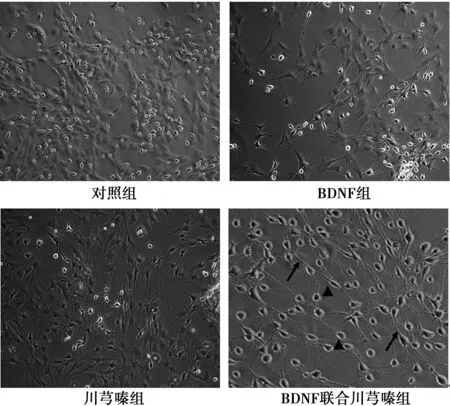
图2 BMSCs形态学变化(×100)
2.3BMSCs分化的鉴定 免疫细胞化学方法检测结果显示诱导4 d后,对照组细胞nestin和NSE标记阴性,BDNF联合川芎嗪组nestin和NSE标记阳性(图3)。实时荧光定量PCR检测结果显示,对照组为0.615±0.006,BDNF组0.719±0.006,川芎嗪组为0.727±0.005,BDNF联合川芎嗪组为1.586±0.003。BDNF联合川芎嗪组细胞的NSE 基因表达量显著高于对照组、BDNF组及川芎嗪组。

图3 BMSCs分化鉴定结果
3 讨 论
BMSCs是骨髓微环境的重要组成部分,在体内分布于多种组织器官,体外在特定的诱导条件下可分化为各种细胞,其中包括神经样细胞。目前,BMSCs具有自我更新和多向分化潜能的特性已经被广泛认知。一些学者用 β-巯基乙醇〔23〕、二甲基亚砜、4-羟基茴香烷〔24〕、丁基化酚酮等化学试剂,体外成功诱导BMSCs向神经样细胞分化,但由于化学试剂的毒性作用,很难应用于临床治疗。近年研究表明使用丹参、多糖、黄芪类、红景天苷、银杏内酯、鹿茸多肽和白藜芦醇等药或其提取物可诱导 BMSCs 向神经样细胞分化,并表达多种神经干细胞或神经细胞的特异性标志物〔25~32〕。药理学的研究认为,上述药物的诱导作用可能和药物的抗氧化作用有关。川芎嗪是一种已经被广泛应用于神经内科和心血管内科等领域的传统中药提取物,其提取物药理作用较广泛,具有抗氧化、清除氧自由基、保护神经细胞等作用,因此川芎嗪具有诱导BMSCs 定向分化为神经样细胞的潜能。细胞的分化还受各种细胞因子的影响,其中神经营养因子的作用尤为关键。BDNF参与调控神经结构及功能变化,在中枢神经系统的学习和长期记忆中发挥重要作用,分泌后与其受体酪氨酸激酶受体B结合产生一系列信号途径,保护神经元、促进损伤神经再生〔31,33,34〕。Lim等〔35〕将BDNF添加入神经诱导培养基,成功诱导BMSCs向神经分化,分化过程与MAPK/ERK和PI3K/Akt信号有关。Han等〔36,37〕在体外将BDNF基因转入BMSCs,与普通的BMSCs相比,BDNF/BMSCs表现出更高的增殖能力,分泌更多的BDNF,明显提高向神经样细胞分化的比率。BDNF在脑内表达量尤为显著,对发育中中枢神经的存活、分化及增殖具有促进作用,防止神经元退行性变,还能抗细胞凋亡。本实验中,BDNF联合川芎嗪组神经样细胞的存活时间明显比川芎嗪单体诱导组要长,可能与上述机制有关,BDNF延长了神经样细胞的存活时间。微小RNA(miRNA)是具有调控功能的非编码RNA,大小20~25个核苷酸,在中枢神经系统的发育中发挥重要作用。近年来,对于miRNA在神经细胞分化中所起作用的研究成为神经诱导中的研究热点之一,最近有研究发现在亨廷顿舞蹈病患者体内,神经功能紊乱和死亡均会导致miR-10b-5p表达量上升,其靶基因BDNF表达量降低,BDNF与miR-10b-5p共同调控神经的功能及存活〔38〕,从另一方面为寻找BMSCs向神经细胞分化的关键调控因子提供基础。综上所述,BDNF在神经细胞分化中发挥了重要作用,是神经分化及生长不可缺少的因子。
1Biver G,Wang N,Gartland A,etal.Role of the P2Y13 receptor in the differentiation of bone marrow stromal cells into osteoblasts and adipocytes〔J〕.Stem Cells,2013;31(12):2747-58.
2Chen CJ,Qu YC,Liao SL,etal.Transplantation of bone marrow stromal cells for peripheral nerve repair〔J〕.Exp Neurol,2007;204(1):443-53.
3Zheng L,Cui HF.Use of chitosan conduit combined with bone marrow mesenchymal stem cells for promoting peripheral nerve regeneration〔J〕.J Mater Sci,2010;21(5):1713-6.
4Jia H,Wang Y,Tong XJ,etal.Sciatic nerve repair by acellular nerve xenografts implanted with BMSCs in rats xenograft combined with BMSCs〔J〕.Synapse,2012;66(3):256-69.
5Wang Y,Jia H,Li WY,etal.Synergistic effects of bone mesenchymal stem cells and chondroitinase ABC on nerve regeneration after acellular nerve allograft in rats〔J〕.Cell Mol Neurobiol,2012;32(3):361-71.
6冯 敏,孙荣青,马爱群.体外诱导大鼠骨髓间充质干细胞向心肌细胞定向分化的研究〔J〕.中国危重病急救医学,2009;21(6):340-2.
7赵 瑛,蔡绍皙.鼠骨髓间充质干细胞的分离培养及定向诱导分化为内皮样细胞〔J〕.中国应用生理学杂志,2010;26(1):60-5.
8Feng Z,Li C,Jiao S,etal.In vitro differentiation of rat bone marrow mesenchymal stem cells into hepatocytes〔J〕.Hepatogastroenterology,2011;58(112):2081-6.
9Wei B,Jin C,Xu Y,etal.Chondrogenic differentiation of marrow clots after microfracture with BMSC-derived ECM scaffold in vitro〔J〕.Tissue Eng Part A,2014;20(19):2646-55.
10Wang T,Yang X,Qi X,etal.Osteoinduction and proliferation of bone-marrow stromal cells in three-dimensional poly (epsilon-caprolactone)/ hydroxyapatite/collagen scaffolds〔J〕.J Transl Med,2015;13(1):152.
11Lei Z,Yongda L,Jun M,etal.Culture and neural differentiation of rat bone marrow mesenchymal stem cells in vitro〔J〕.Cell Biol Int,2007;31(9):916-23.
12柴立辉,吴素霞,鄢文海,等.体外诱导人骨髓间充质干细胞向多巴胺神经元分化的研究〔J〕.生物工程学报,2007;23(2):252-6.
13Huat TJ,Khan AA,Abdullah JM,etal.MicroRNA expression profile of neural progenitor-like cells derived from rat bone marrow mesenchymal stem cells under the influence of IGF-1,bFGF and EGF〔J〕.Int J Mol Sci,2015;16(5):9693-718.
14李 博,黄春田,李彩芳,等.大鼠骨髓间充质干细胞向神经细胞分化后自噬水平的变化〔J〕.中国应用生理学杂志,2015;31(1):31-4.
15Zhu T,Yu D,Feng J,etal.GDNF and NT-3 induce progenitor bone mesenchymal stem cell differentiation into neurons in fetal gut culture medium〔J〕.Cell Mol Neurobiol,2015;35(2):255-64.
16Fan LH,Wang KZ,Cheng B,etal.Anti-apoptotic and neuroprotective effects of tetramethylpyrazine following spinal cord ischemia in rabbits〔J〕.BMC Neurosci,2006;7(1):48-57.
17Kao TK,Ou YC,Kuo JS,etal.Neuroprotection by tetramethylpyrazine against ischemic brain injury in rats〔J〕.Neurochem Int,2006;48(3):166-76.
18Tan Z.Neural protection by naturopathic compounds-an example of tetramethylpyrazine from retina to brain〔J〕.J Ocul Biol Dis Infor,2009;2(3):57-64.
19马 潞,刘文科,张跃康,等.川芎嗪对重型脑损伤组织BDNF、bFGF表达的影响及对神经元的保护作用〔J〕.四川大学学报(医学版),2008;39(2):207-10.
20Ivanov AD.The role of NGF and BDNF in mature brain activity regulation〔J〕.Zh Vyssh Nerv Deiat Im I P Pavlova,2014;64(2):137-46.
21Baydyuk M,Wu XS,He L,etal.Brain-derived neurotrophic factor inhibits calcium channel activation,exocytosis,and endocytosis at a central nerve terminal〔J〕.J Neurosci,2015;35(11):4676-82.
22Hannan JL,Albersen M,Stopak BL,etal.Temporal changes in neurotrophic factors and neurite outgrowth in the major pelvic ganglion following cavernous nerve injury〔J〕.J Neurosci Res,2015;93(6):954-63.
23Wu R,Wang N,Li M,etal.Experimental study on the facilitative effects of miR-125b on the differentiation of rat bone marrow mesenchymal stem cells into neuron-like cells〔J〕.Cell Biol Int,2013;37(8):812-9.
24Kaka GR,Tiraihi T,Delshad A,etal.In vitro differentiation of bone marrow stromal cells into oligodendrocyte-like cells using triiodothyronine as inducer〔J〕.Int J Neurosci,2012;122(5):237-47.
25胡琳燕,余加林,刘官信,等.丹参诱导鼠骨髓间充质干细胞分化为神经样细胞优化方案及电生理研究〔J〕.细胞生物学杂志,2008;30(3):392-6.
26纳 鑫,汪雪兰,皮荣标.川芎嗪对中枢神经系统的药理作用及其机制的研究进展〔J〕.中药新药与临床药理,2008;19(1):77-80.
27王旭凯,王 英,杨有庚,等.鹿茸多肽对β-淀粉样蛋白诱导脊髓神经元细胞凋亡的保护作用〔J〕.浙江中医药大学学报,2009;33(1):45-7.
28范洪伟,邓春荣,付 健,等.枸杞多糖对大鼠坐骨神经离断后创伤性神经瘤形成及其疼痛影响〔J〕.中国修复重建外科杂志,2010;24(11):1298-301.
29杜晓鸣,魏会平,张爱兰,等.川芎嗪对大鼠骨髓间充质干细胞长期诱导效应的研究〔J〕.中国中医药现代远程教育,2012;10(13):157-8.
30陆 燕,刘 沙,刘 的,等.银杏内酯B诱导大鼠骨髓间充质细胞分化为神经元样细胞的电生理研究〔J〕.现代生物医学进展,2012;12(15):2826-8.
31Ma J,Zhang Z,Su Y,etal.Magnetic stimulation modulates structural synaptic plasticity and regulates BDNF-TrkB signal pathway in cultured hippocampal neurons〔J〕.Neurochem Int,2013;62(1):84-91.
32黄家贵,沈长波,刘 舒,等.白藜芦醇诱导大鼠骨髓基质细胞的神经元样细胞分化伴Shh信号激活〔J〕.第三军医大学学报,2013;35(4):280-3.
33Jeon SJ,Rhee SY,Seo JE,etal.Oroxylin A increases BDNF production by activation of MAPK-CREB pathway in rat primary cortical neuronal culture〔J〕.Neurosci Res,2011;69(3):214-22.
34Revest JM,Le Roux A,Roullot-Lacarriere V,etal.BDNF-TrkB signaling through Erk1/2 MAPK phosphorylation mediates the enhancement of fear memory induced by glucocorticoids〔J〕.Mol Psychiatry,2014;19(9):1001-9.
35Lim JY,Park SI,Oh JH,etal.Brain-derived neurotrophic factor stimulates the neural differentiation of human umbilical cord blood-derived mesenchymal stem cells and survival of differentiated cells through MAPK/ERK and PI3K/Akt-dependent signaling pathways〔J〕.J Neurosci Res,2008;86(10):2168-78.
36Han ZM,Huang HM,Wang FF.Brain-derived neurotrophic factor gene-modified bone marrow mesenchymal stem cells〔J〕.Exp Ther Med,2015;9(2):519-22.
37Liu Q,Cheng G,Wang Z,etal.Bone marrow-derived mesenchymal stem cells differentiate into nerve-like cells in vitro after transfection with brain-derived neurotrophic factor gene〔J〕.In Vitro Cell Dev Biol Anim,2015;51(3):319-27.
38Muller S.In silico analysis of regulatory networks underlines the role of miR-10b-5p and its target BDNF in huntington′s disease〔J〕.Transl Neurodegener,2014;3(1):17-21.

