不同干燥方式对牛蒡片多酚含量及抗氧化能力的影响
张钟元, 朱翠平,2, 李大婧,2, 刘春泉, 江 宁, 王晓燕,2, 聂梅梅,2
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014; 2.南京农业大学食品科技学院,江苏 南京 210095)
新鲜牛蒡根营养丰富,但组织中含有大量纤维使其在生长后期及贮藏过程中极易纤维化而变空心,这一变化不但影响食用口感,并且使牛蒡营养价值显著降低。对牛蒡根进行干燥处理,可以有效延长其货架期、降低贮运成本及丰富脱水产品市场种类。但牛蒡根中的热敏感性多酚类化合物极易在干燥处理过程中氧化和降解,降低干制牛蒡片的抗氧化能力。已有研究结果表明,干燥方式对多酚组成及抗氧化能力影响显著。卢可可等[1]研究发现恒温热风干燥后香菇中游离酚和结合酚含量损失较大,从而导致其抗氧化能力显著降低。陈玮琦等[2]研究不同干燥方式对苹果幼果干酚类物质及其抗氧化性的影响,结果表明真空冻干处理样品酚类物质含量最高,抗氧化能力最强。热干燥过程中由于较高温度和氧气存在导致多酚类物质被热分解,从而影响其抗氧化活性[3-4]。联合干燥是将2种或2种以上的干燥方式以串连或并联的方式组合,在不同的脱水阶段选择适宜的干燥方式,以此实现高效干燥过程,产出高品质的产品。目前联合干燥方式对物料多酚及抗氧化能力的影响的研究尚不多见。
本研究采用热风干燥、真空微波干燥、真空冷冻干燥、热风联合真空微波干燥、真空冷冻联合真空微波干燥5种方式对牛蒡片进行干燥,分析不同干燥方式生产的干制牛蒡片的多酚组成及抗氧化能力的差异,旨在探讨联合干燥方式对牛蒡片的多酚组成及抗氧化能力的影响,为牛蒡综合开发利用提供理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
新鲜牛蒡(品种为柳川黄肌牛蒡)购于徐州市牛蒡种植基地,储藏于4 ℃冰箱备用;分析纯乙醇、Na2CO3、NaOH、NaNO2、A1(NO3)3、苯酚、没食子酸,购于北京化学试剂公司;Folin酚试剂购于Sigma-Aldrich上海贸易有限公司。
1.2 仪器与设备
数显101A-2型电热鼓风干燥箱(上海浦东荣本科学仪器有限公司生产),VMD-1型真空微波干燥设备(南京孝马机电设备厂生产),FD-1A-50冷冻干燥机(北京博医康实验仪器有限公司生产),MP2002电子天平(上海舜宇恒平科学仪器有限公司生产),TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司生产),TG16-WS台式高速离心机(长沙湘仪离心机仪器有限公司生产),Agilent 1100HPLC/MS(SL)联用仪(美国Agilent公司生产), DW-86L828型超低温保存箱(青岛海尔股份有限公司生产)。
1.3 方法
1.3.1 干燥方式 热风干燥(Hot air drying, AD):将预处理后的牛蒡片放入电热鼓风干燥箱中70 ℃干燥至水分含量为5%以下;真空微波干燥(Vacuum microwave drying, VMD):将预处理后的牛蒡片放入真空微波干燥设备中8 W/g干燥至水分含量为5%以下;真空冷冻干燥(Vacuum freeze drying, VFD):将预处理后的牛蒡片放入真空冷冻干燥设备中(绝压20 Pa、加热板温度25 ℃、冷阱温度-58 ℃)干燥至水分含量为5%以下;热风联合真空微波干燥(Hot air & vacuum microwave drying, AD&VMD):将预处理后的牛蒡片放入电热鼓风干燥箱中(70 ℃)干燥30 min后真空微波干燥(8 W/g)至水分含量为5%以下。真空冷冻联合真空微波干燥(Vacuum freeze&vacuum microwave drying, VFD&VMD):将预处理后的牛蒡片真空冷冻干燥至水分含量为60%,真空微波干燥(8 W/g)至水分含量为5%以下。
1.3.2 水分含量测定 采用GB 5009.3-2010食品中水分的测定方法。
干基含水率=(Mt-Ms)/Ms
式中:Mt:物料t时刻对应的质量;Ms:绝干物料质量。
1.3.3 能耗率测定 干燥过程所消耗的能量用能耗率表示,其中干燥过程中单位时间所消耗的能量用功率表测定。

1.3.4 多酚的测定 多酚含量采用Folin-Ciocalteus(FC)法测定[5]。准确称取1 g样品加20 ml 30%乙醇,超声波240 W、40 ℃、30 min下提取,制得牛蒡片粗提取液,取各提取液1 ml,加蒸馏水补充至6 ml,加入稀释1倍的Folin-酚试剂1 ml,充分震荡后静置 3~4 min,再分别加入3 ml 7.5% 碳酸钠溶液,终体积为 10 ml,摇匀置于 25 ℃恒温水浴中避光反应 1 h,以蒸馏水为空白做对照,于765 nm 条件下测定吸光度。酚含量以相当没食子酸毫克数表示。
没食子酸标准曲线:配制浓度为2 μg/ml、4 μg/ml、6 μg/ml、8 μg/ml和10 μg/ml的没食子酸溶液,吸取1 ml上述溶液于试管中,按照样品测定方法操作,测定吸光值,重复3次。根据标准曲线,计算样品中总酚含量。
1.3.5 2,2-diphenyl-2-picryl-hydrazyl (DPPH) 清除能力测定 采用分光光度法进行样品测定,取稀释不同浓度的牛蒡片粗提物100 μl 加入100 μl 0.2 mmol/L DPPH溶液,混匀后于室温下避光反应30 min后,测定其在517 nm处的吸光值。以无水乙醇做空白,加入100 μl无水乙醇的DPPH溶液做对照,做一系列提取物浓度梯度试验。牛蒡片提取物清除DPPH自由基能力用IC50表示,即为当清除率(I)达到50%时提取物的浓度。
清除率(I) =(A0-A1)/A0×100%
其中I为清除率;A0为不加清除剂的吸光值,A1为加入清除剂后的吸光值。用抗坏血酸当量表示抗氧化能力(Ascorbic acid equivalent antioxidant capacity, AEAC)。
AEAC(mg/g)=VC的IC50(mg/ml)/样品的IC50(mg/ml)×103
1.3.6 铁离子还原能力(Ferric reducing ability of power,FRAP)的测定 准确量取50 μl的牛蒡片粗提液,加入150 μl 三吡啶三吖嗪 (tripyridyl-triazine, TPTZ)工作液(由0.3 mol/L pH 3.6的醋酸缓冲液 25 ml,10 mmol/L TPTZ 溶液 2.5 ml,20 mmol/L FeCl3溶液 2.5 ml 组成),混匀后 37 ℃反应10 min,以甲醇为空白,测定混合液在593 nm处的吸光值[6]。VC标准溶液:配置浓度为20 mg/ml、40 mg/ml、60 mg/ml、80 mg/ml、100 mg/ml、120 mg/ml、140 mg/ml和160 mg/ml的VC标准溶液,分别取50 μl与150 μl TPTZ工作液在相同条件下反应,测定吸光值。
FRAP(mg/g)=样品吸光值对应的VC浓度(mg/ml)/样品此时的浓度( mg/ml)×103
1.3.7 2, 20-azinobis-(3-ethylbenzothiazoline)-6-sulfonic acid (ABTS)自由基清除能力测定 将ABTS溶解于20.00 mmol/L、pH为4.5的醋酸缓冲液中得到7.00 mmol/L的ABTS贮液,取5 ml ABTS与5 ml 2.45 mmol/L过硫酸钾混合,在室温(20 ℃)避光反应 12~16 h,用之前稀释55倍,使溶液在734 nm吸光值在 0.700±0.002,以此得到ABTS贮液,该工作液现配现用。取20 μl样品+180 μl ABTS工作液,室温避光反应60 min。以蒸馏水为空白对照。自由基清除能力用Trolox等价抗氧化能力表示,单位:mg/g。
1.3.8 液相分析条件 色谱柱为Zorbax SB-C18反相色谱柱(4.6 mm×250.0 mm,5 μm),DAD检测器(检测波长为280 nm),柱温35 ℃,以含0.1%乙酸的水为流动相A,含0.1%乙酸的乙腈为流动相B,进样量20 μl,控制流速为0.5 ml/min,按照如下梯度洗脱:0~5.0 min 9%~15% B,5.1~10.0 min 15%~20% B,10.1~15.0 min 20%~25% B,15.1~18.0 min 25%~30% B,18.1~20.0 min 30%~32% B,20.1~25.0 min 32%~9% B。
1.3.9 质谱分析条件 采用电喷雾负离子源,扫描范围为100~1 000 m/z,干燥气体10 L/min,干燥气体温度350 ℃;雾化气体30 Psi,毛细管电压3.0 kV。
1.3.10 牛蒡多酚组分定性定量分析方法 通过比较某一特征峰与时间的曲线面积、保留时间、出峰顺序、相应色谱峰的ESI-MS质谱图特征碎片离子的相对分子质量的信息对色谱峰进行结构解析。对于有标样的组分,对照保留时间的一致性进行确定,基于外标法构建的回归方程对样品多酚各组分含量进行量化分析。因无法购买到5-咖啡酰奎宁酸和1,3-咖啡酰奎宁酸标准品,对其定量时参考相对应同分异构体,5-咖啡酰奎宁酸采用绿原酸标准曲线定量,1,3-咖啡酰奎宁酸采用3,5-二咖啡酰奎宁酸标准曲线定量。
1.4 统计分析
单因素试验指标的差异采用SAS 统计软件中ANOVA 方差分析,由Tukey分析均值差异的显著性,显著水平P<0.05。应用SPSS20.0(SPSS Inc.,Chicago,IL)作相关性分析,P<0.05表示显著差异,P<0.01表示极显著差异。
2 结果与分析
2.1 不同干燥方式对牛蒡片干燥时间及能耗的影响
由表1可见,VFD干燥时间最长,为16.30 h,耗能最大,每干燥1 kg水,需要消耗102.80 KW·h电能。VMD干燥时间最短,为0.48 h,能耗较小。2种联合干燥方式所需时间适中,耗能适中,其中AD&VMD与单一AD干燥相比,干燥时间缩短90.0%,耗能降低80.1%,VFD&VMD与单一VFD干燥相比,干燥时间缩短53.9%,耗能降低57.9%。
表1不同干燥方式对牛蒡片干燥时间及能耗率影响
Table1Effectofdryingmethodsonthedryingtime,dryingenergyconsumptionofburdockrootslices
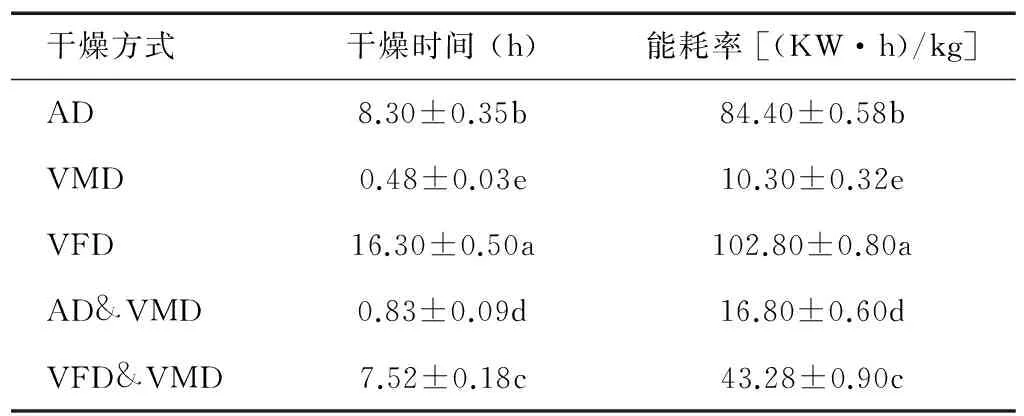
干燥方式干燥时间(h)能耗率[(KW·h)/kg]AD8.30±0.35b84.40±0.58bVMD0.48±0.03e10.30±0.32eVFD16.30±0.50a102.80±0.80aAD&VMD0.83±0.09d16.80±0.60dVFD&VMD7.52±0.18c43.28±0.90c
AD:热风干燥;VMD:真空微波干燥;VFD:真空冷冻干燥;AD&VMD:热风联合真空微波干燥;VFD&VMD:真空冷冻联合真空微波干燥。同一列数据后不同小写字母表示差异显著(P<0.05)。
2.2 不同干燥方式对牛蒡片多酚含量的影响
从图1中可以看出,不同干燥方式对牛蒡片中总酚含量影响显著。干燥所得样品中总酚含量依次为VFD>VFD&VMD > VMD>AD&VMD>AD,与VFD样品相比,AD、VMD、AD&VMD干燥后产品中总酚含量分别减少了30.13%、23.23%、26.33%,而VFD&VMD干燥后产品中总酚含量与VFD无显著差异。这是因为VFD条件下,热不稳定的多酚不易与氧接触,且在低温下干燥,因此酚类物质保留较好[7]。VFD&VMD干燥前期VFD干燥利于酚类物质保留,后期VMD干燥缩短干燥时间,因此总酚含量较高。
2.3 牛蒡片多酚各组分鉴定
图2为HPLC-DAD分析得到的牛蒡片中多酚组成,通过分子量(一级质谱)以及特征结构碎片(二级质谱)对其中4个主峰进行鉴定,并比对绿原酸及3,5-二咖啡酰奎宁酸标准品保留时间,获得鉴定结果如表2所示。
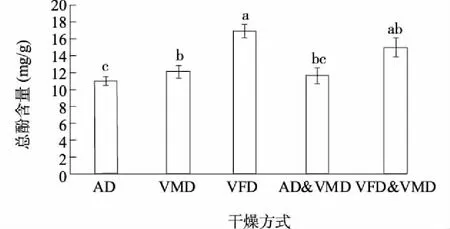
AD:热风干燥;VMD:真空微波干燥;VFD:真空冷冻干燥;AD&VMD:热风联合真空微波干燥;VFD&VMD:真空冷冻联合真空微波干燥。不同小写字母表示差异显著。图1 不同干燥方法对牛蒡片总酚含量的影响Fig.1 Effect of drying methods on the polyphenolic content of dried burdock root slices
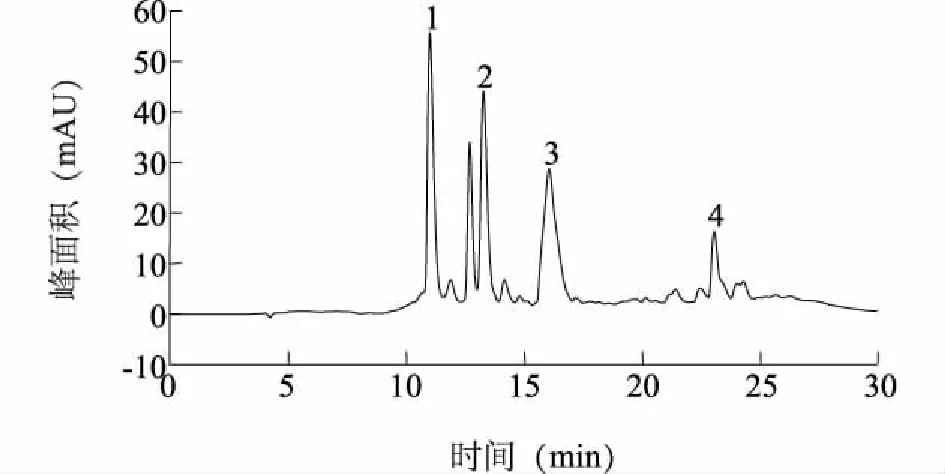
图2 牛蒡多酚HPLC图(检测波长280 nm)Fig.2 HPLC chromatograms of burdock root polyphenols (280 nm)
表2牛蒡片多酚组分鉴定
Table2Identificationofburdockrootpolyphenols

峰号保留时间(min)相对分子质量[M-H]-MS(m/z)碎片离子[M-H]-MS-MS(m/z)吸收峰(nm)牛蒡多酚种类110.970353191,179240,300,3285-咖啡酰奎宁酸213.217353191,179,173,135240,300,328绿原酸316.031515353,191,179,135240,300,3301,3-二咖啡酰奎宁酸423.021515353,191,179,161,135240,300,3303,5-二咖啡酰奎宁酸
峰2碎片离子m/z为191是奎宁酸192在质谱负模式条件下失去一个氢离子而得,碎片离子m/z为 179是由咖啡酸在质谱负模式条件下失去一个氢离子而得,准分子离子m/z为353=192+180-18-1,3个离子碎片与Clifford等[8]报道的3-咖啡酰奎宁酸离子碎片一致,因此判断峰2为3-咖啡酰奎宁酸,即绿原酸,并通过对照标准品保留时间,确定该化合物为绿原酸。
峰1中碎片离子m/z为191,是奎宁酸192在质谱负模式条件下失去了一个量数为1的氢离子碎片,可以判断峰1为绿原酸顺式异构体。比对Niranjan等[9]的研究结果,确定峰1为5-咖啡酰奎宁酸即新绿原酸。
峰3、峰4具有二咖啡酰奎宁酸的光谱特征,其中峰4二级质谱图的准分子离子峰[M-H]-的m/z为515,离子碎片[M-C9H6O3]-([M-H-162(咖啡酰基) ]- )的m/z为353 (咖啡酰奎宁酸),离子碎片[M-H-2C9H6O3]-的m/z为191,通过对照标准品保留时间,确定该化合物为3,5-二咖啡酰奎宁酸。峰3和峰4的二级质谱信息相似,是m/z为353的咖啡酰奎宁酸离子碎片经能量更高的碰撞进一步形成m/z191和179的特征离子碎片,比对文献[10]、[11]可确定峰3为1,3-二咖啡酰奎宁酸。
2.4 不同干燥方式对牛蒡片多酚各组分的影响
从表3中可以看出不同干燥方式得到的牛蒡片多酚物质组成较一致,但各组分间含量差异显著。VFD&VMD干燥所得样品中5-咖啡奎宁酸和绿原酸含量均最高,达3 219.9 μg/g、3 578.4 μg/g,其中绿原酸含量是VFD干燥的1.17倍,可见联合真空冷冻与真空微波干燥更利于单咖啡酰奎宁酸的保留。这是因为前半段真空冷冻干燥低温利于酚类物质保留,而后半段采用真空微波干燥显著缩短了干燥时间,使酚类物质得到较高保留。VFD干燥的牛蒡片中1,3-二咖啡酰奎宁酸和3,5-二咖啡酰奎宁酸含量显著高于其他干燥方式,其中3,5-二咖啡酰奎宁酸含量是热风干燥的2.08倍。这与Jeng等[11]的研究结果相似,即双咖啡酰基奎宁酸比单咖啡酰基奎宁酸对热更敏感,前者在低温条件下更稳定,而高温条件下更易降解。
表3不同干燥方式对牛蒡片多酚各组分含量的影响
Table3Effectofdryingmethodsonthepolyphenolcontentofdriedburdockrootslices
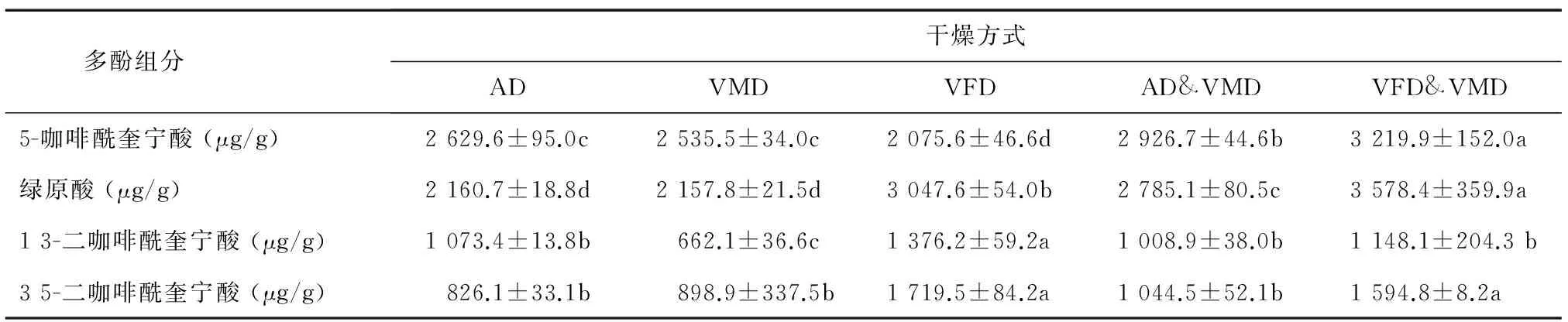
多酚组分 干燥方式ADVMDVFDAD&VMDVFD&VMD5-咖啡酰奎宁酸(μg/g)2629.6±95.0c2535.5±34.0c2075.6±46.6d2926.7±44.6b3219.9±152.0a绿原酸(μg/g)2160.7±18.8d2157.8±21.5d3047.6±54.0b2785.1±80.5c3578.4±359.9a13-二咖啡酰奎宁酸(μg/g)1073.4±13.8b662.1±36.6c1376.2±59.2a1008.9±38.0b1148.1±204.3b35-二咖啡酰奎宁酸(μg/g)826.1±33.1b898.9±337.5b1719.5±84.2a1044.5±52.1b1594.8±8.2a
AD:热风干燥;VMD:真空微波干燥;VFD:真空冷冻干燥;AD&VMD:热风联合真空微波干燥;VFD&VMD:真空冷冻联合真空微波干燥。同一行数据后不同小写字母表示差异显著(P<0.05)。
2.5 不同干燥方式对牛蒡片抗氧化能力的影响
从表4可知,不同干燥方式得到的牛蒡片DPPH+·清除能力、Fe3+还原能力及ABTS+·清除能力有显著差异。真空冷冻干燥的牛蒡片清除DPPH+·的IC50值最低,为0.76 mg/ml。AD、VMD、VFD、AD&VMD、VFD&VMD干燥牛蒡片清除DPPH+·自由基的抗氧化能力分别为5.91 mg/g,dw、6.53 mg/g,dw、10.04 mg/g,dw、6.46 mg/g,dw、8.26 mg/g,dw。铁还原能力依次为:VFD>VFD&VMD>VMD>AD&VMD>AD,其中真空冷冻干燥提取物的铁还原能力最强,为9.62 mg/g,dw,是AD干燥的1.37倍。真空冷冻干燥牛蒡片清除ABTS+·自由基能力最强,为36.45 mg/g,dw,真空冷冻联合真空微波干燥其次,是热风干燥的1.75倍。
以上研究不难发现,所有干燥方式中VFD所得牛蒡片各项抗氧化能力均最强,对比各干燥条件下多酚组分发现,VFD干燥条件下双咖啡酰基奎宁酸含量显著高于其他干燥方式。这是因为1,3-二咖啡酰奎宁酸和3,5-二咖啡酰奎宁酸这2种物质具有清除自由基的多个酚羟基基团,供电子能力较强,导致其抗氧化能力提高[12-13]。VFD&VMD干燥所得牛蒡片的抗氧化能力仅次于VFD干燥条件,但在干燥时间和能耗方面具有显著的优势。
2.6 不同干燥方式下牛蒡片多酚组分与抗氧化能力之间相关性分析
将不同干燥方式所得牛蒡片中多酚组分与抗氧化能力进行相关性分析,结果(表5)表明,3,5-二咖啡酰奎宁酸含量与清除DPPH+·自由基能力、铁还原能力及清除ABTS+·自由基能力均呈显著相关性,这表明产品中3,5-二咖啡酰奎宁酸含量越高,产品的抗氧化能力越强,营养价值越高。
表4不同干燥方式对牛蒡片抗氧化性的影响
Table4Effectofdryingmethodsontheantioxidantactivityofburdockrootslices
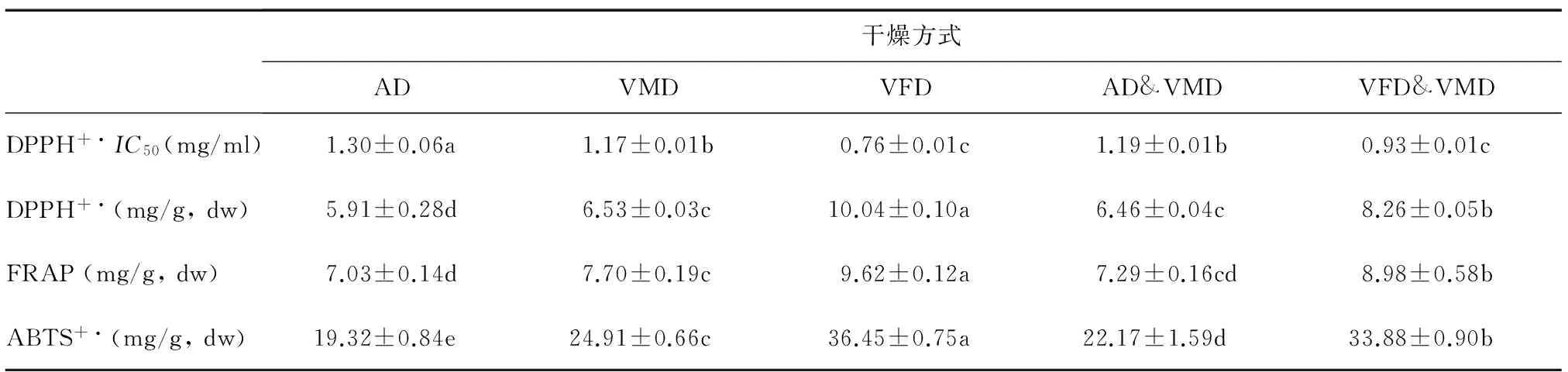
干燥方式ADVMDVFDAD&VMDVFD&VMDDPPH+·IC50(mg/ml)1.30±0.06a1.17±0.01b0.76±0.01c1.19±0.01b0.93±0.01cDPPH+·(mg/g,dw)5.91±0.28d6.53±0.03c10.04±0.10a6.46±0.04c8.26±0.05bFRAP(mg/g,dw)7.03±0.14d7.70±0.19c9.62±0.12a7.29±0.16cd8.98±0.58bABTS+·(mg/g,dw)19.32±0.84e24.91±0.66c36.45±0.75a22.17±1.59d33.88±0.90b
AD:热风干燥;VMD:真空微波干燥;VFD:真空冷冻干燥;AD&VMD:热风联合真空微波干燥;VFD&VMD:真空冷冻联合真空微波干燥。同一行数据后不同小写字母表示差异显著(P<0.05)。
表5不同干燥方式下牛蒡片多酚各组分与抗氧化的相关性
Table5Correlationanalysisonevaluationindicatorsofburdockslicespolyphenolcomponentsbydifferentdryingmethods
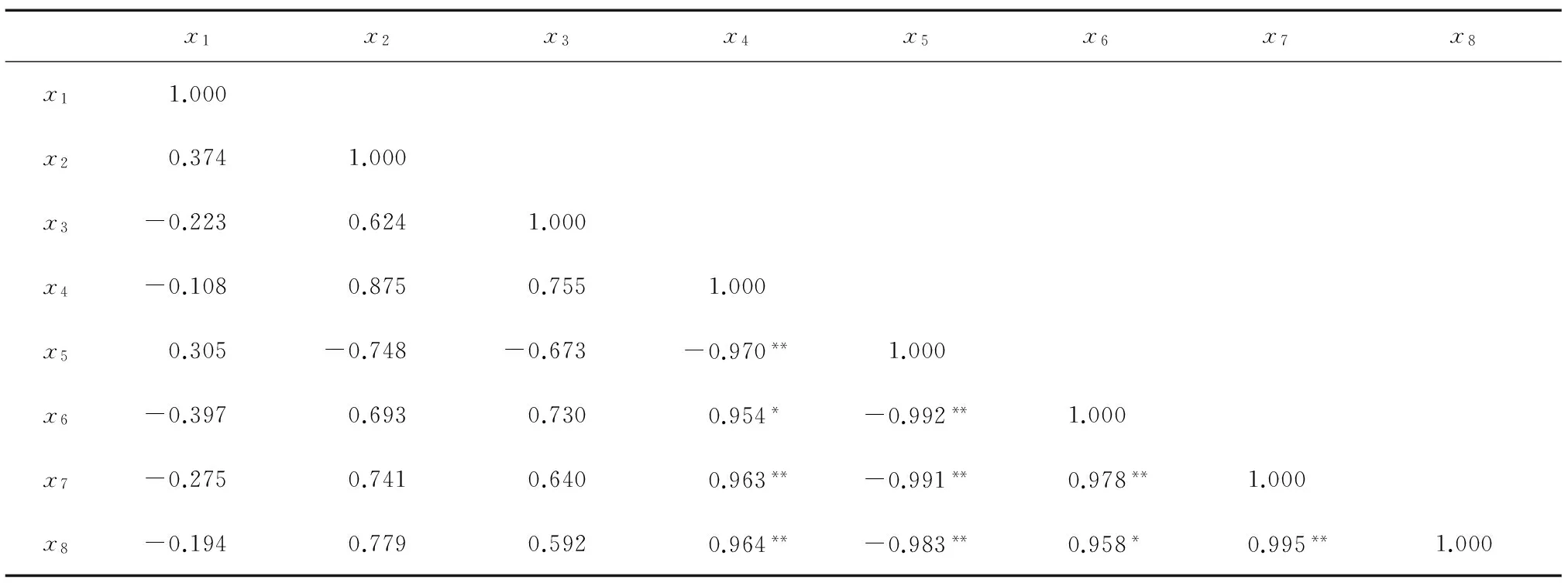
x1x2x3x4x5x6x7x8x11.000x20.3741.000x3-0.2230.6241.000x4-0.1080.8750.7551.000x50.305-0.748-0.673-0.970**1.000x6-0.3970.6930.7300.954*-0.992**1.000x7-0.2750.7410.6400.963**-0.991**0.978**1.000x8-0.1940.7790.5920.964**-0.983**0.958*0.995**1.000
x1~x8分别表示5-咖啡奎宁酸含量、绿原酸含量、1,3-二咖啡酰奎宁酸含量、3,5-二咖啡酰奎宁酸含量、DPPH+·IC50、DPPH+·AEAC、 FRAP AEAC、ABTS+·TEAC。*表示显著相关;**表示极显著相关。
3 结 论
不同干燥方式干燥牛蒡片所需时间和耗能趋势相同,且差异显著,依次为VFD>AD>VFD&VMD>AD&VMD>VMD。利用C30-HPLC-DAD-MS/MS分析方法共鉴定出牛蒡片中4种咖啡酸的衍生物,即5-咖啡奎宁酸、绿原酸、1,3-二咖啡酰奎宁酸和3,5-二咖啡酰奎宁酸。相比于单一干燥方式,联合干燥方式更利于单咖啡酰基奎宁酸的保留,其中VFD&VMD干燥所得牛蒡片中5-咖啡奎宁酸和绿原酸含量最高,VFD干燥所得牛蒡片中1,3-二咖啡酰奎宁酸和3,5-二咖啡酰奎宁酸含量最高;VFD干燥所得牛蒡片的清除DPPH+·、ABTS+·和铁还原能力均最强,VFD&VMD干燥所得牛蒡片抗氧化能力仅次于VFD干燥所得样品,显著高于AD、VMD、AD&VMD干燥所得样品。
[1] 卢可可,郭晓晖,李富华,等.不同热风干燥方式对香菇多酚组成及其抗氧化活性的影响[J].现代食品科技,2015,31(9):185-191.
[2] 陈玮琦,郭玉蓉,张 娟,等.干燥方式对苹果幼果干酚类物质及其抗氧化性的影响[J].食品科学,2015,36(5):33-37.
[3] PIGA A,DEL CARO A,CORDA G.From plums to prunes: influence of drying parameters on polyphenols and antioxidant activity[J].Journal of Agricultural and Food Chemistry,2003, 51(12):3675-3681.
[4] 朱翠平,张钟元,李大婧,等.不同干燥方式对牛蒡脆片品质的影响[J].江苏农业科学,2017,45(7):181-184.
[5] 李 静,聂继云,毋永龙.Folin-Ciocalteus 法测定马铃薯中的总多酚[J].中国马铃薯,2014,28(1):27-30.
[6] JIANG D Q,GUO Y,XU D H,et al.Antioxidant and anti-fatigue effects of anthocyanins of mulberry juice purification (MJP) and mulberry marc purification (MMP) from different varieties mulberry fruit in China[J].Food and Chemical Toxicology,2013,59(9):1-7.
[7] DATTA S,DAS A,BASFORE S,et al.Value addition of fruits and vegetables through drying and dehydration[M]. India: Springer,2015.
[8] CLIFFORD M N,JOHNSTON K L,KNIGHTS,et al.Hierarchical scheme for LC-MS n identification of chlorogenic acids[J].Journal of Agricultural and Food Chemistry,2003,51(10):2900-2911.
[9] NIRANJAN A,BARTHWAL J,LEHRIA,et al.Development and validation of an HPLC-UV-MS-MS method for identification and quantification of polyphenols inArtemisiapallensL.[J].Acta Chromatographica, 2009, 21(1):105-116.
[10] WEISZG M,KAMMERER D R,CARLE R.Identification and quantification of phenolic compounds from sunflower (HelianthusannuusL.) kernels and shells by HPLC-DAD/ESI-MS[J]. Food Chemistry,2009,115(2):758-765.
[11] KRIZMAN M,BARICEVIC D,PROSEK M.Determination of phenolic compounds in fennel by HPLC and HPLC-MS using a monolithic reversed-phase column[J].Journal of Pharmaceutical and Biomedical Analysis,2007,43(2):481-485.
[12] JENG T L,LAI C C,LIAO T C,et al.Effects of drying on caffeoylquinic acid derivative content and antioxidant capacity of sweet potato leaves[J].Journal of Food and Drug Analysis,2015,23 (4):701-708.
[13] XIANG Z,NING Z.Scavenging and antioxidant properties of compound derived from chlorogenic acid in South-China honeysuckle[J].LWT-Food Science and Technology,2008,41(7):1189-1203.

