一株杀线虫活性海洋真菌BH-0531的培养特性及种属鉴定
李 娜,张金源,苗利华,冯 欣,2,孟庆恒,2*,孙建华,2
(1.天津师范大学 生命科学学院,天津 300387;2.天津市动植物抗性重点实验室,天津 300387)
菌株BH-0531是一株以松材线虫为靶标,从渤海湾底(E:117°53′23.2″;N:38°55′51″)水中分离得到的具有杀线虫活性的海洋丝状真菌。该菌株的代谢产物不仅具有良好的杀线虫作用[1],还对枯草芽孢杆菌、金黄色葡萄球菌和白色念珠菌等具有明显的抑菌活性,显示出广谱的抑菌作用[2]。进一步的研究表明,其代谢产物可明显影响土壤中的微生物类群和数量,对土壤的去真菌化作用显著,有利于植物真菌病害的防治[3],显示出良好的开发潜力,因此,有必要进一步明确其培养特性和分类地位。
前期的鉴定结果显示,菌株BH-0531具有枝顶孢属(Acremonium)的属性。枝顶孢属旧称头孢霉属(Cephalosporium),因生物合成头孢菌素而具有十分重要的地位[4]。该属是一个无性型的属,有超过150个种,目前国内已明确的种仅有13个[5]。其次生代谢产物种类丰富,如环肽、蒽醌类、酚类等,均具有良好的生物活性[6]。这也使得菌株BH-0531的种性研究显得更有必要。据此,本实验以菌株BH-0531为研究对象,对其形态结构和生长特性等生物学特性进行了观察分析,并借助Biolog微生物鉴定系统,以及5.8SrDNA-ITS序列分析对菌株进行了分类鉴定,旨在为该菌株的进一步研究和应用提供实验依据。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株
海洋真菌BH-0531(菌种保藏号CGMCC-5445):天津师范大学生命科学学院微生物实验室。
1.1.2 供试培养基
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基:去皮马铃薯200 g,葡萄糖20 g,无水硫酸镁0.5 g,琼脂20 g,补蒸馏水至1000mL。
查氏琼脂培养基:查氏琼脂培养基47 g,1 000 mL蒸馏水,煮沸溶解。
海水琼脂培养基:蛋白胨2 g,葡萄糖10 g,酵母膏1 g,海水600 mL,补蒸馏水至1 000 mL。
20%麦芽汁琼脂培养基:Oxoid麦芽抽提物20 g,琼脂18 g,蒸馏水1 000 mL,煮沸溶解,冷却后调整pH值至5.5±0.2(25 ℃)。
玉米粉琼脂培养基:玉米粉30 g,琼脂15 g,蒸馏水1 000 mL,玉米粉文火煮沸后计时1 h,4层纱布过滤。
上述培养基均121℃灭菌20 min。
1.1.3 化学试剂
葡萄糖(分析纯):天津市凤传化学试剂有限公司;琼脂(分析纯):天津市珠海卫生材料厂;硫酸镁(分析纯):西安化学试剂厂;蛋白胨、酵母膏、查氏琼脂培养基:北京奥博星生物技术有限责任公司;氯化铵、硝酸钠(均为分析纯):天津市北方天医化学试剂厂;FF-IF接种液、Oxoid麦芽抽提物(均为生物试剂):天津福宝德科技发展有限公司;乳酸酚棉蓝染液(生物试剂):天津为科生物技术有限公司。
1.2 仪器与设备
SPX-250B-Z生化培养箱:上海博迅实业有限公司医疗设备厂;YXQG02型电热式灭菌锅:山东新华医疗器械厂;LEICA DME(MVC2000)显微镜、LEICA DM6000显微镜:上海徕卡显微系统有限公司;Biolog微生物鉴定系统(GENIIIMicrostation):美国Biolog公司。Catalog No.3532-220 volt model浊度仪:天津福宝德科技发展有限公司。
1.3 实验方法
1.3.1 供试菌种的活化
将保存的菌种BH-0531接种于PDA培养基斜面试管中,26℃培养7 d。
1.3.2 海洋真菌BH-0531的生物学特性观察
(1)菌落培养特性观察
将活化好的菌种用打孔器在菌落边缘切取直径6 mm的菌丝块分别接种于不同培养基平板中央,26℃培养7 d,十字交叉法测量菌落直径,观察并记录初生菌丝颜色、菌落颜色变化、表面特征、产色素情况等,菌株培养条件见表1。

表1 菌株BH-0531的培养条件Table 1 Culture conditions of strain BH-0531
(2)菌丝及产孢结构的显微观察
采用小室培养法[7]。26℃小室培养6 d后,用乳酸酚棉蓝染液染色,显微镜下观察菌丝、孢子和产孢器结构特征。
1.3.3 Biolog微生物鉴定系统分析
将已活化两代的菌种接种于20%麦芽汁琼脂培养基中,26℃培养7 d,挑取孢子于FF-IF接种液中,利用浊度仪配制成孢子浓度为(75±2)%的菌悬液,将菌悬液按每孔100μL的接种量添加到FF鉴定板上,鉴定板置于26℃培养箱中培养,在24 h、48 h、72 h、96 h、168 h分别用Biolog微生物鉴定系统读取结果,获得菌株BH-0531对96种碳源的利用情况,对结果进行分析。
1.3.4 序列比对分析
采用通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')分别作为上下游引物扩增ITS序列,菌种样品送至北京华大基因科技股份有限公司进行测序(www.genomics.cn),序列提交到Genbank进行Blast对比。
2 结果与分析
2.1 不同培养条件下菌株BH-0531的培养及生长特性
2.1.1 菌株BH-0531在不同海水含量中的生长情况

图1 菌株BH-0531在不同海水含量中的菌落直径Fig.1 Colony diameter of strain BH-0531 in different seawater concentrations
由图1可知,菌株BH-0531在0~60%海水含量范围内的培养基中均能生长,且随着培养基海水含量的增加,菌落直径先增加后减小,在20%海水含量的培养基中的菌落直径最大,为4.73 cm,与其他海水含量培养基的菌落直径差异显著(P<0.05),因此,菌株BH-0531生长的最适海水含量为20%。
2.1.2 菌株BH-0531在不同培养基中的生长情况

图2 菌株BH-0531在不同培养基中的菌落直径Fig.2 Colony diameter of strain BH-0531 in different media
由图2可知,菌株BH-0531在各培养基中均能正常生长,培养7 d后,PDA培养基、查氏琼脂培养基和20%海水琼脂培养基中的菌落直径分别为4.12cm、3.43cm、4.73cm,菌落直径差异显著(P<0.05)。因此,20%海水琼脂培养基更适合该菌株生长。
2.1.3 菌株BH-0531在不同氮源中的生长情况
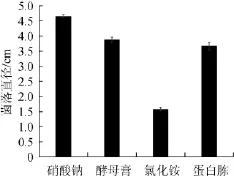
图3 菌株BH-0531在不同氮源中的菌落直径Fig.3 Colony diameter of strain BH-0531 in different nitrogen sources
由图3可知,菌株BH-0531在不同氮源培养基的菌落直径差异显著(P<0.05),其中菌株对硝酸钠的利用最好,菌落直径最大,优于其他氮源(酵母膏、氯化铵、蛋白胨)。因此,菌株BH-0531的最适氮源为硝酸钠。
2.1.4 菌株BH-0531在不同pH条件下的生长情况

图4 菌株BH-0531在不同pH下的菌落直径Fig.4 Colony diameter of strain BH-0531 under different pH
由图4可知,菌株BH-0531在pH 4~9的范围内均能良好生长。当pH值为6时,菌落直径最大,与pH值为7时的菌落直径无显著性差异(P>0.05),而两者与其他pH条件下的菌落直径有显著性差异(P<0.05),因此,菌株BH-0531的最适pH值为6~7。
2.1.5 菌株BH-0531在不同温度条件下的生长情况
由图5可知,随着培养温度的升高,菌株菌落直径呈先增加后减小的趋势,适合菌株BH-0531生长的温度为22~28℃,且温度为26℃时,菌落直径最大,与其他温度条件下的菌落直径差异性显著(P<0.05),表明该菌株的最适温度为26℃。

图5 菌株BH-0531在不同温度中的菌落直径Fig.5 Colony diameter of strain BH-0531 in different temperatures
2.2 菌株BH-0531的Biolog鉴定及碳源谱分析
FF鉴定板共有96种碳源,结果显示,菌株BH-0531可利用的碳源为76种。值得注意的是,在4种胺类碳源中,菌株BH-0531仅能利用腐胺,其他不能被利用,表明该菌株具有一定的腐生特性。由于Biolog微生物鉴定系统数据库中无对应菌种,因此不能据此得出明确的菌种鉴定结果。
2.3 菌株BH-0531的形态特征观察结果
将菌株BH-0531在马铃薯琼脂培养基上26℃培养14 d后,观察菌株形态,结果见图6。

图6 菌株BH-0531的形态学特征Fig.6 Morphological characteristics of strain BH-0531
由图6可知,菌株BH-0531在7 d直径达到4.1~4.2 cm,14 d直径为6.9~7.0 cm。菌落有局限,较平坦,质地绒毡状,初生菌丝体白色,随培养时间延长,颜色变为粉色,菌落质地变为粉质状,稍湿,边缘整齐不一,菌落背面呈淡橘黄色(见图6A、图6B)。显微观察结果显示,菌丝有隔,分枝明显,气生菌丝直径1.5~2.0μm,营养菌丝直径1.0~1.5μm,常形成不编结绳状菌丝束,分生孢子梗自菌丝垂直生出,逐渐变细,无隔、无分枝,与菌丝间有隔,直立,单生,长度为20~30μm,分生孢子顶生,可形成黏性孢子头,孢子无色,近圆形、椭圆形,顶端有尖,大小(2.5~2.7)μm×(5.0~7.0)μm,壁光滑,未见厚垣孢子(见图6C、图6D)。繁殖方式为分生孢子萌发生成菌丝(见图6E)。上述特征与已有的枝顶孢霉属(Acremonium)[8-9]的特征描述具有一致性。
进一步的观察发现,该菌株在玉米粉琼脂(产孢)培养基上培养5 d后,可见菌丝间的接合,并观察到由菌丝形成的长形子囊,内含4~8个子囊孢子。子囊孢子多为长椭圆形,一端有尖,表面相对光滑,大小为(7.5~12.5)μm×(2.5~5.0)μm,近无色。子囊孢子在子囊内间隔排布,间距2.5~5μm不等(图6F)。实验条件下未见子囊壳形成。
2.4 ITS序列比对分析
将测得的序列经BLAST进行序列相似性比对,构建系统发育树,结果见图7。

图7 菌株BH-0531基于5.8S rDNA-ITS序列的系统发育树Fig.7 Phylogenetic tree of strain BH-0531 based on 5.8S rDNAITS sequence
由图7可知,菌株BH-0531序列与Acremonium potronii isolate35同源性达到了100%,借助MEGA6.06构建系统发育树后,发现菌株BH-0531与Acremonium potronii isolate 35在同一分支,且其与Acremonium potronii isolate 194、Acremoniumpotronii isolate30、Acremonium potronii isolate MS02同源性为99%。菌株BH-0531种属地位明确指向波氏枝顶孢霉(Acremonium potronii)。
枝顶孢属是一个依据菌株无性阶段所显现的属性和亲缘关系而划分的无性型属[10],按照GAMESW等[11-12]的体系可划分为3组,其有性阶段多指向翅孢壳属(Emericellopsis)[13]。研究结果显示,该菌株虽然在产孢培养基条件下可观察到子囊和子囊孢子,但未观察到子囊壳的形成,其子囊壳的类型未知,因而将其划归翅孢壳属(Emericellopsis sp.)的依据不足。相对而言,依据无性阶段的显微结构和菌落培养特征,特别是依据ITS序列进行的BLAST对比结果,将其划归枝顶孢属(Acremonium sp.)的证据显得更加充分,并将该菌种的种属地位指向波氏枝顶孢霉(A.potronii)。
菌株BH-0531分离自渤海湾底水,培养特性显示,该菌株可在较高浓度的海水条件下正常生长,能以海水中富含的硝态氮为良好氮源,并可利用腐胺,这与已记录的A.potronii菌株(多为内生菌或病原菌)存在着营养特性和来源上的区别[14-15]。此外,对比还发现,菌株BH-0531在菌落特征、孢子形态和大小等方面也都存在着一定的差异[5]。据此,鉴定菌株BH-0531为A.potronii的海栖型变种:Acremonium potronii var.marine BH-0531。
3 结论
本研究以海洋丝状真菌BH-0531为研究对象,通过设置不同的培养基、海水浓度、氮源、pH、温度等培养条件对该菌株的培养特性进行了研究,并在传统形态学观察的基础上,通过5.8SrDNA-ITS序列对比及Biolog微生物自动鉴定系统对该菌株进行了菌种鉴定。研究结果表明,菌株BH-0531最适海水含量为20%,最适培养条件为20%海水琼脂培养基,温度26℃,pH6~7,氮源为硝酸钠;ITS序列分析结果表明,菌株BH-0531序列与Acremonium potronii isolate35同源性达到了100%,结合形态学特征观察,鉴定该菌株为A.potronii的海栖型变种:Acremonium potronii var.marine BH-0531,为进一步开发该菌株奠定了种属基础,并为其发酵培养条件的进一步优化提供了一定的生物学培养特性的理论依据。
参考文献:
[1]MENGQ H,SHIX X.Isolation of an Acremonium sp.from a screening of 52 seawater fungal isolates and preliminary characterization of its growth conditionsand nematicidal activity[J].Biotechnol Lett,2012,34(10):1847-1850.
[2]孟凡欢,王勇勇,蒙春蕾.渤海湾丝状海洋真菌抑菌活性菌株的调查研究[J].天津师范大学学报:自然科学版,2014,34(4):64-67.
[3]黄 敏,刘晓霞,申佩娟.海洋枝顶孢霉BH0531对黄瓜根结线虫防治的微生态效应[J].中国酿造,2016,35(3):52-56.
[4]JOSEPG,JOSEPA G,ALBERTOM S.Developments in reviews fungal taxonomy[J].Clin Microbiol,1999,12(3):454-500.
[5]WANG Y Z,GUO F,ZHOU Y G.Survey of Acremonium species from Chinawith threenew records[J].菌物学报,2002,21(2):192-195.
[6]姚 磊,徐良雄,薛璟花.枝顶孢属真菌的抑菌活性及其代谢产物研究[J].热带亚热带植物学报,2012,20(2):192-196.
[7]沈 萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007:74.
[8]DASS,SAHA R,DAR SA.Acremonium species:A review of the etiological agentsof emerging hyalohyphomycosis[J].Mycopathologia,2010,170(6):361-375.
[9]裘维蕃.菌物学大全[M].北京:科学出版社,1998:890.
[10]PERDOMOH,SUTTON D A,GARCIA D.Spectrum of clinically relevant Acremonium speciesin the United States[J].J Clin Microbiol,2011,49(1):243-256.
[11]GAMESW.Cephalosporium-artige Schimmelpilze(Hyphomycetes)[M].Stuttgart:Gustav Fischer Verlag,1971:253-258.
[12]GAMESW.Cephalosporium-like Hyphomycetes:some tropical species[J].Trans Brit Mycol Soc,1975,64(3):389-404.
[13]中国科学院微生物研究所.常见与常用真菌[M].北京:科学出版社,1973:210-215.
[14]FORSTER R K,REBELL G,STILES W.Recurrent keratitis due to Acremonium potronii[J].Am J Ophthalmol,1975,79(1):126-128.
[15]ALEJANDRA G,JOSEPA G,JOSEPC.Twonew speciesof Acremonium from Spanish soils[J].Mycologia,2012,104(6):1456-1465.

