HPLC-ELSD法同时测定酵母发酵液中的多元醇
王晓丹,白晓燕,朱国军,雷安亮,陈美竹,邱树毅*
(1.贵州大学 贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025;2.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;3.贵州珍酒酿酒有限公司,贵州 遵义 563000)
绝大多数白酒均呈甜味,甜味是一种让人感觉比较愉悦的口感,尤其在酒精度高的白酒中,微甜味可以使酒体更加绵柔醇厚。这种甜味主要来自于醇类[1]。多元醇是酒醅中的酵母菌在生成酒精的同时通过发酵还原糖所产生的,在酒中可起缓冲作用,使白酒更加丰满醇厚[1-2]。白酒中的多元醇种类繁多,主要包括丙三醇、阿拉伯糖醇、核糖醇、赤藓糖醇、木糖醇、山梨醇、甘露醇、半乳糖醇、麦芽糖醇等,甜度随羟基数增多而增强[2]。由于多元醇沸点高,属于难挥发性醇类,不易随蒸馏进入酒中,在蒸馏酒醅时,一小部分多元醇会随着水蒸气被带入酒中,因此白酒中多元醇含量极低,定量分析的难度较大[3]。
目前,白酒中多元醇的检测方法主要有:薄层层析法、高效液相色谱-蒸发光散射检测器(high performance liquid chromatography-evaporativelight-scattering detector,HPLCELSD)[4]、液质联用法[5]、毛细管气相色谱法[6]、离子色谱积分脉冲安培法[7-8]等。气相色谱法由于其高分辨率、高灵敏度、低检测限等优点而被广泛使用。但多元醇具有高极性、强亲水性以及低挥发性的特性,气相色谱法测定时,必须将糖醇衍生化为易挥发且稳定的衍生物,操作繁琐而复杂,容易带来误差[9]。离子色谱法虽然灵敏度较好,但是受环境温度的影响大,且由于糖类在电极表面能将某些分子氧化或还原,因而该方法准确性受限[10]。高效液相色谱-蒸发光散射法具有基线稳定、分离效果良好,结果准确、样品处理简单、测定速度快等优点,因此在本研究中选用高效液相色谱-蒸发光散射法对酵母发酵液中多元醇进行测定。
由于白酒酿造中,多元醇不易随蒸馏进入酒中,本研究建立一种高效液相色谱-蒸发光散射法对酵母菌发酵液中多元醇种类及含量进行测定,以课题组前期从酱香型大曲和酒醅中分离的酵母菌株为研究对象,测定酵母菌产多元醇类物质的能力。以期找到在白酒酿造中对多元醇产生能力较强的酵母菌,为后期白酒中多元醇的提高奠定基础。
1 材料与方法
1.1 材料与试剂
丝孢酵母(Trichosporon coremiiforme)(FBKL2.0118、FBKL2.0307、FBKL2.0315)、娄德酵母(Lodderomyceselongisporus)FBKL2.00130、库德毕赤酵母(Pichia kudriavzevii)FBKL2.0310分离筛选于酱香型大曲和酒醅中并保藏于贵州省发酵工程与生物制药重点实验室。
D-阿拉伯糖醇(纯度≥98%)、D-核糖醇(纯度≥98%)、赤藓糖醇(纯度≥99%):上海源叶生物科技有限公司;木糖醇(纯度≥99.5%)、山梨糖醇(纯度≥98%):天津市科密欧化学试剂有限公司。
酵母膏胨葡萄糖琼脂(yeast extract peptone dxtrose,YEPD)培养基:酵母膏10 g,蛋白胨20 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,121℃灭菌20 min。
酵母种子培养基:葡萄糖20 g,酵母粉10g,蛋白胨20 g,蒸馏水1 000 mL,121℃灭菌20 min。
酵母发酵培养基:葡萄糖200 g,酵母粉10 g,蛋白胨20 g,蒸馏水1 000 mL,115℃灭菌20 min。
1.2 仪器与设备
Milli-Q Academic密理博超纯水仪:密理博(上海)贸易有限公司;Agilent1260高效液相色谱仪、Agilent G4260B蒸发光散射检测器、SPEC18固相萃取小柱(200 mg,3 mL)、Agilent Hi-plexCa液相色谱柱(7.7 mm×300 mm,8μm):安捷伦科技(中国)有限公司。
1.3 方法
1.3.1 溶液的配制
精确称取D-阿拉伯糖醇、D-核糖醇、赤藓糖醇、木糖醇及山梨糖醇标准品0.01 g于10 mL容量瓶中,用二次蒸馏水分别配制成质量浓度为1.0 mg/mL的标准储备溶液,并用0.22μm微孔滤膜过滤。准确称取D-阿拉伯糖醇、D-核糖醇、赤藓糖醇、木糖醇及山梨糖醇标准品各0.500 0 g于50 mL容量瓶中,配制成质量浓度为10.0 mg/mL的多元醇混合标准品储备溶液,用蒸馏水稀释成质量浓度分别为8.0 mg/mL、6.0 mg/mL、4.0 mg/mL、2.0 mg/mL、1.0 mg/mL、0.8mg/mL、0.6mg/mL的混合标准工作液,并用0.22μm微孔滤膜过滤。
1.3.2 样品处理
大数据常用的数据分析处理技术包括云计算和Mapreduce系统、数据库、可视化技术等。云计算是大数据分析处理技术的核心原理,也是大数据分析应用的基础平台。Mapreduce系统提出简化了数据的计算过程,避免了大量数据传输。数据库则是为用户提供了各种数据以及获取数据的方式,可视化技术即运用计算机图形学和图像处理技术,将分析出来的数据转换为图形或图像形式,与用户进行交互处理。这一技术极大地方便了通过数据及时掌握生产的内在变化[1]。随着数据处理软件的不断更新升级,越来越多的多样化功能软件将被应用在工业生产的大数据动态分析中,自动为用户展现最直观的结果。
参照白小燕等[11]的方法,将酵母菌株经YEPD培养基活化后接种到酵母种子培养基中,在30℃、160 r/min条件下扩大培养24 h即为种子培养液,种子培养液按照5%的接种比例接种到装液量为50 mL/250 mL的酵母发酵培养基中,30℃、160 r/min摇瓶培养5 d后获得发酵液。
吸取5 mL发酵液于试管中,65℃水浴10 min后转移到离心管中,10 000 r/min离心10 min,获得上清液并经C18固相萃取小柱净化,再用0.22μm水系滤膜过滤后,待高效液相色谱仪分析。
1.3.3 高效液相色谱条件
色谱条件:Agilent Hi-plexCa色谱柱(7.7 mm×300 mm,8 μm);流动相:纯水;流速:0.5 mL/min;柱温:70℃;进样量:4μL;检测器:蒸发光散射检测器(ELSD);雾化温度为60℃;蒸发温度为60℃;增益:2;氮气(纯度为99.999%)为载气。采用5种多元醇标准品的色谱峰保留时间对发酵液中多元醇进行定性;用外标法进行定量分析。
2 结果与分析
2.1 5种多元醇标准品及样品高效液相色谱检测结果
由图1可知,HPLC-EISP法可以检测到酵母发酵体系中的主要成分葡萄糖和甘油,同时还可以测到D-阿拉伯糖醇、D-核糖醇、赤藓糖醇、木糖醇和山梨醇这五种多元醇,因此说明此方法能够准确分析酵母发酵多元醇的代谢成分的变化。从多元醇标准品得到各多元醇的保留时间为:葡萄糖13.329 min,D-核糖醇16.869 min,赤藓糖醇19.568 min,甘油20.349,D-阿拉伯糖醇23.143 min;木糖醇28.103 min,山梨醇29.223 min。将酵母发酵液和多元醇标准品对比可得,酵母FBKL2.0118发酵液中含有D-核糖醇和D-阿拉伯糖醇;酵母FBKL2.0315发酵液中含有赤藓糖醇;酵母FBKL2.0310发酵液中含有甘油、D-阿拉伯糖醇、木糖醇和山梨醇,且由于残糖量过高,葡萄糖已经超出检测限,出现平头峰;酵母FBKL2.0073发酵液中含有D-阿拉伯糖醇;酵母FBKL2.0307发酵液中含有D-阿拉伯糖醇和山梨醇。进一步优化D-阿拉伯糖醇、D-核糖醇、赤藓糖醇、木糖醇和山梨醇五种多元醇检测方法。
2.2 回归方程、线性范围和检出限
配制不同质量浓度的5种多元醇混合标准溶液,在相同试验条件下进行测试分析,根据测得的峰面积(Y)和相对应的多元醇质量浓度(X)进行线性回归,得到5种多元醇标准品的线性回归方程和相关系数R;以信噪比等于3(S/N=3)为标准[12],得到5种多元醇的检出限,结果如表1所示。由表1可知,5种多元醇的相关系数R在0.996~0.999之间,表明在各自线性范围内5种多元醇的质量浓度与峰面积均具有良好的线性关系。5种多元醇检出限在0.045~0.058mg/mL之间,表明该方法能够实现多元醇含量的测定。
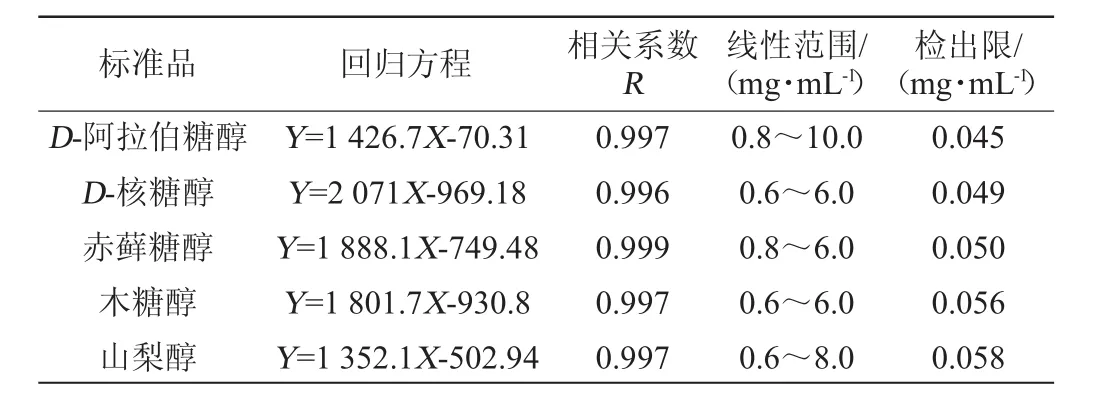
表1 5种多元醇标准品的回归方程、线性范围及检出限Table 1 Regression equation,linear range and limit of detection of 5 polyhydric alcohols
2.3 精密度实验

表2 精密度实验结果Table 2 Results of precision tests
采用HPLC-ELSD法对5种多元醇的混合标准工作溶液(1.0 mg/mL)平行测定6次,记录色谱峰面积,计算相对标准偏差(relativestandard deviation,RSD),判断该检测方法的精密度[13-15],结果如表2所示。由表2可知,5种多元醇含量检测结果的相对标准偏差(RSD)均在1.22%~4.53%之间,说明该实验方法精密度良好。
2.4 方法的回收率试验
用菌株FBKL2.0310制备相同酵母发酵液2份,其中一份发酵液作为本底,另一份发酵液添加一定量的5种多元醇溶液进行加标回收率试验,设置3个水平,每个水平重复进样6次,采用HPLC-ELSD法进行检测,计算回收率和RSD值[16-17],结果如表3所示。由表3可知,5种多元醇的平均回收率在96.73%~100.46%之间,RSD值为0.22%~3.31%,说明该方法准确度较高,可以用于实际酵母发酵液的检测。
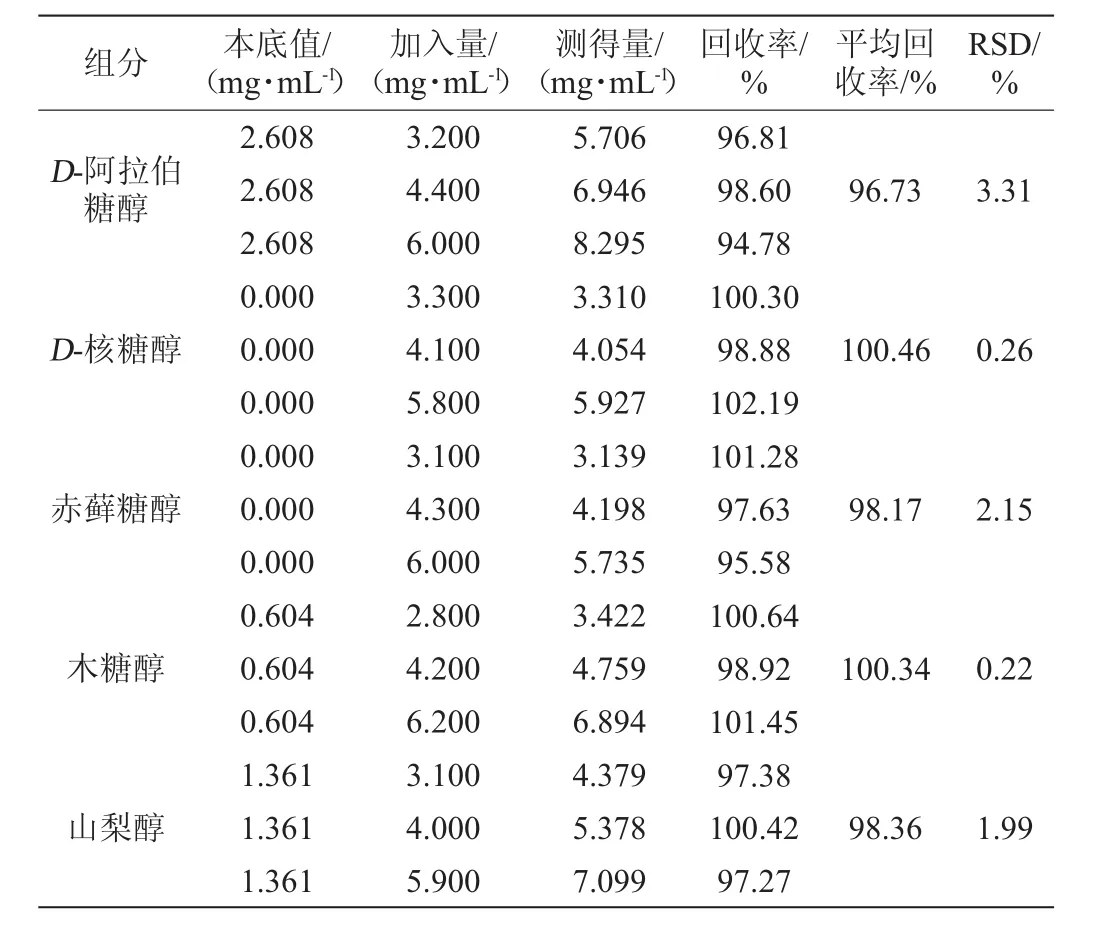
表3 样品加标回收率试验结果Table 3 Results of samples adding standard recovery rates tests
2.5 稳定性和重现性试验
取5种多元醇的混合标准工作溶液(1.0 mg/mL),放置于4 ℃冰箱中,分别于0、4 h、8 h、12 h、16 h、24 h时取样,进行多元醇含量测定,测得标品中D-阿拉伯糖醇、D-核糖醇、赤藓糖醇、木糖醇、山梨醇的峰面积相对标准偏差(RSD)(n=6)分别为2.28%、1.75%、1.99%、1.88%、2.84%和2.10%。表明该方法对于5种多元醇在24 h内测定稳定性较好。
按样品发酵液制备方法平行操作,取菌株FBKL2.0310制备的发酵液6份,平行进样3次,测得发酵液中D-阿拉伯糖醇、D-核糖醇、赤藓糖醇、木糖醇、山梨醇的峰面积相对标准偏差(RSD)分别为1.03%、1.36%、0.40%、1.87%和0.37%,表明本方法重现性良好。
2.6 酵母菌株发酵液中多元醇定量分析
本课题组前期从酱香型大曲和酒醅中筛选到利用葡萄糖产生糖醇能力较强的酵母菌株FBKL2.0130、FBKL2.0118、FBKL2.0307、FBKL2.0310、FBKL2.0315,并以这5株酵母菌作为发酵菌株,接种到发酵培养基中于30℃、160 r/min摇瓶培养5 d得到发酵液,利用高效液相色谱-蒸发光散射检测器法对5株酵母发酵液中多元醇进行测定,将测得各多元醇峰面积代入相应的回归方程得到各多元醇的含量,定量结果如表4所示。由表4可知,菌株FBKL2.0130产D-阿拉伯糖醇能力最强(12.05 g/L),并且产多元醇总量最多(13.03 g/L);菌株FBKL2.0118产D-核糖醇和D-阿拉伯糖醇;菌株FBKL2.0307产D-阿拉伯糖醇和山梨糖醇;菌株FBKL2.0310能够产D-阿拉伯糖醇、木糖醇和山梨糖醇,菌株FBKL2.0315仅可以产赤藓糖醇。

表4 不同酵母发酵液中多元醇含量Table 4 Polyhydric alcohols contents in different yeast fermentation broth
3 结论
本实验建立了高效液相色谱-蒸发光散射(HPLC-ELSD)同时检测酵母发酵液中D-阿拉伯糖醇、D-核糖醇、赤藓糖醇、木糖醇、山梨醇的方法。结果表明,5种多元醇在0.8~6.0 mg/mL质量浓度范围内与色谱峰面积呈良好的线性关系(相关系数R均≥0.996);精密度实验结果相对标准偏差(RSD)均<5%,回收率为96.73%~100.46%,重现性和样品在24 h内稳定性的RSD均<1.90%,表明该方法具有良好的准确性、重现性和稳定性。菌株FBKL2.0130产D-阿拉伯糖醇能力最强(12.05g/L);且产多元醇总量最多(13.03g/L)。
本实验以酱香型白酒酿造过程中大曲和酒醅分离的酵母为研究对象,运用本方法能够在30 min内同时测定到酵母发酵液中的D-阿拉伯糖醇、D-核糖醇、赤藓糖醇、木糖醇、山梨醇,为白酒的风格特征的凸显和品质的保证提供了科学依据和保证。
参考文献:
[1]孙 洁,李好转,孙立臻,等.芝麻香型白酒酒醅中多元醇分析方法探讨[J].酿酒科技,2015(6):51-53.
[2]TAT L,COMUZZOP,STOLFOI,et al.Optimization of wineheadspace analysisby solid-phasemicroextractioncapillary gaschromatography with massspectrometric and flameionization detection[J].Food Chem,2005,93(2):361-369.
[3]韩兴林,王 勇,魏金旺,等.清香型白酒中多元醇含量的分析研究[J].酿酒科技,2013(8):44-49.
[4]YUEJ,NARINESS.Separation and quantification of vegetableoil based polyols by high performance liquid chromatography with evaporative light scattering detection[J].J Am Oil Chem Soc,2007,84(9):803-807.
[5]WAMELINK M M C,SMITHD EC,JAKOBSC,et al.Analysis of polyolsin urine by liquid chromatography-tandem massspectrometry:A useful tool for recognition of inborn errors affecting polyol metabolism[J].J Inherit Metab Dis,2005,28(6):951-963.
[6]SHETTY H U,HOLLOWAY H W,RAPOPORT SI.Capillary gas chromatography combined with ion trap detection for quantitativeprofiling of polyols in cerebrospinal fluid and plasma[J].Anal Biochem,1995,224(1):279-285.
[7]宋林林,李 净,谭光迅,等.枝江白酒含氮化合物和多元醇的定量分析[J].酿酒,2015,42(3):42-45.
[8]GE SL,WANG H,WANG Z F,et al.Sensitive measurement of polyols in urineby capillary zone electrophoresiscoupled with amperometric detection using on-column complexation with borate[J].J Chromatogr B,2013,915-916:39-45.
[9]MEDEIROSP,SIMONEIT B.Analysis of sugars in environmental samplesby gaschromatography-massspectrometry[J].J Chromatogr A,2007,1141(2):271-278.
[10]费 栋,陈梅兰,朱 岩.离子交换色谱-积分脉冲安培检测法测定食品中糖[J].理化检验:化学分册,2010,46(1):76-78.
[11]白小燕,邱树毅,雷安亮,等.酱香白酒酿造过程中产多元醇功能酵母的筛选[J].中国酿造,2017,36(5):58-62.
[12]朱群英,江 勇,甘 钰.HPLC-ELSD法同时测定食品中5种糖[J].食品科学,2008,29(12):503-506.
[13]PORTER L,HRSTICH L,CHAN B.The conversion of procyanidins and prodelphinidins to cyaniding and delphinidin[J].Phytochemistry,1985,25(1):223-230.
[14]张丽丽.高产D-阿拉伯糖醇酵母菌株的筛选及其发酵条件的研究[D].无锡:江南大学,2009.
[15]王凤伟.耐高渗赤藓糖醇生产菌的筛选与发酵条件优化[D].无锡:江南大学,2012.
[16]杨其义.木糖醇生产菌株的筛选及工艺优化[D].济南:齐鲁工业大学,2013.
[17]齐向辉,王 旭,林 静,等.耐高糖酵母的筛选鉴定及其产多元醇分析[J].食品与发酵工业,2014,40(10):16-21.

