乌司他丁预处理下调NLRP3保护缺血性脑损伤的研究
李笑冰 岳宗源 白婧 任垒 饶维 彭程 费舟 张磊*
(1空军军医大学学员一旅,陕西 西安 710032; 291709部队卫生所,吉林 珲春 133300; 3空军军医大学西京医院神经外科,陕西 西安 710032; 4解放军第261医院神经外科,北京 100094)
近年来,研究发现,一种炎性分子—核苷酸结合寡聚化结构域样受体蛋白3 (nucleotide-binding oligomerization domain receptor protein 3, NLRP3)与被溶酶体蛋白酶激活的Caspase1结合,形成NLRP3炎性小体后,会促进白介素-1β(interleukin-1β, IL-1β)的分泌,加重机体损伤[1]。而一种糖蛋白-乌司他丁(ulinastatin, UTI)具有强大的广谱溶酶体酶抑制功能,其预处理对急性外伤性胰腺炎、肺损伤、休克和创伤性脑损伤等各组织器官危重伤病具有明显的保护作用[2]。虽然,大量研究表明炎性反应是缺血再灌注脑损伤的重要病理机制之一,但具体分子病理机制尚不清楚,缺乏有效的治疗手段,所以探索其具体分子机制,研究新型抗缺血药物成为目前研究热点。本研究拟探讨UTI预处理措施是否可以通过下调NLRP3的表达,减少神经元凋亡,从而发挥脑保护的作用,为UTI治疗缺血性脑损伤提供实验证据和理论依据。
材料与方法
一、材料
健康C57孕鼠,孕15~16 d,清洁级,由空军军医大学实验动物中心提供。兔抗大鼠NLRP3单克隆抗体由AdipoGen提供;兔抗大鼠β-Actin单克隆抗体由Cell Signaling提供;山羊抗兔IgG/辣根酶标记由中杉金桥提供;CCK-8试剂盒由武汉博士德生物工程有限公司提供;链霉菌抗生物素蛋白-过氧化物酶免疫组化试剂盒由北京中山生物技术有限公司提供。
二、方法
1.神经元培养:孕龄14~15 d的C57孕鼠颈椎处死取胎鼠,体视显微镜下分离出大脑皮层,0.125%的胰蛋白酶消化15 min,用含20%的胎牛血清的细胞培养基终止消化,制备细胞悬液,均匀接种在6孔细胞培养板中,接种密度约为8×105/mL,最后将培养板置于含5%CO2的培养箱中培养,24 h后全量换神经基础培养基(Neurobasal),以后每3 d进行半量换液。
2.体外培养神经元缺血再灌注损伤的制作、UTI预处理及分组:培养原代神经元至成熟,选取3 h、6 h两个氧糖剥夺时间点,随机将细胞分为3 h、6 h组,分别在两组内随机分为空白组(Sham组)、对照组(Control组)和乌司他丁预处理组(UTI组),将神经元培养液换成无糖达尔伯克改良伊格尔培养基(Dulbecco's modified Eagle's medium, DMEM),并放置于37 ℃,含氮气及CO2孵箱内培养。培养3 h、6 h后,取出神经元,再次更换高糖DMEM含10%胎牛血清(fetal bovine serum, FBS)培养基,并放置置于37 ℃、50 mL/CO2孵箱中培养2 h后提取细胞[3]。UTI组在第6~8天维持培养基UTI 100 U/mL、UTI 1 000 U/mL,对照组在第6天给予等剂量生理盐水,空白组细胞造模前不做任何处理。
3.免疫荧光检测NLRP3空间表达:神经元经4%多聚甲醛固定后,驴血清封闭30 min,加入一抗抗体(NLRP3 1 ∶50)4 ℃过夜,PBS洗涤3遍,加入驴抗兔荧光二抗抗体(1 ∶1 000)室温孵育3 h,PBS洗涤5遍,Hoechst 染料染核5 min,PBS洗涤5遍,镜检。
4.Western blot 检测NLRP3蛋白水平变化:收集各组处理过的神经元,提取细胞总蛋白,考马斯亮蓝法测定蛋白浓度,聚丙烯酰胺凝胶电泳,分离蛋白后转移到硝酸纤维素膜上,与NLRP3(1 ∶500),β-actin(1 ∶2 000)抗体结合,然后与辣根过氧化物酶标记的二抗结合,电化发光法显色后照相。最后用凝胶成像系统(image master VDS)摄影,图像分析软件(Image J) 行灰度扫描分析。以目的蛋白与β-actin 的蛋白产物条带灰度值之比作为其蛋白水平的相对量。并进行扫描图像分析仪计算蛋白条带的表达。
5.CCK-8检测细胞活性:将原代神经元接种于96孔板中,同体外培养神经元缺血再灌注损伤的制作、UTI预处理及分组,加入CCK-8溶液后孵育1~4 h后测定吸光度。
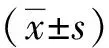
结 果
一、荧光免疫组化检测神经元NLRP3表达的结果
与Sham组比较,氧糖剥夺3 h和6 h后Control组神经元大量死亡,但存活神经元中NLRP3的染色阳性率高,有统计学差异(P<0.05),但3 h和6 h Control组之间无统计学差异(P>0.05);与氧糖剥夺3 h和6 h Control组比较,UTI 100和1000组有较多神经元存活,且NLRP3染色阳性率较高,UTI和1000组之间免疫组化结果比较无显著差异(P>0.05)。同时,NLRP3染色阳性率有NLRP3荧光免疫组化染色结果提示,阳性染色呈颗粒状,分布在细胞膜、细胞质和突起上(图1)。
二、Western blot检测UTI预处理后神经元NLRP3表达的结果
与氧糖剥夺3 h后Control组比较,Sham组和UTI 100组NLRP3的表达降低不明显,无统计学差异(P>0.05),而UTI 1000组NLRP3表达显著降低(P<0.05),提示UTI不仅能降低NLRP3表达,而且具有剂量依赖性;而与氧糖剥夺6 h后Control组比较,Western blot检测结果显示UTI 100和1000组NLRP3表达均显著降低,具有统计学差异(P<0.05);同时,UTI 100和1000组之间比较也有显著统计学差异(P<0.05,图2)。
三、CCK-8试剂盒检测UTI预处理后神经元凋亡的结果
与Control组比较,氧糖剥夺3 h Sham组(0.358±0.015)和UTI 100(0.377±0.010)以及1000组(0.371±0.013)细胞活性无统计学差异(P>0.05),而氧糖剥夺6 h组中UTI 100(0.307±0.012)和1000组神经元凋亡水平均显著下降(P<0.05),其中以UTI 6 h 1000组下降最为明显,其OD值为0.459±0.039(P<0.01)。

图1 四组原代培养的皮层神经元NOD样受体蛋白3(NLRP3)免疫组织化学图像(免疫荧光染色, ×400)
Fig 1 NLRP3 protein of neurons in four groups by immunohistochemistry (Immunofluorescent staining, ×400)
A: OGD for 6 h; B: OGD for 6 h with saline; C: OGD 6 h with UTI, 100 U/mL; D: OGD 6 h with UTI, 1 000 U/mL.
The nuclear was marked by blue-fluorescence, while NLRP3 was marked by green-fluorescence.

图2 Western blot 检测NLRP3蛋白在各组中的表达变化
Fig 2 NLRP3 expression in the neurons of each group detected byWestern blot
A: NLRP3 expression in the neurons of each group filmed by Image master VDS; B: Detection of NLRP3 expression analyzed by Image J. OGD 3 h stands for oxygen-glucose deprivation for 3 h, and the S behind OGD 3 h stands for sham, C stands for control, the number stands for the concentration of UTI. And the following options are in the same way.
aP﹤0.01,bP﹤0.05,vsOGD 6 h C;cP﹤0.05,dP>0.05,vsOGD 3 h C.
讨 论
近年来,作为一种从健康男性尿液中提取精制而成的糖蛋白,UTI通过抑制多种活性亢进的蛋白酶及其释放,稳定细胞膜和溶酶体膜;抑制炎症介质释放和消除氧自由基;抑制心肌抑制因子产生和并高度对抗机体无损害的酶活性,控制过度的炎症反应,减轻机体损伤,促进机体康复。大量研究表明,UTI对肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、白介素-6(interleukin-6, IL-6)、白介素-8(interleukin-8, IL-8)等炎症介质有显著抑制作用,在肺挫伤后早期应用效果显著。有人研究发现颅脑损伤后可能有多种继发性物质释放,诱导大量中性粒细胞在肺内聚集活化,释放多种炎症物质,如弹性蛋白酶、氧自由基等,直接作用肺血管,影响通透性,导致神经源性肺水肿,应用UTI能改善和抑制上述情况的发生[4-5]。Yamaguchi等[6]研究提示UTI在溃疡性结肠炎模型中抑制炎性因子的释放。孙来芳等[7]在以往研究中提示UTI可能在脓毒症大鼠模型上抑制TNF-α和IL-6的表达,提高白介素-10(interleukin-10, IL-10)和白介素-13(interleukin-13, IL-13)的表达水平来起到保护作用。最近的研究还揭示长时期或者短时期使用UTI可阻止慢性胰腺炎模型造成的热痛过敏。He等[8]又发现UTI预处理可以改善大鼠心肺复苏后的心肌损伤,其可能的保护机制为调控应激反应、信号转导、能量代谢、免疫反应和其他相关基因的表达。多篇创伤性脑损伤研究中发现[9-11],UTI等通过抑制组织蛋白酶B(Cathepsin B)、半胱氨酸天冬氨酸蛋白酶3(Caspase3)等表达,抑制神经细胞凋亡和死亡,发挥重要的脑保护作用。本文研究结果也发现,不同剂量的UTI都可能减少缺血性脑损伤后神经元凋亡,特别是大剂量UTI脑保护作用更强,具有明显的剂量依赖性。
大量文献提示,炎性反应是缺血性脑损伤发生发展的关键病理过程之一。各种炎性分子,特别是近年来新发现的NLRP3在其中发挥重要的分子调控作用。Mankan等[12]研究证实,在细胞的损伤和坏死过程中都可能存在溶酶体的损伤,释放大量的组织蛋白酶,激活NLRP3 因子与已被激活的半胱氨酸天冬氨酸蛋白酶1(Caspase1)结合,形成NLRP3炎性小体,促进IL-1β、IL-6和白介素-18(interleukin-18, IL-18)等的产生,影响细胞存活,给机体造成伤害。因此,NLRP3可能会识别导致溶酶体损伤及组织蛋白酶B活化的危险因子,在炎性反应中发挥核心作用。而在本研究中,我们发现UTI可以显著降低NLRP3的表达水平,减轻炎性反应,保护受损神经元。结合文献,这些结果提示,在缺血性脑损伤发生发展过程中,神经元溶酶体大量破坏,释放大量水解酶,激活炎性反应。而在此过程中,利用UTI稳定溶酶体膜,减少水解酶和炎性因子,特别是NLRP3的释放和表达,打断炎性反应通路,可以减少神经细胞死亡,从而发挥保护受损神经元的作用。但其保护作用对浓度要求较高,其发挥最大保护作用的最佳浓度及临床实用性有待进一步研究。
目前,关于NLRP3在脑损伤发病机制的的研究已经取得了极大的进展,但还不够透彻,而且,是否能够以NLRP3为药物靶点,进行缺血性脑损伤药物研究,还需我们提供更多的实验研究证据和理论依据。
参 考 文 献
1YIN J J, XIE G Y, ZHANG N, et al. Inhibiting autophagy promotes endoplasmic reticulum stress and the ROS-induced nod-like receptor 3-dependent proinflammatory response in HepG2 cells [J]. Mol Med Rep, 2016, 14(4): 3999-4007.
2OHAYON S, BOYKO M, SAAD A, et al. Cell-free DNA as a marker for prediction of brain damage in traumatic brain injury in rats [J]. J Neurotrauma, 2012, 29(2): 261-267.
3WU J X, ZHANG L Y, CHEN Y L, et al. Curcumin pretreatment and post-treatment both improve the antioxidative ability of neurons with oxygen-glucose deprivation [J]. Neural Regen Res, 2015, 10(3): 481-489.
4CUI T, ZHU G. Ulinastatin attenuates brain edema after traumatic brain injury in rats [J]. Cell Biochem Biophys, 2015, 71(2): 595-600.
5BENCHOUA A, BRAUDEAU J, REIS A, et al. Activation of proinflammatory caspases by cathepsin B in focal cerebral ischemia [J]. J Cereb Blood Flow Metab, 2004, 24(11): 1272-1279.
6YAMAGUCHI Y, OHSHIRO H, NAGAO Y, et al. Urinary trypsin inhibitor reduces C-X-C chemokine production in rat liver ischemia/reperfusion [J]. J Surg Res, 2000, 94(2): 107-115.
7孙来芳, 潘利伟. 乌司他丁影响严重脓毒症大鼠IL-10、TNF-α、IL-1β水平的研究 [J]. 临床外科杂志, 2005, 13(12): 770-772.
8HE W, LIU Y, GENG H, et al. The regulation effect of ulinastatin on the expression of SSAT2 and AQP4 in myocardial tissue of rats after cardiopulmonary resuscitation [J]. Int J Clin Exp Pathol, 2015, 8(9): 10792-10799.
9饶维, 张磊, 曹宝萍, 等. 不同剂量乌司他丁预处理对小鼠创伤性脑水肿的影响 [J]. 中华神经外科疾病研究杂志, 2012, 11(2): 113-116.
10曹宝萍, 张磊, 苏宁, 等. 乌司他丁对创伤性脑损伤的保护作用研究 [J]. 中华神经外科疾病研究杂志, 2013, 12(3): 244-246.
11张强, 张磊, 李兵, 等. 乌司他丁预处理对小鼠颅脑损伤保护的初步研究 [J]. 中华神经外科疾病研究杂志, 2011, 10(3): 197-199.
12MANKAN A K, DAU T, JENNE D, et al. The NLRP3/ASC/caspase-1 axis regulates IL-1β processing in neutrophils [J]. Eur J Immunol, 2012, 42(3): 710-715.

