小檗碱调控内质网应激水平影响UC结肠炎症反应的实验研究
沈雁 王章流 郑华君 钟继红 江向红 倪思忆 李思
溃疡性结肠炎(ulcerative colitis,UC)是一种以黏膜炎症和溃疡形成为主要病理特征的慢性结肠炎症性疾病,常反复发作、迁延不愈,是目前消化科难治性疾病之一[1-2]。近年来,我国UC发病率不断上升,且患者多为青壮年[3]。研究表明,肠上皮细胞(intestinal epithelial cells,IECs)异常凋亡导致的肠黏膜屏障损伤是造成UC结肠炎症反应持续存在的主要原因,而内质网应激(endoplasmic reticulum stress,ERS)状态下激活的 Caspase-12/Caspase-3凋亡信号转导通路可能起到重要的中介作用[4-6]。小檗碱(berberine,BBR)是中药黄连中提取的有效活性成分,对于多种急慢性炎症均有良好的抑制作用,其用于治疗UC效果确切[7-8]。基于此,本研究从Caspase-12/Caspase-3信号转导通路角度出发,探讨BBR是否通过调控ERS水平来影响IECs凋亡行为,以起到治疗UC的作用,现报道如下。
1 材料和方法
1.1 材料
1.1.1 实验动物 健康雄性SPF级BALB/c小鼠60只,8 周龄,体重(20±2)g,购自上海斯莱克实验动物有限责任公司,许可证号为SCXK(沪)2017-0005,合格证号为0345203。实验动物房使用许可证号为SYXK(浙)2015-0008,饲养环境:温度 20~25℃,相对湿度 40%~70%。
1.1.2 药品与试剂 右旋葡聚糖硫酸酯钠(DSS,美国MP Biomedicals公司,批号:BJ14745);小檗碱(BBR,上海源叶生物科技有限公司,批号:Y18D8C50814);葡萄糖调节蛋白 78(GRP78)、Caspase-12 和 Caspase-3 一抗(英国Abcam公司,批号分别为GR309483-1、ab62484和ab13847);抗兔和抗鼠二抗(北京中杉金桥生物技术有限公司,批号分别为K167722B、K175212C);蛋白酶K(北京 Tiangen公司,批号:M2011);DAB显色试剂盒(北京中杉金桥生物技术有限公司,批号:K167722A);TUNEL细胞凋亡原位检测试剂盒(德国ROCHE公司,批号:11906800);高纯总RNA快速提取试剂盒(上海Generay公司,批号:1703G01);逆转录试剂盒HiScript-II Q RT SuperMix for qPCR(南京 Vazyme公司,批号:7E092G6);qPCR试剂ChamQ SYBR Color qPCR Master Mix(南京Vazyme公司,批号:7E092H6)。
1.1.3 仪器 RM2235型轮转式切片机(德国LEICA公司),Tec 2500型病理组织漂烘仪(常州市郝思琳仪器设备有限公司),BX43型显微镜(日本OLYMPUS公司),PYX-DHS500BS-Ⅱ型隔水式恒温培养箱(上海跃进医疗器械有限公司),BCD-211KD3型冰箱(TCL公司),C21-SDHC15K型电磁炉(浙江绍兴苏泊尔生活电器有限公司),101-3型电热恒温鼓风干燥箱(上海锦屏仪器有限公司)。
1.2 方法
1.2.1 分组及处理 将60只小鼠按随机数字表法分为空白对照组、模型对照组、BBR低剂量组(UC模型+100mg·kg-1BBR)、BBR 中剂量组(UC 模型+150mg·kg-1BBR)和 BBR 高剂量组(UC 模型+200mg·kg-1BBR),每组12只。按人-小鼠体表面积换算,分别用蒸馏水配制成低、中、高剂量的BBR混悬液。采用DSS诱导法建立UC模型:配制5%DSS溶液(5g DSS溶于100ml蒸馏水中),空白对照组小鼠每日自由饮用蒸馏水(100ml),其他各组小鼠自由饮用5%DSS溶液,连续7d。BBR低剂量组、中剂量组和高剂量组小鼠造模同时予BBR混悬液灌胃(给药容量为10ml·kg-1),模型对照组和空白对照组小鼠给予等体积蒸馏水,1次/d,共7d。
1.2.2 指标观察检测
1.2.2.1 一般情况观察 自造模之日起,每日观察并记录各组小鼠的精神活动状态、摄食量和饮水量等情况,每日定时称量体重,观察粪便性状并行隐血试验与疾病活动度评分(disease activity index,DAI)。DAI=(体重减轻率分数+大便性状分数+隐血程度分数)/3。
1.2.2.2 结肠组织病理学检测 用药结束后,全部小鼠以颈部脱臼法处死,严格无菌条件下取出结肠组织,肉眼观察黏膜与浆膜面的变化。取新鲜结肠组织1块,修整大小为1.0cm×1.0cm×0.2cm,置于包埋盒用4%多聚甲醛固定4d,石蜡包埋,4μm厚连续切片,HE染色后光镜下观察组织病理学变化。
1.2.2.3 结肠组织IECs凋亡情况检测 结肠组织切块后用4%多聚甲醛固定,包埋切片,按照TUNEL试剂盒说明书进行操作。主要步骤如下:切片脱蜡入水,蛋白酶K工作液37℃消化组织20min,PBS冲洗,加TUNEL反应混合液(含5μl TdT和45μl荧光素标记的dUTP标记液),加封闭液于暗湿盒中37℃反应30min,漂洗,加DAB底物,显微镜下控制显色,苏木素复染,梯度酒精脱水,二甲苯透明中性树胶封片。TUNEL阳性细胞呈褐色或深褐色,正常结肠上皮细胞呈蓝色。每张切片于400倍镜下随机选取5个视野观察,记录并统计TUNEL阳性细胞数,即代表IECs凋亡数。
1.2.2.4 免疫组化法检测结肠组织GRP78、Caspase-12和Caspase-3蛋白的表达 结肠组织切块后用4%多聚甲醛固定,包埋切片,按照免疫组化染色法进行操作。主要步骤如下:切片二甲苯脱蜡,梯度酒精复水,3%过氧化氢溶液37℃孵育15min,PBS冲洗,滴加一抗4℃冰箱孵育过夜,滴加二抗37℃孵育30min,DAB反应染色,显微镜下观察反应进度,冲洗、复染,干燥,封片。每张切片于200倍镜下随机选取3个视野观察,判读阳性表达强度和阳性率。参照Fromowitz法进行评分,具体评分标准:(1)染色强度(以多数细胞呈现的染色强度并减去背景着色计分):无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;(2)阳性范围:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。计算两项结果之和,<2分为阴性(-),2~3分为弱阳性(+),4~5分为中度阳性(++),6~7 分为强阳性(+++);以评分代表蛋白表达水平。
1.2.2.5 荧光定量PCR法检测结肠组织GRP78 mRNA的表达 Trizol-离心柱法提取结肠组织总RNA,测定总RNA纯度和含量后按照试剂盒说明书进行逆转录合成cDNA。PCR 体系(20μl):10.0μl ChamQ SYBR Color qPCR Master Mix,上下游引物(10μmol/L)各 0.6μl,8.8μl cDNA。PCR 反应条件 :95℃ 30s;40 个循 环(95℃ 10s,60℃30s,收集荧光)。PCR 引物序列与扩增条件详见表1。取PCR产物用l%琼脂糖凝胶电泳,凝胶成像系统成像,目标mRNA的表达采用内参Musβ-Actin进行校正,基因相对表达水平以 2(Ct内参基因-Ct目的基因)表示。

表1 PCR引物序列与扩增条件
1.3 统计学处理 应用SPSS 20.0统计软件;计量资料以表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 5组小鼠一般情况比较 造模成功后,模型对照组与BBR低、中、高剂量组小鼠均出现不同程度的精神呆滞、行动缓慢、进食少,伴有大便稀溏、便血、体重下降,而空白对照组小鼠的精神、活动、饮食、大便、体重等一般情况均正常。5组小鼠DAI比较见表2。
由表2可见,5组小鼠DAI比较有统计学差异(P<0.05);模型对照组与BBR低、中、高剂量组小鼠DAI均高于空白对照组(均P<0.05);BBR高剂量组小鼠DAI较模型对照组降低(P<0.05),而BBR低、中剂量组小鼠DAI与模型对照组比较差异均无统计学意义(均P>0.05)。

表2 5组小鼠DAI比较(分)
2.2 5组小鼠结肠组织病理学变化比较 见图1。
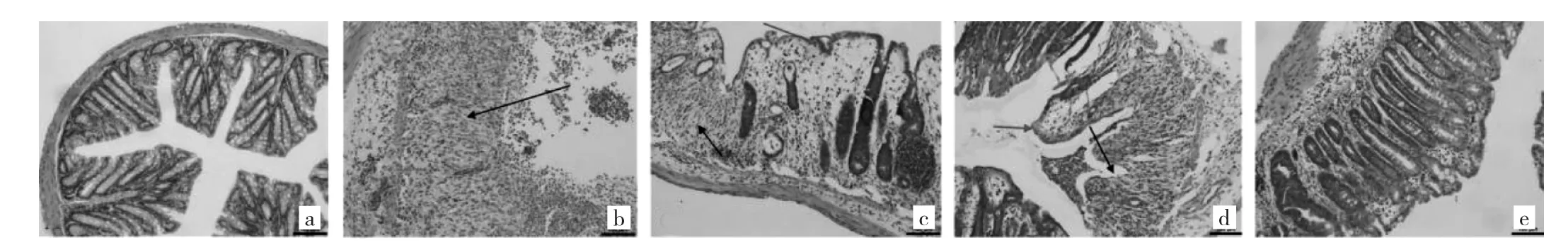
图1 5组小鼠结肠组织病理学变化比较
由图1可见,空白对照组结肠组织结构正常,黏膜上皮未见病变;模型对照组结肠可见黏膜下隐窝腺体全部丢失,炎症细胞浸润黏膜至上皮结构破坏;BBR低、中、高剂量组中,以BBR高剂量组结肠组织结构与正常对照组最为接近,BBR低剂量组可见隐窝腺体大片丢失,黏膜下炎症细胞浸润,部分黏膜上皮可见水肿,BBR中剂量组与低剂量组相比病变程度有所减轻。
2.3 5组小鼠结肠组织IECs凋亡情况比较 见图2、表3。

图2 5组小鼠结肠组织IECs凋亡情况比较

表3 5组小鼠结肠组织IECs凋亡数(个/5个视野)
由表3可见,5组小鼠结肠组织IECs凋亡数比较有统计学差异(P<0.05);模型对照组与BBR低、中、高剂量组小鼠结肠组织IECs凋亡数均高于空白对照组(均P<0.05);BBR低、中、高剂量组小鼠结肠组织IECs凋亡数均较模型对照组减少(均P<0.05)。
2.4 5组小鼠结肠组织 GRP78、Caspase-12和 Caspase-3蛋白表达水平比较 见图3、表4。
由图3可见,GRP78、Caspase-12和Caspase-3阳性细胞均呈褐色或黄褐色,上述蛋白主要表达于细胞质。由表4可见,5组小鼠结肠组织GRP78、Caspase-12和Caspase-3蛋白表达水平比较均有统计学差异(均P<0.05);模型对照组小鼠结肠组织GRP78、Caspase-12和Caspase-3蛋白表达水平均高于空白对照组(均P<0.05);BBR中、高剂量组小鼠结肠组织GRP78、Caspase-3表达水平均低于模型对照组(均P<0.05),BBR高剂量组Caspase-12表达水平低于模型对照组(P<0.05)。2.5 5组小鼠结肠组织GRP78 mRNA表达水平比较 见表5。

图3 5组小鼠结肠组织GRP78、Caspase-12和Caspase-3蛋白表达水平比较
由表5可见,5组小鼠结肠组织GRP78 mRNA表达水平比较有统计学差异(P<0.05);模型对照组与BBR低、中、高剂量组小鼠结肠组织GRP78 mRNA表达水平均高于空白对照组(均P<0.05);BBR中、高剂量组小鼠结肠组织GRP78mRNA表达水平均较模型对照组降低(均 P<0.05)。

表4 5组小鼠结肠组织GRP78、Caspase-12和Caspase-3蛋白表达水平比较(分)

表5 5组小鼠结肠组织GRP78 mRNA表达水平比较
3 讨论
ERS是真核细胞中普遍存在且高度保守的应激反应机制,是指细胞在各种应激原的刺激下,其内质网合成加工蛋白质的生理功能发生障碍,大量未折叠或错误折叠蛋白在内质网腔中蓄积所启动的一系列细胞内稳态失衡过程[9]。ERS在决定应激细胞的结局如抵抗、适应、损伤或凋亡中发挥重要作用。定位于内质网膜上的GRP78通常被认为是ERS的标志性分子,其表达水平代表了细胞的应激水平。生理条件下,GRP78与内质网跨膜感受蛋白相结合而使后者处于无活性状态。当细胞ERS适度时,跨膜感受蛋白与GRP78发生解离而活化,进而通过未折叠蛋白反应(UPR)的保护性机制以改善应激细胞内蛋白质的合成加工,恢复和维持细胞内稳态,避免细胞损伤。但若ERS程度过强或持续过久,UPR不足以完全代偿缓解细胞损伤时,为维持细胞内稳态,活化的跨膜感受蛋白将进一步激活细胞凋亡程序,诱导应激细胞的程序性死亡[10-11]。Caspase-12是ERS特异性凋亡信号转导通路的起始因子,它仅在ERS状态下被激活并进一步磷酸化激活下游的凋亡执行因子Caspase-3,从而独立地介导细胞凋亡[12-13]。
IECs是一种ERS活跃细胞,其在生理条件下发生的适度凋亡与肠道干细胞的分化补充间维持动态平衡[14];但当其受到肠腔内病原微生物、黏膜炎性介质、缺血缺氧等应激原的刺激后易发生过度的ERS,出现凋亡加速,导致肠黏膜屏障损伤,肠上皮通透性增高[15],各种内外源性抗原物质异常暴露并激活肠道局部免疫系统,通过瀑布样级联放大的连锁免疫炎症反应,引起组织损伤。研究表明,UC患者和动物模型的IECs中可检测出ERS过度状态[16-18];而不同应激原刺激IECs所构建的体外ERS模型以及UC患者、动物模型的结肠组织中亦普遍存在细胞异常凋亡现象[19-23]。因此,IECs在ERS状态下过度凋亡是导致肠黏膜屏障损伤、引起UC发生发展的重要病理机制[4-6],通过抑制应激特有的Caspase-12/Caspase-3凋亡信号通路活化而抑制IECs的凋亡是治疗UC的可能有效方法之一。
BBR是从黄连中提取的一种异喹啉类生物碱,具有较强的抗炎和免疫调节作用。研究发现,BBR对UC具有良好的治疗效果,可能通过调整肠道菌群结构[24]、保护肠屏障功能[25]和调节免疫应答反应[26]等机制发挥作用,但直接研究BBR调控ERS影响IECs凋亡水平,从而介导UC结肠炎症反应发生、发展方面的报道较为少见,有必要就此深入研究。本研究结果表明,BBR治疗能明显缓解UC小鼠腹泻、便血、体重减轻等临床症状,明显减轻结肠黏膜炎症细胞浸润、上皮水肿、上皮结构破坏及隐窝腺体丢失等结肠组织病理学损伤,UC小鼠的DAI均明显下降,说明BBR治疗UC具有良好的临床效果。与正常小鼠相比,UC小鼠发生凋亡的IECs显著增多,经各剂量的BBR治疗后,细胞的凋亡水平均较模型对照组明显减轻,说明IECs凋亡过度是UC的重要病理过程之一,而BBR能有效抑制IECs的凋亡行为。GRP78、Caspase-12和Caspase-3蛋白主要存在于细胞质中,与正常小鼠相比,3者在UC小鼠结肠组织中的表达水平均显著升高,GRP78 mRNA的相对表达量亦升高;而经中、高剂量的BBR治疗后,上述3种蛋白和GRP78 mRNA的表达水平均较模型对照组明显下降,提示ERS介导的Caspase-12/Caspase-3凋亡信号通路参与了UC小鼠IECs凋亡过程。
综上所述,BBR减轻UC结肠炎症可能与下调ERS水平,抑制ERS介导的Caspase-12/Caspase-3凋亡信号通路有关。本研究结果有助于进一步阐明BBR治疗UC的作用机制,BBR在UC治疗方面的应用前景值得期待。

