淫羊藿苷和骨髓间充质干细胞共育液对兔骨关节炎模型关节液中IL-1、TNF-α、IL-10、MMP-3表达的影响
秦丰伟 黄荷 焦锋 唐望
1广州市中西医结合医院骨科(广州 510800);2广州中医药大学(广州 510405)
骨关节炎(osteoarthritis,OA)在50岁以上的人群中有着很高的发病率,是一种常见的骨科疾病,因其发病机制复杂,仍然没有确切的治疗方法,亦成为科研工作者的研究热点。研究表明,IL-1、TNF-α、MMP-3、IL-10与骨关节炎的病理变化关系密切,因此,如何改善上述因子的表达水平是治疗骨关节炎的关键。骨髓间充质干细胞(BMSCs)拥有强大的自我更新、增殖能力及分化潜能,具有免疫抑制和抗炎作用[1],近年来作为理想的种子细胞治疗骨关节炎已成为研究焦点。BMSCs可能是依靠其抗炎、抗免疫等生物特性干预修复损伤的软骨组织,但是大量基础和临床实验发现BMSCs移植到目标区域后,受损的软骨并没有得到有效的修复,这也成为BMSCs移植治疗骨关节炎的一大难点。那么如何提高BMSCs的活性进而促进其向成软骨及成骨细胞增殖分化就成为研究的关键。在诸多的补肾中药中,淫羊藿是治疗骨性关节炎的常用中药,也是目前研究最多的一种。研究表明淫羊藿苷作为淫羊藿的主要有效成份,能促进成骨细胞的增殖与分化,促进机体产生促成骨细胞生长的因子而促进成骨细胞的增殖与分化,还能抑制破骨细胞[2-3]。因此,淫羊藿苷很有可能可以提高BMSCs活性,增强其修复软骨能力。为此,本实验通过研究淫羊藿苷对BMSCs活性的影响以及两者的共育液关节腔注射对兔骨关节炎模型关节液中IL-1、TNF-α、MMP-3、IL-10表达的影响,为后期BMSCs治疗骨关节炎提供新的思路和理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物普通级健康新西兰雄兔1只,3月龄,2~3 kg,由广州中医药大学动物实验中心提供,用于骨髓间充质干细胞分离、培养等。
1.1.2 主要试剂及实验器材兔骨髓间充质干细胞专用培养基(Cyagen公司,RBXMX-90011)、淫羊藿苷(Sigma公司,I1286)、含0.25%EDTA的胰酶(Cyagen公司,TEDTA-10001-100)、戊巴比妥钠(美国Gibco公司,69020100)、CCK-8(日本同仁公司)、transwell小室(Corning公司)等。
1.2 方法
1.2.1 BMSCs培养3%的戊巴比妥钠按1 mL/kg经耳缘静脉注射行兔全身麻醉,无菌条件下,于一侧股骨下端行骨髓穿刺,接无菌针管(内含肝素)抽取骨髓4 mL,随即将骨髓移入抗凝管抗凝,将骨髓移入超净工作台,加入兔骨髓间充质干细胞专用培养基,吹打混匀,接种于25 cm2培养皿,置入37℃、5%CO2培养箱中培养,48 h后首次半量更换培养液,此后依据细胞生长情况2~3 d半换液1次。7~8 d后,倒置显微镜下观察细胞可达到达80%融合后,进行传代培养:加入含有0.25%EDTA的胰蛋白酶消化1 min。通过倒置显微镜观察发现贴壁细胞间隙增大时,加入等量专用培养基终止消化,吹打瓶壁细胞使其脱壁。多数细胞脱离瓶壁形成细胞悬液后,按照1∶2重新接种至25 cm2培养瓶中。
1.2.2 BMSCs成骨和成软骨诱导取第3代BMSCs,以1×105/孔密度接种于6孔板,每孔加2 mL基础培养基,饱和湿度CO2培养箱中孵育,待细胞爬满汇合后,培养基分别换成成软骨诱导培养基和成骨诱导培养基。每隔2 d换液,每日观察细胞生长情况。3周后分别采用阿尔新蓝染色和ALP染色和茜素红染色。
1.2.3 CCK-8法检测细胞活性取第3代BMSCs,以5×103的密度接种于96孔板,共6块,每块板6个组,各有5个复孔,置入37℃、5%CO2培养箱中培养,12 h细胞贴壁后,加入不同浓度的ICA进行干预,分为 0、0.01、0.1、1、10、100 μmol/L ICA组,各组分别干预 12、24、36、48、72、96 h后,每孔加入10μL CCK-8,置于培养箱中继续孵育40 min,于酶标仪波长450 nm处检测各组细胞吸光度值。
1.2.4 动物分组及骨关节炎模型的建立将20只兔随机分为空白组、模型组、BMSCs组、BMSCs+ICA组,各5只。模型组及治疗组兔采用注射木瓜蛋白酶法造模,关节腔内注射4%木瓜蛋白酶溶液0.5 mL,对照组注射等剂量的生理盐水;每3天重复注射1次,共注射3次。首次注射4周后即可以获得稳定的膝骨关节炎模型。
1.2.5 BMSCs和ICA共育液关节腔注射及标本的收集按照前期实验的结果,移植干细胞选择第3代细胞。模型组关节腔内注射0.2 mL培养液;BMSCs组:常规细胞消化、离心得混悬液,调整细胞最终浓度为5×104/mL,取0.2 mL关节内注射;BMSCs+ICA组:淫羊藿苷与BMSCs共育液,细胞最终浓度为5×104/mL,取0.2 mL关节内注射。对照组和模型组关节腔注射等量生理盐水。2周后分别抽取关节液0.5 mL,1 500 r/min离心后,-70℃保存。
1.2.6 观测指标及测定关节液中IL-1、IL-10、TNF-α、MMP-3的含量使用ELISA法检测。具体步骤按上海信帆生物科技有限公司提供的ELISA检测试剂盒说明进行操作。
1.3 统计学方法采用SPSS 22.0统计软件进行分析,实验结果以表示,组间比较采用方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 骨髓间充质干细胞的形态兔BMSCs第三代细胞传代48 h,覆盖率达90%以上(图1a)。
2.2 BMSCs体外诱导成骨及成软骨能力鉴定BMSCs在成软骨诱导液培养下向软骨细胞分化,14 d后,通过阿尔新蓝染色发现,细胞质呈蓝色,细胞分支染色略淡,可以辨认出细胞核的轮廓,见图1。在成骨诱导液培养下,BMSCs向成骨细胞分化,细胞诱导2周后采用茜素红染色显示大量钙结节形成,见图1;ALP染色发现黑色颗粒,出现深蓝色钙化结节影,见图1。体外诱导实验说明BMSCs可以向成骨细胞及成软骨细胞分化。
2.3 ICA对BMSCs活性的影响研究发现,0.01 μmol/L的ICA对BMSCs的活性无明显影响,0.1、1、10μmol/L的ICA可提高BMSCs的活性,且各组作用的最佳时间都是72 h,其中1μmol/L的ICA对BMSCs活性的影响作用最明显,与其他比较各组相比,差异均具有统计学意义(P<0.05)。而100μmol/L ICA对BMSCs活性具有抑制作用。如图2所示。

注,图a,第三代BMSCs形态(倒置相差显微镜(×100);图b,BMSCs成骨诱导14 d后茜素红染色显示钙结节形成(倒置相差显微镜(×100);图c,BMSCs成骨诱导后ALP染色显示深蓝色钙化结节影(倒置相差显微镜(×100);图d,BMSCs成软骨诱导后阿尔新蓝染色显示细胞核轮廓可以辨认,细胞质呈现蓝色(倒置相差显微镜(×100)

图2 不同浓度的ICA干预不同时间对BMSCs细胞生物活性的影响Fig.2 Proliferation of BMSCs stimulated by ICA
2.4 治疗前后关节液中IL-1、IL-10、TNF-α、MMP-3水平变化情况造模成功后,与空白组对比,其余各组关节液中IL-1、TNF-α、MMP-3均明显升高,IL-10水平下降,差异有统计学意义(P<0.05)。关节腔注射2周后,与模型组相比,BMSCs和BMSCs+ICA组IL-1、TNF-α、MMP-3均下降,而IL-10升高,差异有统计学意义(P<0.05),且BMSCs+ICA组明显优于BMSCs组,差异有统计学意义(P<0.05);对照组治疗前后关节液中IL-1、IL-10、TNF-α、MMP-3水平变化无显著性差异(P>0.05);见图3及表1。上述结果证明,BMSCs关节腔内植入能够抑制炎症因子IL-1、TNF-α的产生,促进抗炎症因子IL-10的产生,使软骨降解产物MMP-3下降;而淫羊藿苷对骨髓间充质干细胞的干预,可以在很大程度上提高其活性,更好的发挥其抑制炎症因子、促进抗炎症因子和减缓软骨降解的作用。

图3 各组治疗前后关节液中IL-1、IL-10、TNF-α、MMP-3表达水平柱状图Fig.3 The levels of interleukin-1,interleukin-10,tumor necrosis factor-α,matrix metalloprotease-3 in the joint fluid of experimental group and control group before and after treatment
3 讨论
3.1 IL-1、IL-10、TNF-α、MMP-3在骨关节炎病理过程中的作用骨关节炎的病理变化十分复杂,可能与多种细胞因子和软骨蛋白降解酶有着密切的联系。目前研究已经证实,IL-1和TNF-α可能是骨关节炎的始发因子。正常软骨组织中IL-1含量极低,但在骨关节炎发病过程中IL-1含量明显增高,IL-1可以诱导MMP-3的合成,MMP-3又可以促使软骨基质中的蛋白多糖高度裂解,最终形成对关节软骨的破坏[4]。在此病理过程中,TNF-α和IL-1具有高度协同作用,TNF-α可以促使IL-1的合成,而IL-1又可以诱导TNF-α的表达。两者形成恶性循环,加重滑膜的炎症反应和软骨的降解。临床研究也证实了骨关节炎患者血清和关节液中TNF-α水平明显升高,且与关节炎轻重程度呈正相关关系[5]。与T细胞亚群之一的Th1分泌的IL-1、TNF-α等炎症因子相反,其另一亚群Th2分泌的IL-10则能够促进抗炎因子的释放,经常被作为正向调节因子被应用于临床和实验研究[6-7]。
表1 各组治疗前后关节液中IL-1、IL-10、TNF-α、MMP-3表达水平Tab.1 The levels of interleukin-1,interleukin-10,tumor necrosis factor-α,matrix metalloprotease-3 in the joint fluid of every group ± s,pg/mL
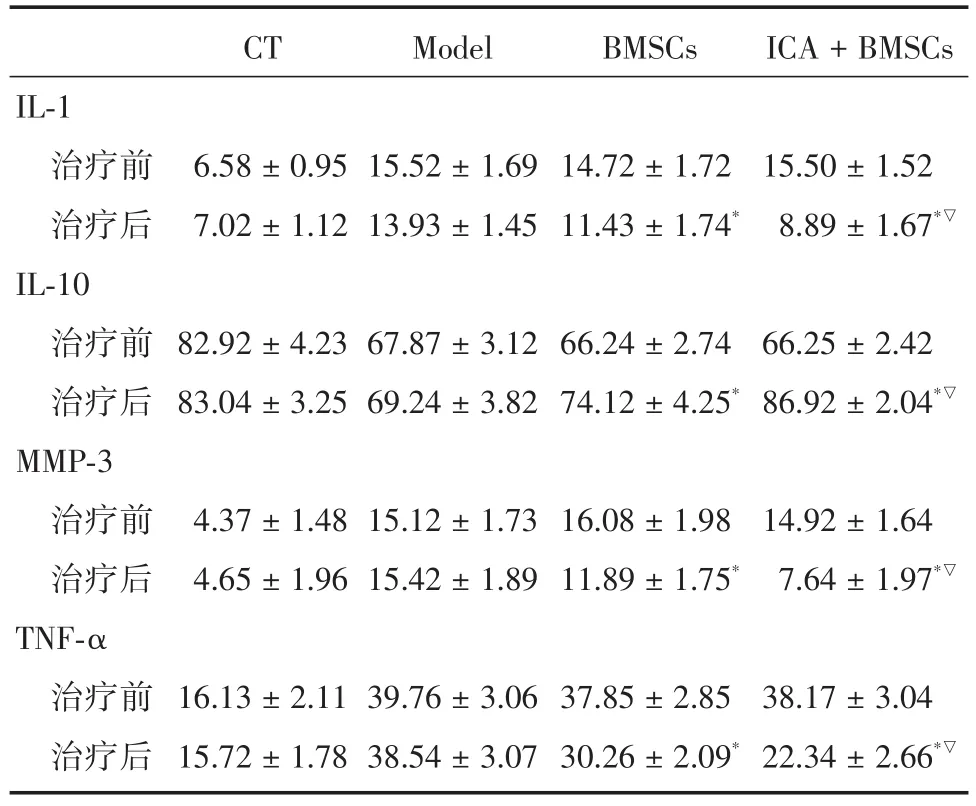
表1 各组治疗前后关节液中IL-1、IL-10、TNF-α、MMP-3表达水平Tab.1 The levels of interleukin-1,interleukin-10,tumor necrosis factor-α,matrix metalloprotease-3 in the joint fluid of every group ± s,pg/mL
注:与模型组相比,*P< 0.05;与BMSCs组相比,▽P<0.05
IL-1治疗前治疗后IL-10治疗前治疗后MMP-3治疗前治疗后TNF-α治疗前治疗后CT 6.58±0.95 7.02±1.12 82.92±4.23 83.04±3.25 4.37±1.48 4.65±1.96 16.13±2.11 15.72±1.78 Model 15.52±1.69 13.93±1.45 67.87±3.12 69.24±3.82 15.12±1.73 15.42±1.89 39.76±3.06 38.54±3.07 BMSCs 14.72±1.72 11.43±1.74*66.24±2.74 74.12±4.25*16.08±1.98 11.89±1.75*37.85±2.85 30.26±2.09*ICA+BMSCs 15.50±1.52 8.89±1.67*▽66.25±2.42 86.92±2.04*▽14.92±1.64 7.64±1.97*▽38.17±3.04 22.34±2.66*▽
3.2 关节腔内注射BMSCs治疗骨关节炎BMSCs能够营养软骨,主要是通过合成诸多生物活性因子,进而激活血管再生通道[8]。庄超等[9]用自体骨髓间充质干细胞关节腔注射移植治疗兔早期骨性关节炎模型,结果显示,实验组兔软骨厚度增加幅度优于对照组。本次研究结果中,BMSCs和BMSCs+ICA组关节液中IL-1、TNF-α、MMP-3表达水平较模型组明显下降,而IL-10水平明显升高,并且BMSCs+ICA组各项指标的变化幅度均优于BMSCs组,这说明骨髓间充质干细胞移植可降低兔骨关节炎IL-1、TNF-α、MMP-3的表达,抑制炎症反应,从而减轻关节软骨的破坏。
3.3 ICA与BMSCs的关系鲍远等[10]通过淫羊藿苷干预骨髓间充质干细胞,发现淫羊藿苷随时间正向上调runx2、ocn和osx基因的表达,促进BMSCs成骨分化。本实验研究发现,0.1、1、10μmol/L的ICA可提高BMSCs的活性,且各组作用的最佳时间都是72 h,其中1μmol/L的ICA对BMSCs的增殖作用最明显,100μmol/L的ICA对BMSCs的增殖有抑制作用。
3.4 BMSCs用于治疗骨关节炎的剂量对于BMSCs经关节腔注射治疗骨关节炎的合适剂量,目前并没有统一的结论,比较常用的剂量范围在1×106~10×106/cm2,本次实验在保证安全和治疗效果的前提下,参照其他研究者的研究结果,选择治疗剂量为5×106/cm2[11]。实验结果显示,该治疗剂量的BMSCs能够获得良好的效果。
ICA与BMSCs共育液关节腔注射可以提高关节腔内IL-10表达水平,降IL-1、TNF-α、MMP-3表达水平,依此推断淫羊藿苷可以提高骨髓间充质干细胞活性,可能是通过免疫调节及炎症抑制两种机制调节关节腔内紊乱微环境,缓解软骨的降解。本实验提示骨髓间充质干细胞联合中药单体淫羊藿苷关节腔注射有望成为治疗骨关节炎的有效方案。

