融合TAT重组猪细小病毒样粒子的构建及鉴定
刘金凤,杜毅超,覃绍敏,白安斌,张振江,陈凤莲,吴健敏
(广西壮族自治区兽医研究所 广西兽医生物技术重点实验室,广西南宁 530001)
猪细小病毒(Porcine parvovirus,PPV)是导致母猪繁殖障碍的主要病原之一,感染猪常以初产妊娠母猪流产、死胎、畸形胎、木乃伊胎、弱仔、延期回归发情为特征。此外,PPV还可以引起仔猪皮炎、腹泻、心肌炎及呼吸系统疾病[1-2]。疫苗免疫是防控PPV感染的有效手段,虽然传统的灭活苗和弱毒苗已在临床上广泛应用于PPV的防控,并取得了良好的效果,但灭活苗免疫效果不稳定,免疫保护力低,并且存在灭活不彻底会导致散毒的风险,弱毒苗存在毒株重组或毒力返强等缺点,因此开发安全高效的新型PPV疫苗对有效控制和彻底清除PPV具有重要的意义[3]。病毒样粒子(virus-like particles,VLPs)形态与天然病毒结构极为相似,能有效模拟天然病毒感染模式,通过MHCⅠ类分子和MHCⅡ类分子途径进行抗原提呈激活机体产生一系列的免疫应答[4-5],但VLPs不含核酸,消除了天然病毒毒力返强、产生免疫缺陷等风险,具有极高的安全性,是一种理想的候选疫苗[6]。
近年来,PPV-VP2已被证实能在多种不同的表达系统中成功表达,并且能在体外自行组装形成VLPs,同时具有良好的免疫原性。尽管PPV-VLPs研究取得了不少成果,但要实现PPV-VLPs疫苗的临床推广应用,仍需就如何提高VLPs表达效率及免疫原性进行深入研究。TAT蛋白是人类免疫缺陷病毒1(HIV-1)的方式激活因子,由86个氨基酸组成,能有效携带外源蛋白跨膜进入细胞,发挥蛋白的生物活性。TAT蛋白中的一个富含11个碱性氨基酸、带正电荷的多肽片段与TAT蛋白的转导功能密切相关,称之为TAT蛋白转导域。据报道,TAT蛋白转导域具有强大的蛋白转导功能,能促进融合蛋白跨膜导入细胞进入MHCⅠ类分子介导的抗原呈递途径,并激发抗原特异性CTL应答效应,增强机体的免疫反应[7-9];还能显著提高外源蛋白高效、可溶性表达的水平[10]。本研究尝试在PPV-VP2基因的N端融合TAT蛋白转导域,用杆状病毒/昆虫细胞表达系统进行表达,分析融合蛋白形成病毒样粒子的可行性,以期为进一步研制高效的VLPs疫苗提供试验依据。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株、细胞系 重组杆粒rBacmid-VP2、DH5α、PPV N毒株由广西兽医研究所诊治中心实验室保存; DH10Bac感受态细胞购自北京博迈德生物技术有限公司;pFastBac Ⅰ质粒、Sf9昆虫细胞系由军事医学科学院军事兽医研究所惠赠。
1.1.2 主要试剂 Fast pfu DNA聚合酶为全式金公司产品、BamHⅠ和NotⅠ限制性内切酶、DNA Marker为TaKaRa公司产品;蛋白Marker、DNA胶回收试剂盒、基因组提取试剂盒、质粒小提试剂盒为天根生物公司产品;LipofectamineTM3 000 为 Invitrogen公司产品;胎牛血清、Grace's昆虫培养基购为GIBCO公司产品;PPV单克隆抗体为洛阳普莱柯公司赠与;FITC标记的羊抗鼠IgG为武汉博士德生物公司产品。
1.2 方法
1.2.1 引物设计合成 根据GenBank公布的PPV(GeneID:M32787.1)基因组序列设计扩增VP2基因特异性引物,人工合成TAT蛋白转导域序列(表1),引物由北京博迈德生物公司合成。其中引物P1、P4用于从病毒基因组扩增VP2基因;P2、P4用于扩增在VP2 N端引入第1段TAT序列的TAT-VP2基因,P3、P4用于扩增在VP2 N端引入第2段TAT序列的TAT-VP2基因,P2、P3单下划线部分为TAT序列,P3、P4双下划线部分引入的酶切位点。

表1 用于扩增基因的引物及其序列
1.2.2 目的基因克隆及序列测定 以常规方法提取PPV病毒基因组DNA为模板,应用Fast pfu DNA Polymerase聚合酶和引物P1和P2扩增VP2基因,扩增条件为:95℃ 2 min;95℃ 20 s,65℃ 30 s,72℃ 1 min,32个循环;72℃延伸7 min。扩增产物经加A反应回收纯化后进行TA克隆构建pMD-VP2重组质粒并经PCR、酶切鉴定及测序分析;以pMD-VP2质粒为模板用P2、P4引物进行PCR扩增,在VP2的N端引入第1段TAT序列。扩增条件为:95℃ 2 min;95℃ 10 s,68℃ 1 min,32个循环;72℃延伸7 min。回收纯化第一轮PCR产物为模板,用P3、P4引物以相同条件进行第二轮PCR扩增,引入第二段TAT序列,扩增产物经加A反应回收纯化后进行TA克隆构建pMD-TAT-VP2重组质粒并经PCR、酶切鉴定及测序分析。
1.2.3 重组杆粒构建 pMD-TAT-VP2重组质粒和pFastBacⅠ空载体分别用BamHⅠ和NotⅠ进行双酶切,酶切产物经胶回收后,用T4连接酶将TAT-VP2基因插入pFastBac I载体中;连接产物转大肠埃希菌DH5α细胞,提取重组质粒,并进行PCR和双酶切鉴定筛选阳性质粒,并命名为pFast-TAT-VP2。用将pFast-TAT-VP2转化含Bacmid和辅助质粒的DH10Bac感受态细胞中,经3种抗生素(四环素、卡那霉素、庆大霉素)和蓝白斑筛选,获取阳性重组菌株并提取杆粒,杆粒经M13引物 PCR鉴定正确后命名为rBacmid-TAT-VP2。
1.2.4 重组杆状病毒制备及扩增 按照LipofectamineTM3 000说明书操作方法,将重组杆粒rBacmid-TAT-VP2转染对数生长期的Sf9细胞,设rBacmid-VP2转染组为阳性对照,转染后27℃培养96 h,反复冻融细胞,4℃、12 000 r/min离心10 min,收集上清获得P1代重组细胞毒rBV-TAT-VP2和rBV-VP2,提取重组细胞毒基因组,以P1/P4特异性引物进行PCR鉴定;将鉴定正确的P1代重组毒按照1∶10稀释接种Sf9细胞进行传代,待细胞发生明显病变后收获P2代毒,以同样传代方法获P3代毒,收获的重组毒在-80℃保存。
1.2.5 表达产物间接免疫荧光鉴定 将rBV-TAT-VP2按1∶10接种96孔板培养的Sf9细胞,设非感染和rBV-VP2对照组,27℃培养48 h~72 h,细胞开始出现病变后,以80%预冷丙酮固定,PBST洗涤3次后50 g/L脱脂奶粉4℃封闭过夜,以1∶2 000稀释的PPV单抗为一抗,在37℃下避光孵育1 h,以1∶1 000稀释的FITC荧光标记的羊抗鼠IgG为二抗,37℃孵育1 h,期间每一环节用PBST洗涤3次,于荧光显微镜下观察。
1.2.6 表达产物电镜观察 将重组杆状病毒按1∶10接种Sf9细胞,27℃培养3 d~5 d至约75%细胞产生明显病变后,反复冻融细胞离心去除细胞碎片,收集上清。将上清样品滴于载样铜网上,吸附2 min,去除多余样品,然后滴加10 g/L磷钨酸染色固定,进行透射电镜观察。
1.2.7 表达产物血凝效价测定 将重组杆状病毒按1∶10接种Sf9细胞,27℃培养3 d~5 d至约75%细胞产生明显病变后反复冻融细胞离心收集上清;采集并处理豚鼠血,配置1%红细胞悬液,采用微量血凝实验在96孔V型板上测定表达产物的血凝效价。
2 结果
2.1 TAT-VP2基因构建及鉴定
以PPV基因组DNA为模板扩增VP2基因,琼脂糖凝胶电泳分析,可见预期大小约1.75 kb的目的条带(图1);以纯化的VP2基因为模板,经两轮PCR扩增出含两段TAT序列的目的基因,扩增产物经纯化回收后克隆到pMD-18T载体进行酶切鉴定,可见预期大小约1.8 kb和2.7 kb的目的条带(图2);测序分析结果与预期相符。

M.DNA标准DL 2 000; 1~2.VP2 PCR扩增产物M.DNA Marker DL 2 000; 1-2.VP2 amplification products

M.DNA标准DL 15 000; 1~2.pMD-TAT-VP2双酶切产物M.DNA Marker DL 15 000; 1-2:pMD-TAT-VP2 digestion products
2.2 重组杆粒rBacmid-TAT-VP2 的构建及鉴定
pMD-TAT-VP2载体酶切回收目的片段,并将其插入pFastBac I载体,构建重组转移载体pFast-TAT-VP2,进行PCR及双酶切鉴定,结果与预期一致(图3);将pFast-TAT-VP2转化DH10Bac感受态细胞,经蓝白斑筛选后提取重组杆粒rBacmid-TAT-VP2,并用通用引物M13F/R进行PCR鉴定,可见约4.1 kb的目的条带(图4),与预期结果相符,提示成功获得重组杆粒rBacmid-TAT-VP2。

M.DNA标准DL 5 000; 1.pFastBac-TAT-VP2 PCR产物; 2.pFastBac-TAT-VP2 酶切产物
M.DNA Marker DL 5 000; 1.pFastBac-TAT-VP2 PCR amplification products; 2.pFastBac-TAT-VP2 digestion products
图3 pFast-TAT-VP2质粒PCR及酶切鉴定
Fig.3 Identification of the recombinant pFast-TAT-VP2
by PCR and enzyme digestion
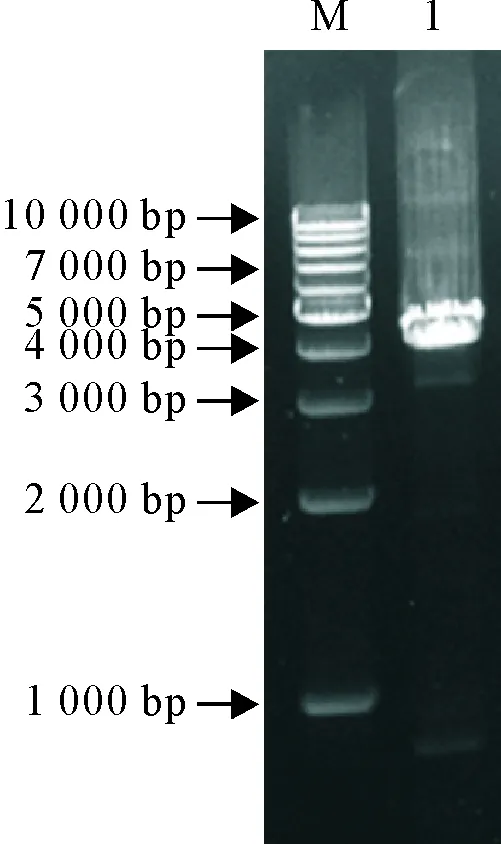
M.DNA标准DL 1 000; 1.rBacmid-TAT-VP2 PCR产物
M.DNA Marker DL 1 000; 1.rBacmid-TAT-VP2 PCR amplification products
图4重组杆粒rBacmid-TAT-VP2 PCR鉴定
Fig.4 Identification of the recombinant rBacmid-TAT-VP2 by PCR
2.3 重组杆状病毒rBV-TAT-VP2的获得与病毒扩增
重组杆粒rBacmid-TAT-VP2转染Sf9细胞后获得P1代重组杆状病毒,提取其DNA进行PCR鉴定,结果可检测到目的条带,证实目的基因TAT-VP2成功整合到重组杆状病毒基因组中。将鉴定为阳性的P1代重组杆状病毒感染Sf9细胞,培养96 h后,细胞出现明显的病变,细胞变大,变圆或不规则,上漂裂解,正常细胞则无明显病变(图5)。

A.正常Sf9细胞; B.感染rBV-VP2病变细胞; C.感染rBV-TAT-VP2病变细胞A.Normal Sf9 cells; B.cells infected with rBV-VP2 ; C.cells infected with rBV-TAT-VP2
2.4 表达产物间接免疫荧光鉴定
用P3代重组杆状病毒感染Sf9细胞48 h后,采用IFA方法检测目的蛋白表达情况。结果显示重组杆状病毒表达产物可被PPV抗体特异性识别,荧光显微镜下可见绿色荧光,而未感染杆状病毒的正常昆虫细胞则无特异性荧光反应(图6),表明TAT-VP2蛋白在重组杆状病毒中成功表达。

A1.正常Sf9细胞(白光); A2.正常Sf9细胞(荧光); B1.rBV-VP2感染细胞(白光); B2.rBV-VP2感染细胞(荧光); C1.rBV-TAT-VP2感染细胞(白光); C2.rBV-TAT-VP2感染细胞(荧光)
A1.Normal Sf9 cells(light); A2.Normal Sf9 cells(fluorescence); B1.Cells infected with rBV-VP2(light); B2.Cells infected with rBV-VP2(fluorescence); C1.Cells infected with rBV-TAT-VP2(light); C2.Cells infected with rBV-TAT-VP2(fluorescence)
图6表达产物间接免疫荧光鉴定
Fig.6 Indirect immunofluorescence identification of expressed products
2.5 表达产物电镜观察
重组杆状病毒感染Sf9细胞3 d~5 d后,收集细胞上清进行电镜观察,结果观察到形态大小与野生型PPV及VP2-VLPs相似的、直径约20 nm的VLPs,表明TAT-VP2融合蛋白能在体外自行组装形成VLPs(图7)。
2.6 表达产物血凝效价测定
采用微量血凝试验测定表达产物的HA效价,结果显示,TAT-VP2融合蛋白具有类似于全病毒的血凝活性,能有效凝集豚鼠的红细胞,血凝效价达29。

A.VP2 蛋白形成的VLPs ; B.TAT-VP2蛋白形成的VLPs
A.VLPs formed by VP2 proteins; B.VLPs formed by TAT-VP2 proteins
图7表达产物电镜观察
Fig.7 Electron microscopic observation of expressed products
3 讨论
目前,PPV严重制约我国养猪业可持续发展,虽然PPV的致病机理还未研究透彻,但VP2蛋白已经被证实是PPV的主要衣壳蛋白,包含了PPV主要的抗原表位,是中和抗体作用的主要靶蛋白,因此VP2是分子水平上诊断PPV的主要抗原,同时也是PPV基因工程亚单位疫苗研究的主要靶标[11]。VP2能在大肠埃希菌、酵母、哺乳动物细胞及杆状病毒系统中有效表达,并表现出良好的免疫原性。也有研究报道,单独的VP2蛋白不添加佐剂作为免疫原时,其免疫效果并不理想,这可能与蛋白质来源有关,也可能与蛋白不能高效进入动物细胞因而不能进入MHCⅠ类分子介导的抗原提呈途径刺激产生细胞免疫有关[12-14]。
蛋白的结构影响其免疫活性,不同表达系统表达的VP2蛋白免疫活性差异明显。大量研究发现,大肠埃希菌表达的PPV-VP2蛋白由于蛋白的错误折叠及修饰不能自行组装成VLPs,使用VP2蛋白的免疫效果不佳,而杆状病毒表达的VP2蛋白能自行组装形成VLPs并诱导强烈的免疫反应,表明VP2蛋白的VLPs形成与免疫保护效果密切相关[15-16]。杆状病毒表达系统是以杆状病毒为载体,昆虫细胞为真核表达系统,目前已经成为病毒疫苗研究的主要平台。与大肠埃希菌表达系统相比,杆状病毒表达系统能对表达的蛋白进行正确折叠及磷酸化、糖基化等修饰,从而最大限度保留蛋白的天然生物活性;此外,杆状病毒宿主范围小,仅感染节肢动物,在哺乳动物细胞中不能复制,而且昆虫细胞体外培养可不添加任何动物细胞相关的附属物,因而与其他病毒真核表达系统相比具有更高的安全性。因此,该系统在构建生产VLPs疫苗方面具有明显的优势[17]。
细胞膜的屏蔽作用制约了动物蛋白疫苗的发展,提高外源蛋白的入膜效率,可能是提高蛋白疫苗免疫效果的有效途径。蛋白转导域能引导与之融合表达的抗原在细胞间及细胞内传播,促进CTL表位的加工和释放,同时提高抗原表位的细胞提呈[18]。Chen H J等[19]研究表明,VP22蛋白转导域能显著增强马立克病毒(MDV)融合蛋白VP2在小鼠体内的免疫应答;Bolhassani A等[20]发现将VP22与利什曼原虫的amastin蛋白编码基因融合表达,能显著提高amastin疫苗的免疫原性;Yu Z等[21]融合表达TAT-P53蛋白并转导肿瘤细胞,结果发现融合蛋白能有效进入肿瘤细胞并发挥抗肿瘤作用;Leifert J A等[22]研究发现TAT的核心肽段与LCMV的核蛋白融合表达并不能提高全蛋白编码抗原表位的提呈作用,不能增强细胞的免疫原性,但与核蛋白中NP396表位融合却能极大程度提高NP396表位的细胞提呈作用。基于TAT的跨膜特性及PPV-VP2 VLPs组装特性,本研究将TAT与PPV-VP2基因进行融合,并通过杆状病毒表达系统进行表达,研究TAT-VP2形成病毒样粒子的可行性。结果显示,成功构建了TAT-VP2融合基因的重组杆状病毒rBV-TAT-VP2并在Sf9细胞中成功表达了重组蛋白TAT-VP2,间接免疫荧光证实融合蛋白能与PPV抗体结合,具有与PPV VP2蛋白相似的生物活性;电镜观察进一步证实TAT-VP2蛋白能自行组装成与PPV天然病毒粒子类似的VLPs,表明VP2 N端融合TAT不影响VP2蛋白的表达,不影响病毒样粒子的有效组装;血凝试验结果显示融合TAT重组PPV-VLPs具有与全病毒相同的血凝活性。本研究证实TAT-VP2融合蛋白能在杆状病毒表达系统中成功表达并能自行组装形成病毒样粒子,为后续研制高效PPV亚单位疫苗奠定了基础。

