ANCA相关性小血管炎合并感染的致病菌谱及预后分析
常 洁 梁素忍 郭佳音 董少卿 郭志玲
抗中性粒细胞胞质抗体相关性小血管炎(antineutrophil cytoplasmic antibody-associated vasculitis, AAV)是以血清中存在抗中性粒细胞胞质抗体(antineutrophil cytoplasmic antibody, ANCA)为主要特征性表现的一类疾病,病情进展迅速,累及多个脏器,需要长期治疗,是临床常见的危重症疾病之一。最常见的受累器官是肺和肾脏[1]。由于AAV好发人群为中老年人,再加上AAV本身免疫功能紊乱以及大剂量激素和免疫抑制剂的应用,患者常常容易合并感染。一旦发生感染,治疗极其困难,预后差,给临床医生带来了不少的困惑和难度。AAV合并感染并发症近年来也逐渐受到重视,但目前关于AAV合并感染患者的致病菌谱及药物敏感分析方面的大样本研究还比较少。鉴于此,本研究拟分析AAV合并感染患者的常见致病菌及药物敏感情况,探讨临床特点以及影响预后的危险因素,从而为临床的预防和抗感染治疗提供合理依据,提高治疗有效率,改善预后。
对象与方法
1.研究对象:收集1997年1月~2016年12月笔者医院收治并确诊的活动性AAV合并感染的患者资料共113例。
入选标准:AAV的诊断符合2012年Chapel Hill关于ANCA相关性小血管炎的诊断共识,即血清ANCA阳性,即cANCA+抗蛋白酶3抗体阳性或者pANCA+抗髓过氧化物酶抗体阳性,存在肾脏或其他脏器(如肺、皮肤、关节等)等活动性病变,并排除继发性血管炎如过敏性紫癜、药物过敏、肿瘤、冷球蛋白血症等疾病[1]。
感染诊断:参照我国中华医学会关于社区与医院获得性肺炎、尿路感染、肠道感染等的诊断和治疗指南,结合患者临床症状、体征、实验室和微生物学检查进行综合判断以上AAV患者是否合并感染。普通感染通过临床表现,辅助检查及体液培养进行诊断。特殊感染如结核分枝杆菌感染根据PPD皮肤试验、T-SPOT试验和抗结核治疗的反应诊断。深部真菌感染诊断标准:患者有发热、咳嗽、尿频、尿急、尿痛、腹泻等症状,且体液培养或活组织中发现真菌,可确诊为深部真菌感染,如胸部X线片或CT提示间质性肺炎或伴偏心性空洞,高度怀疑肺部真菌感染。卡氏肺孢子虫(pneumocystis carinii)感染:通过痰液和(或)肺泡灌洗液涂片或PCR检查发现卡氏肺孢子虫可明确诊断;对有免疫缺陷患者出现肺部X线或CT表现为磨玻璃影并逐渐进展为实变纤维化,临床表现为发热、呼吸困难,与体征不符者可疑诊为卡氏肺孢子虫肺炎(pneumocystis carinii pneumonia, PCP)。
2.收集临床资料:收集入选患者的年龄、性别、AAV确诊时间及病程、AAV类型、激素和免疫抑制剂治疗方案(包括单用激素或激素联合环磷酰胺、吗替麦考酚酯、环孢素等免疫抑制剂,应用剂量及疗程)等临床资料,住院期间实验室检测患者血红蛋白、血清白蛋白、血清肌酐水平、外周血CD4+T淋巴细胞计数、超敏C反应蛋白、降钙素原等项目。
3.致病菌培养及药敏试验:在患者出现感染征象时及时留取血液及体液标本进行培养,包括痰标本、咽拭子标本、尿液标本、粪便标本、分泌物标本等。进行取痰时要求患者在其充分漱口后取清晨第1口痰,痰标本量控制在1ml以上,对于有气管插管的患者采用一次性吸痰管通过其气管插管或者气管切开套管深部取痰。血培养采用法国生物梅里埃公司 BACT/Alert 3D全自动血培养仪及配套的血培养瓶分别进行需氧及厌氧菌培养。梅里埃公司全自动微生物分析仪进行药敏分析鉴定。
对AAV合并感染的患者按照医疗常规进行抗感染治疗:将激素和免疫抑制剂酌情减量或停用,根据病原菌培养结果及药敏分析结果调整抗生素治疗方案。出现呼吸衰竭患者及时进行呼吸机辅助呼吸及营养支持治疗。需要透析患者根据病情及时进行血液透析或CRRT治疗。统计所有患者感染的发生时间、部位、预后及转归。
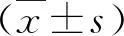
结 果
1.临床资料:113例AAV合并感染患者平均年龄为64.91±10.12岁,男、女性别比例为55∶58,其中65例为pANCA和抗髓过氧化物酶阳性,诊断为显微镜下多血管炎(microscopic polyangiitis, MPA),占57.52%;37例为cANCA和抗蛋白酶3抗体阳性,诊断为肉芽肿性多血管炎(granulomatosis with polyangiitis, GPA),占32.74%;11例为嗜酸细胞性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis, EGPA),占9.73%。治疗方案予以激素治疗者(包括口服或静脉泼尼松、甲基泼尼松龙、地塞米松等)共93例,占82.30%,其中单用激素治疗者47例,联合应用免疫抑制剂治疗者(包括环磷酰胺、吗替麦考酚酯、环孢素等)共46例,另有20例未应用任何激素和(或)免疫抑制剂治疗,占17.70%。所有病例分别来自笔者医院肾内科、风湿免疫科、呼吸科、急诊科及重症监护室。AAV合并感染患者基本临床资料,详见表1。
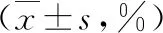
表1 AAV合并感染患者临床资料
激素累计剂量计算方法:各种不同剂型及用法的激素均统一转化为泼尼松后计算累计量,单位为mg。MPA.显微镜下多血管炎;GPA.肉芽肿性多血管炎;EGPA.嗜酸细胞性肉芽肿性多血管炎
2.感染的致病菌分析:在113例患者中,肺部感染85例,泌尿系感染 16例,肠道感染12例,以肺部感染占绝大多数,共占75.38%。对113例患者发生感染时进行体液致病菌培养,共计98例次,培养阳性的共55例次,培养阳性率为56.12%。其中,G+菌18例次,G-菌24例次,真菌感染8例次(曲霉菌3例次、白色念珠菌3例次、热带念珠菌1例次、近平滑念珠菌1例次),混合感染5例次(表2)。另外,通过临床及其他特殊检查确诊结核分枝杆菌3例次,病毒2例次,PCP 1例次,疑诊真菌感染5例次。
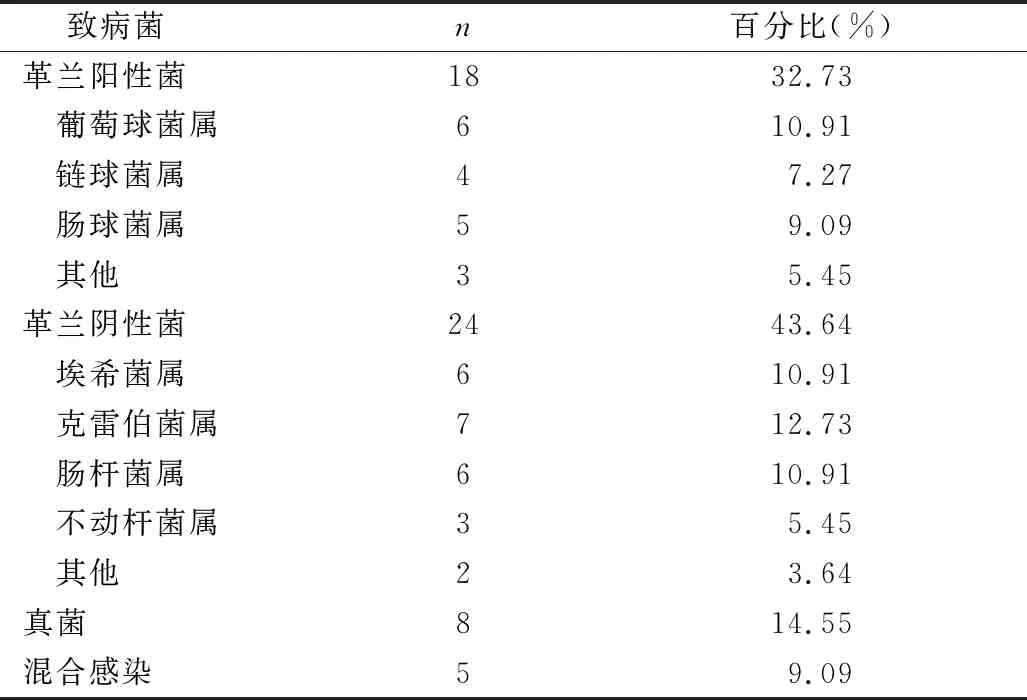
表2 AAV合并感染患者致病菌的构成及比例
3.致病菌药敏分析: 对培养标本进行致病菌药物敏感分析,G+菌以葡萄球菌、链球菌和肠球菌为主,对万古霉素、利奈唑胺、替考拉宁的敏感度最高,均为100%;其次是利福平和庆大霉素,敏感度分别为77.78%和72.22%;对克林霉素、苯唑西林及青霉素敏感度低,分别为16.67%、16.67%、11.11%(表3)。G-菌以克雷伯杆菌和肠杆菌为主,对美罗培南、亚胺培南、阿米卡星的敏感度分别为75.00%、70.83%、70.83%,其次为哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、头孢吡肟,敏感度分别为 66.67%、62.50%、62.50%;对头孢呋辛、头孢噻肟敏感度较低,仅为 29.17%、37.50% (表4)。

表3 革兰阳性菌的药物敏感分析

表4 革兰阴性菌的药物敏感分析
4.AAV合并感染患者的预后分析:113例AAV合并感染患者均在笔者医院给予积极正规治疗,根据药敏调整抗生素。治疗后经追踪随访,其中101例患者病情改善,12例患者最终死亡,均死于重症肺炎。在死亡的12例患者中,真菌感染者6例,混合感染者2例,革兰阳性菌感染者2例,革兰阴性菌感染者1例,PCP 1例。在不同病原菌感染的预后方面,PCP和真菌感染预后最差。共8例确诊为真菌感染患者,6例死亡,病死率达到75%。
AVV合并感染患者病情好转组和死亡组在临床指标方面的差异详见表5。年龄、血红蛋白水平、外周血CD4+T淋巴细胞计数及感染前3个月激素累计剂量上两组比较,差异有统计学意义(P<0.05),提示高龄、贫血严重、免疫功能低下以及激素用量大的患者预后不佳。进一步对以上因素进行多因素二分类Logistic回归分析,结果提示血红蛋白低的患者和外周血CD4+T淋巴细胞计数低的患者是AAV合并感染预后不良的危险因素(P<0.05,表6)。
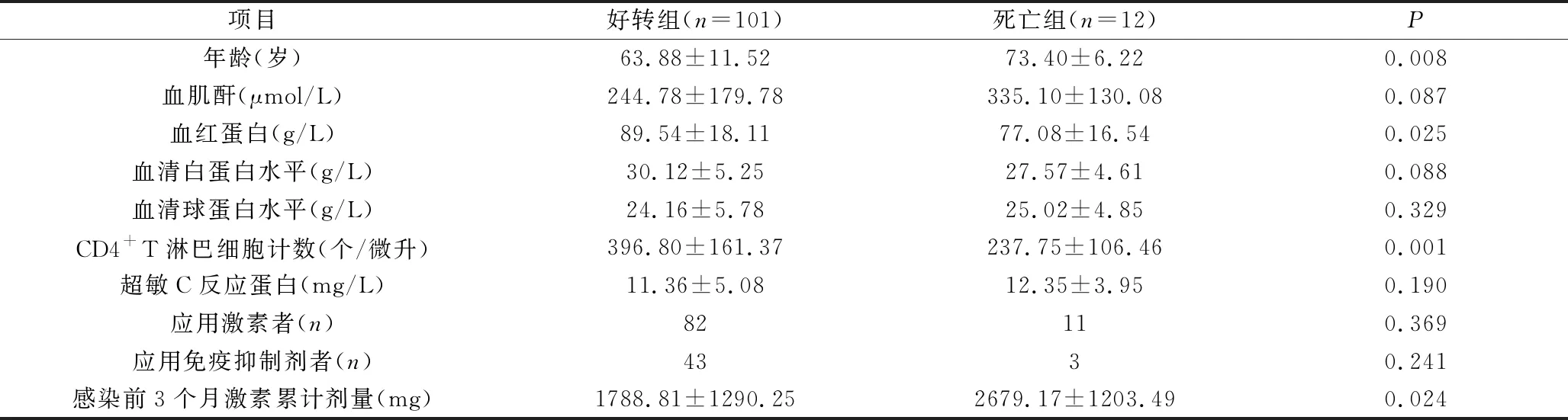
表5 AAV合并感染患者病情好转组与死亡组临床指标的比较分析
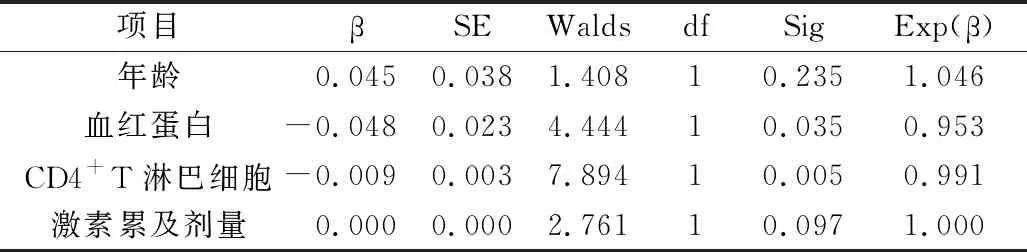
表6 AAV合并感染患者预后影响因素的Logistic回归分析
讨 论
ANCA相关性小血管炎是临床上好发于中老年患者的一类严重疾病,包括显微镜下多动脉炎(MPA)、肉芽肿性多动脉炎(GPA)和嗜酸性肉芽肿性多动脉炎(EGPA)。髓过氧化物酶(MPO)和蛋白酶3(PR3)是ANCA的主要靶抗原。AAV是常见的自身免疫性疾病,据报道在西方国家发生率仅次于类风湿关节炎[2]。在我国目前还缺乏大型流行病学研究统计研究,临床上往往由于对其认识不够以及其临床表现的多样性而漏诊误诊,3个月内确诊率不足50%。AAV累及肾脏可表现为血尿、蛋白尿,甚至急进性肾炎,累及肺脏则表现为咳嗽、咳痰、痰中带血或者大咯血、呼吸困难等,除此之外,还可以表现为神经系统、消化系统症状以及发热、乏力等非特异全身症状,病情往往发展迅速,预后极差。然而,近年来,随着对AAV的认识和研究的逐渐深入,经过积极的治疗后AAV的预后明显改善,病死率大大下降。大剂量激素及免疫抑制剂的应用则是目前国际和国内指南中公认的治疗方案,但随之而来的并发症尤其是感染也逐渐引起了重视[3]。
AAV合并感染的发生率很高,大约为26%~31%,而感染则是AAV患者最重要的死因[4,5]。McGregor等[6]发表的一项研究中显示,对489例AAV患者平均随访2.8年,95%的患者存在肾脏损害,根据病情给予不同的免疫抑制剂包括激素、环磷酰胺、甚至利妥昔单抗等,在随访期间,大概有1/4的患者在第1年内出现严重感染。感染主要累及呼吸系统,其次是泌尿系统。Mohammad等[7]的研究也证实了血管炎患者中严重感染往往发生在确诊后的半年内。一项类似的国内研究显示,124例患者有44%的感染发生在第1年(69%发生在前6个月)[8]。笔者的研究结果显示,113例AAV患者合并感染的部位仍以肺部感染最多(75.38%),其次是泌尿系感染(15.38%)和肠道感染(9.23%)。感染发生的平均时间为6.26±4.15个月,激素治疗后4.28±2.87个月,这和国内外的研究结果基本一致。肺部易合并感染的原因考虑有以下几方面因素:(1)由于AAV本身好发于老年人,往往基础病多,且大多存在肾功能不全,为感染易患人群[9]。(2)AAV病变累及肺部小血管造成的渗出性炎性病变,肺部天然屏障受损,易作为病原菌的良好培养基。(3)AAV往往病情发展迅速,为控制血管炎病变进展,治疗上多数患者需应用激素及免疫抑制剂,而激素及免疫抑制剂的应用更加降低了患者本身的免疫力,增加了感染的发生率[10]。
本研究发现AAV合并感染的最常见病原菌为革兰阴性菌,包括克雷伯杆菌属、肠杆菌属等,其次为革兰阳性菌,以葡萄球菌属比例最高,另外,真菌感染比例高,达到14.55%。国外研究报道,金黄色葡萄球菌是分离出的最常见病原体[10]。另一项国外研究显示,AAV 患者感染病原体主要为肺炎链球菌、流感嗜血杆菌、铜绿假单胞菌和金黄色葡萄球菌[11]。一项国内研究显示,最常见的感染病原体为细菌和真菌,感染的细菌种类主要为金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌[9]。笔者研究与上述研究虽略有不同,但大体一致。需要注意的是,真菌感染的比例较文献报道高,提示真菌感染在AAV患者合并感染的病原菌中不容忽视,需要提高警惕。
AAV合并感染往往起病急、发展快、病情较重,病原菌培养往往时间较长,且阳性率不高,故而多数患者需要在感染起始时即给予正规有效的经验性抗生素治疗。笔者研究通过分离培养感染患者的体液及血液标本得到了相对可靠的药敏分析结果,对AAV合并感染患者的治疗具有非常有意义的临床指导价值。研究发现抗感染治疗首要考虑的抗生素需覆盖革兰阳性菌尤其是金黄色葡萄球菌和包括针对克雷伯杆菌和肠杆菌属的革兰阴性菌。G+菌对万古霉素、利奈唑胺、替考拉宁的敏感度最高,均为100%;其次是利福平和庆大霉素,而G-菌对美罗培南、亚胺培南和阿米卡星的敏感度最高,因此在经验性抗生素选择方面,建议一旦确定感染,宜联合以上强有力的敏感抗生素强化抗感染治疗,早期控制,方能改善预后。
此外,笔者还针对影响感染患者的预后因素进行了统计学分析。研究结果表明,病情好转组和死亡组患者在年龄、血红蛋白水平、CD4+T淋巴细胞计数及感染前3个月激素累计剂量方面比较,差异有统计学意义(P<0.05)。Logistic回归分析结果提示血红蛋白低的患者和外周血CD4+T淋巴细胞计数低的患者是AAV合并感染患者预后不良的危险因素。贫血严重和免疫功能低下的患者更易合并感染,合并感染后易发展为重症感染,预后差。有研究报道89%的AAV患者的感染与激素有关,激素剂量减少后感染率随之下降[17]。血管炎患者本身免疫力差,而大剂量的激素及免疫抑制剂应用则使患者更加处于严重免疫功能低下的高危状态,易合并机会性感染,是预后不良的危险因素[18]。本研究有一部分患者由于高龄或者家庭等各方面因素未使用激素及免疫抑制剂治疗,在合并感染后治疗难度相对较小,预后也较应用大剂量激素者略好。因此,如何在AAV中权衡激素及免疫抑制剂的应用疗程及剂量目前还是一个值得商榷的问题。值得注意的是,在治疗的同时致力于加强营养支持、纠正贫血等措施对于改善预后是有积极意义的。
综上所述,AAV患者易合并感染,以肺部感染多见,感染的微生物以细菌多见,但需小心警惕机会性病原微生物感染如真菌和PCP,病死率高,预后极差,必要时需预防用药。贫血和免疫功能低下的感染患者预后差。本研究总结分析了AAV患者感染的病原微生物学、临床特点及预后影响因素,为感染的防治提供了科学依据。但由于本研究为单中心研究,存在样本量不足以及研究方法的局限,因此还需进一步开展大样本、多中心的临床研究验证。

