MELD评分联合NLR预测肝硬化患者短期预后的价值
陈 卉 谭诗云
自2002年以来,终末期肝病模型(model for end-stage liver disease,MELD)评分系统已成为评价各种中晚期肝脏疾病严重程度的有效指标,在国外常作为终末期肝病患者接受肝移植术器官分配的标准,是其短期生存率的有效独立预测因子[1]。然而,尽管MELD已成功减少了准备或已行肝移植术患者的病死率,但低分数MELD预测肝硬化患者的病死率的准确性大大降低[2]。根据当前的文献描述,MELD评分系统并未包括门静脉高压症的临床并发症,如腹水、出血等以及客观标志物(如低钠血症),而这些与肝硬化患者病死率密切相关。另外,系统性炎性反应在肝硬化的发生、发展中起到十分重要的作用,中性粒细胞-淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)作为新的反映机体炎性状态的指标,已受广泛的关注。已有研究证明高NLR与心血管疾病及各种实体瘤的预后密切相关[3,4]。本研究主要是探讨MELD评分结合NLR预测肝硬化患者短期预后的价值。
对象与方法
1.对象:以2017年1~12月期间在笔者医院住院的408例肝硬化患者为研究对象。纳入标准:按照各种病因所致肝硬化的诊疗指南,根据患者入院情况、症状、体征及辅助检查确诊为肝硬化,必要时也可行肝脏穿刺活检以确诊[5~8]。排除标准:①合并其他系统原发严重疾病(心脏、脑、肾脏等);②合并恶性肿瘤;③妊娠;④院外已行肝移植或经颈静脉肝内门腔静脉分流术治疗;⑤合并血液系统疾病(白血病、淋巴瘤等);⑥资料缺失及失访者。
2.方法:收集患者的一般资料(性别、年龄、病因、院前治疗等),记录患者住院后24h内第1次实验室检查指标,包括白细胞计数、中性粒细胞计数、淋巴细胞计数、红细胞计数、血红蛋白、血小板、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白(ALB)、总胆红素(TBil)、血清肌酐(Scr)、血清钠(Na)、凝血酶原时间(PT)、国际标准化比率(INR),观察患者腹腔积液以及肝性脑病情况,记录患者肝硬化相关并发症。CTP评分系统包括5个指标,即白蛋白、总胆红素、腹腔积液、肝性脑病和PT,其中A级(5~6分)、B级(7~9分)、C级(≥10分)。根据Mayo临床小组的MELD 评分公式,MELD评分=3.8×In(总胆红素×0.058)+11.2×InINR+9.6×In(肌酐×0.011)+6.4×病因(酒精或胆汁性为0,其他为1),总胆红素及肌酐单位为μmol/L,MELD-Na 评分= MELD评分+1.59×(135-血清钠),血清钠<120mmol/L时按120mmol/L计算,>135mmol/L时按135mmol/L计算;iMELD评分= MELD 评分+0.3×年龄-0.7×血清钠+100;iMELD-NLR=iMELD+NLR。NLR=中性粒细胞计数/淋巴细胞计数。以入院当日为观察起点,随访时间为3个月,纳入研究的患者的3个月预后资料来自电话随访以及医院的病例系统。最初,452例患者确定符合纳入标准,这些患者中有44例被排除在外,其中5例合并其他系统原发严重疾病,17例合并肝癌,13例失访或资料不全,2例合并妊娠,6例已行肝移植或分流术,1例合并淋巴瘤。
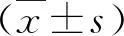
结 果
1.408例肝硬化患者死亡组与生存组之间基本临床特征的比较:408例肝硬化患者,随访3个月时78例死亡,所占比例为19%;两组之间性别、ALT、AST、院前治疗,差异无统计学意义;死亡组患者年龄明显高于生存组,差异有统计学意义(P<0.01)。死亡组白细胞计数、中性粒细胞计数、PT、INR、TBil、Scr高于生存组,差异有统计学意义(P<0.05);死亡组淋巴细胞计数、红细胞计数、血红蛋白、ALB、血清钠低于生存组,差异有统计学意义(P<0.05)。死亡组患者肝硬化相关并发症,如腹腔积液、肝性脑病、出血、感染、肝性脑病、肝肾综合征等发作更频繁,病情更严重些;死亡组NLR、CTP、MELD、MELD-Na 、iMELD和iMELD-NLR评分均高于生存组,差异有统计学意义(P<0.05,表1) 。多因素Logistic回归分析显示年龄、血红蛋白、CTP、MELD、NLR为肝硬化患者不良预后的危险因素(表2)。
2.各评分系统评估408例肝硬化患者3个月预后的准确性:NLR及MELD评分预测肝硬化患者3个月预后的AUC 分别为0.739、0.746,两者差距并不大;NLR最佳临界值为4.61,敏感度为63%,特异性为78%;MELD最佳临界值为8.85,敏感度为64%,特异性为77%。所有评分系统中iMELD-NLR评分的预测价值最佳,其AUC为0.847,NLR与iMELD评分结合可大大提高对患者3个月预后评估的准确性。所有组间比较差异有统计学意义(P<0.05,图1、表3)。
3.NLR 对低 MELD 评分人群预后的评估结果:将 MELD 评分<15分的患者定义为低 MELD 评分人群;本研究中,低MELD 评分人群占总数的91%(371/408),其中死亡组中有53例MELD评分<15分。该组人群中MELD评分的AUC低于整个队列中MELD评分(0.656 vs 0.746)。然而在低MELD评分人群中,NLR对患者预后的评估准确性增加,AUC为0.743,iMELD-NLR的AUC为0.811,P<0.05,差异有统计学意义;此时,NLR最佳临界值仍为4.61,敏感度为66%,特异性为79%(图2、表4)。
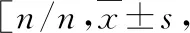
表1 408例肝硬化患者中死亡组和生存组的临床特征的比较中位数(四分位数间距)]
PLT.血小板;ALT.丙氨酸氨基转移酶;AST.天冬氨酸氨基转移酶;ALB.白蛋白;TBil.总胆红素; Scr.血清肌酐;PT.凝血酶原时间;INR.国际标准化比率;MELD.终末期肝病模型;CTP.肝功能分级;NLR.中性粒细胞-淋巴细胞比值
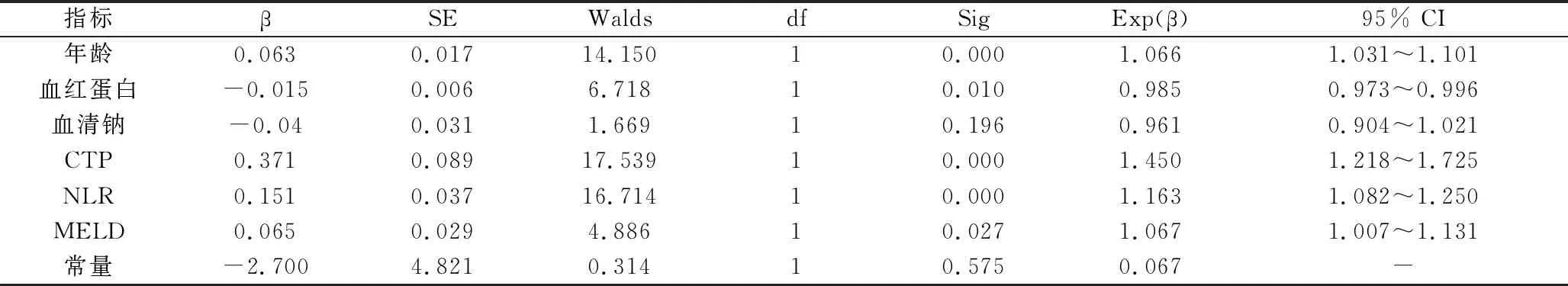
表2 多因素Logistic回归分析
CTP.肝功能分级;NLR.中性粒细胞-淋巴细胞比值;MELD.终末期肝病模型
4.NLR与MELD评分相关性分析:Spearman相关性分析显示NLR与MELD评分呈正相关(r=0.17,P=0.001),差异有统计学意义。当MELD评分越高时,NLR值越大,纳入研究的肝硬化患者死亡风险越大(图3)。
讨 论
近年来,国内外关于寻找评估肝硬化患者预后指标的试验层出不穷,其中最热门当属CTP评分、MELD评分及MELD相关评分系统,比如MELD-Na、MELDNa、iMELD等[9~11]。不过,各个评分系统对于肝硬化患者预后评估价值,各研究者研究结果并不统一。本研究中CTP 评分AUC高于MELD评分(0.805 vs 0.746),但低于MELD-Na、iMELD、iMELD-NLR评分, 其中iMELD-NLR评分最高(其AUC为0.847)。Cheng等[10]利用各种评分系统对失代偿期乙型肝炎肝硬化患者不同时期预后的进行评估,发现在1、3、6、12 个月当中,CTP 评分的AUC均高于MELD、MELD-Na评分。也有研究发现MELD评分及MELD相关评分系统预测乙型肝炎肝硬化患者3个月预后的能力高于CTP评分,所有评分系统当中iMELD评分的AUC最高,其值为0.897,其准确性也最高,为89.3%[11]。

图1 NLR与MELD评分及其他评分系统ROC曲线下面积的比较
表3 各评分系统判断肝硬化患者3个月预后的曲线下面积分析
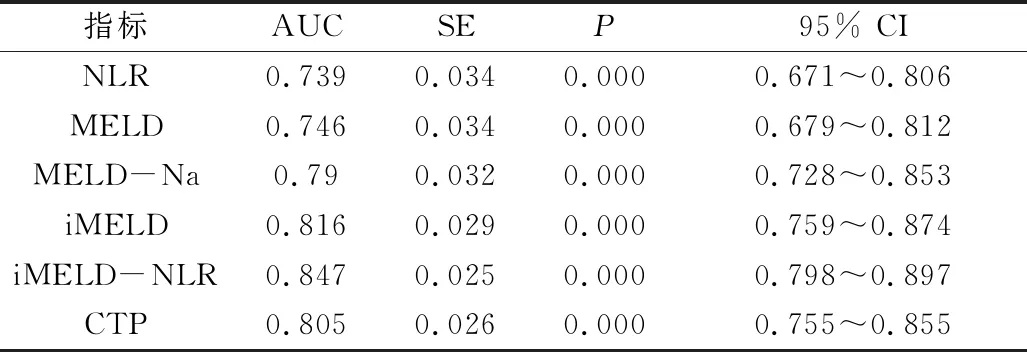
指标AUCSEP95% CINLR0.7390.0340.000 0.671~0.806MELD0.7460.0340.000 0.679~0.812MELD-Na0.790.0320.000 0.728~0.853iMELD0.8160.0290.000 0.759~0.874iMELD-NLR0.8470.0250.000 0.798~0.897CTP0.8050.0260.000 0.755~0.855
MELD.终末期肝病模型;CTP.肝功能分级;NLR.中性粒细胞-淋巴细胞比值
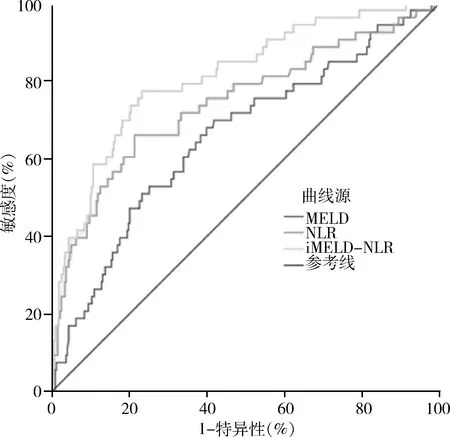
图2 低MELD评分人群中,NLR、MELD评分的ROC曲线下面积比较
表4 低MELD评分人群中,NLR、MELD评分的ROC曲线下面积分析
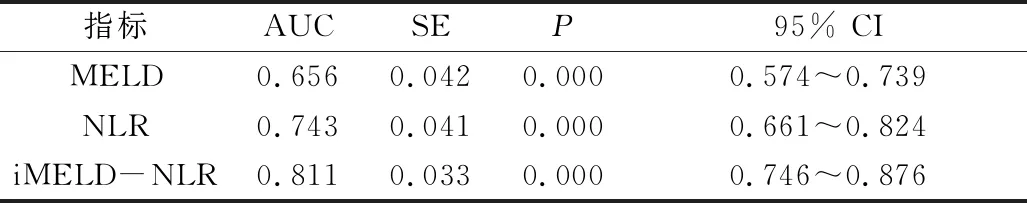
指标AUCSEP95% CIMELD0.6560.0420.000 0.574~0.739NLR0.7430.0410.000 0.661~0.824iMELD-NLR0.8110.0330.000 0.746~0.876
MELD.终末期肝病模型;NLR.中性粒细胞-淋巴细胞比值
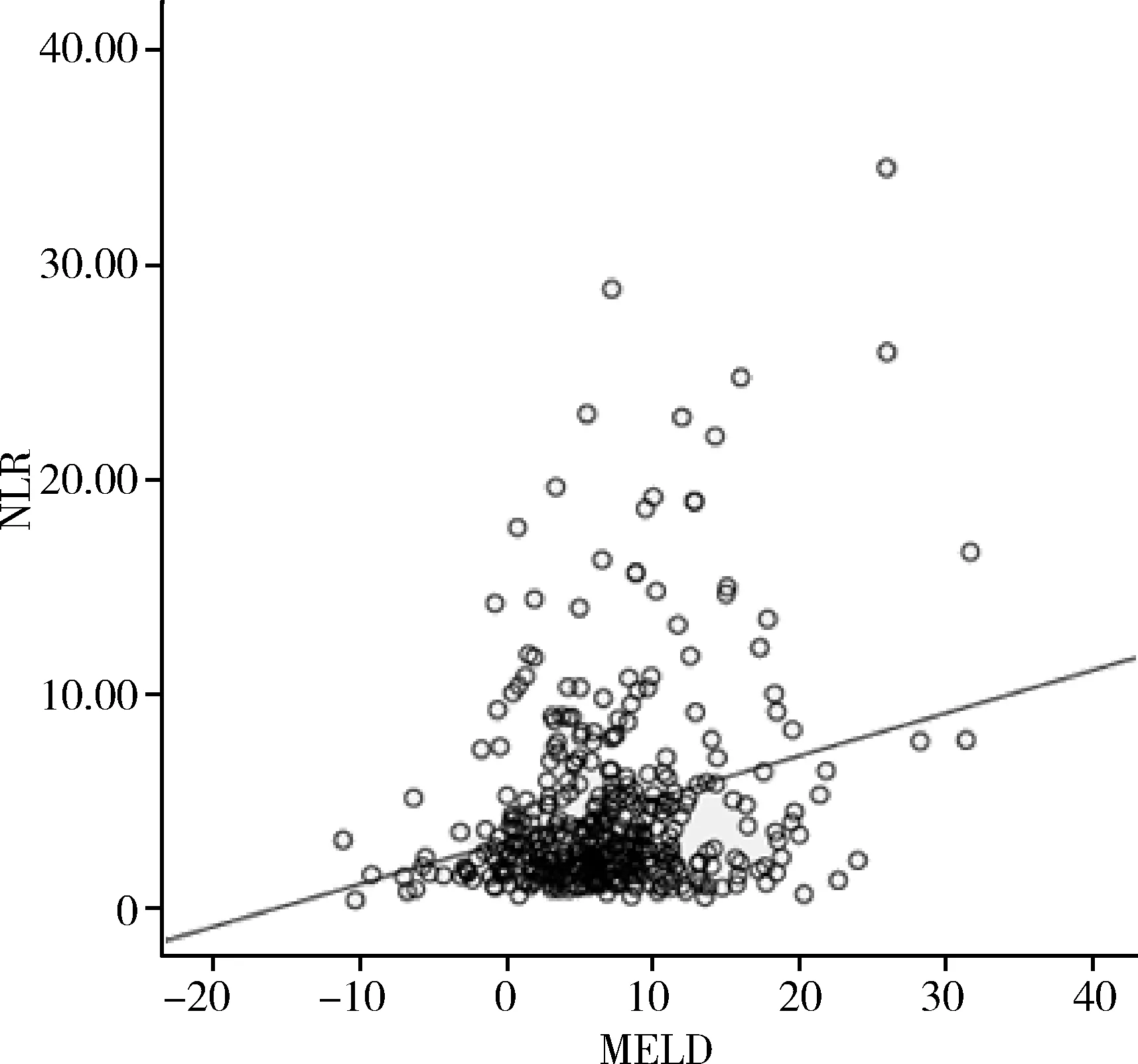
图3 NLR与MELD评分相关性分析
2006年,Biggins等[12]首先建立了“MELD-Na”评估系统,低钠血症在肝硬化患者特别是失代偿中特别常见,甚至有研究发现低钠血症与门静脉高压的严重程度正相关,而且还是早期肝肾综合征的独立预测因子,MELD评分结合血清钠能提高对肝硬化患者短期预后能力[13]。iMELD评分系统在MELD评分基础上增加血清钠水平及患者年龄因素,年龄是一个与死亡风险相关的连续变量,老年患者的生存率较差。本研究当中的结果就显示,年龄是影响肝硬化患者短期预后的重要的独立危险因素。另外,D′Amico等[14]关于118例肝硬化患者预后研究的系统回顾分析显示,年龄是生存期最重要的独立预后因素。不管使用哪一种评分系统,在评估肝硬化患者短期预后时都应将患者年龄纳入观察指标中,对于年龄大的患者更应该注意其短期或长期预后。目前,各评分系统评估能力之间的比较尚未分出胜负,但比较确定的是它们均有自身优势性和局限性,应该综合评估患者疾病变化。此外,也应该积极寻找简单、方便、准确性高的评估预后的指标。
MELD评分的预后准确性相对较低,且MELD评分低的患者仍然存在早期病死率,其原因可能有以下几点:①完全依赖于客观的实验室数据;②未涉及肝硬化失代偿期急性事件的指标;③缺乏涉及肝硬化病理生理学中其他关键决定因素,比如晚期肝硬化患者通常会出现免疫功能障碍。CTP评分、MELD评分及相关评分系统均未将免疫功能障碍这一指标纳入其中。在晚期肝硬化患者的病程中,无论其病因如何,加剧的炎性反应都将与肝硬化相关的免疫功能紊乱并发[15]。
最近有研究提出肝硬化相关免疫功能紊乱综合征(cirrhosis-associated immune dysfunction,CAID)这一概念。CAID的一个重要特征就是全身性炎症与免疫缺陷共存,它是各种病因引起肝硬化的标志性病理生理学改变[16]。鉴于此,有不少研究者提出可以用NLR对肝硬化患者预后进行评估,中性粒细胞能反映机体促炎反应状态,淋巴细胞能反映机体免疫缺陷状态,而且NLR计算简单、方便、可重复。Zhang等[17]研究发现,NLR能预测肝硬化患者1个月短期病死率,且与肝硬化失代偿期相关并发症呈正相关。NLR不仅能够独自评估肝硬化患者预后情况,也能和MELD评分及MELD相关评分系统协同作用,提高它们评估能力。本研究中iMELD-NLR评分的预测能力为所有评分系统中最高。Kalra等[18]还发现即使在MELD评分较低的肝硬化患者中,NLR也与肝脏相关病死率密切相关,这与本研究结果一致。尽管本研究结果表明NLR和肝硬化病死率升高之间密切相关,但笔者目前也只能推测这一发现的潜在机制。未来探讨这一问题的方向可能包括检测低NLR和高NLR住院患者体内细菌DNA的差异,以及低MELD评分的患者随着时间推移,其体内细菌DNA的变化。改变NLR的药物干预,例如抗生素或免疫调节相关药物治疗,也可能作为解释NLR升高独立预测病死率的能力的潜在机制。
综上所述,NLR可作为肝硬化患者一种额外的预后工具,即使在低MELD评分的患者当中也可预测病死率。不仅如此,MELD相关评分结合NLR对预测肝硬化患者的短期预后具有良好的价值。

