微小RNA-664a-3p在乳腺癌组织的表达及对乳腺癌细胞生物学行为的影响
张 沛 岳青芬 侯青霞 韩听锋
乳腺癌是女性最常见的恶性肿瘤之一,中国乳腺癌发病人数仅次于美国,居全球第二位,且呈逐年上升趋势[1, 2]。微小RNA(microRNA,miRNA)是一类内源性非编码RNA,长度约为19~25个核苷酸[3]。miRNA通过与靶基因mRNA的3′-UTR配对结合,导致靶基因mRNA降解或者抑制其翻译,负向调控靶基因的表达[4]。miR-664a-3p的研究尚处于起步阶段,目前仅发现miR-664a-3p在骨肉瘤细胞中具有肿瘤抑制作用[5]。本研究通过qPCR检测miR-664a-3p在乳腺癌组织和细胞株的表达,并将miR-664a-3p转染到乳腺癌细胞中,观察miR-664a-3p对乳腺癌细胞增殖和侵袭的影响,探讨其影响乳腺癌细胞生物学行为的分子机制。
材料与方法
1.实验材料:(1)一般资料:经笔者医院医学伦理学委员会同意,患者本人或家属签署知情同意书,收集笔者医院妇产科2017年1月~8月经手术切除的新鲜乳腺癌组织标本16例,所有患者在手术前均未行放射治疗、化学治疗等。取其乳腺癌原发肿瘤组织和癌旁组织(距离癌灶边缘>5cm)标本。经病理学诊断证实所得标本为乳腺癌组织,根据具体术中病理报告分为早期浸润癌10例、浸润癌6例。标本术中取出后立即放入液氮中保存。(2)细胞与试剂:RNA提取试剂盒和荧光实时定量试剂盒购自日本TaKaRa公司。DMEM/F12 培养基、RPMI 1640培养基和胎牛血清购自美国Gibco公司。工具细胞HEK293、人乳腺癌细胞株(T47D、MDA-MB-231、BT-549、MCF-7)和正常乳腺上皮细胞MCF-10A购自中国医学科学院基础医学研究所。miR-664a-3p模拟物和miR-NC购自广州市锐博生物科技有限公司。脂质体转染试剂Lipofectamine 3000购自美国Invitrogen公司。pGL3荧光素酶检测系统购自美国Promega公司。二喹啉甲酸(BCA)蛋白定量试剂盒购自武汉博士德公司。一抗β-actin、TEM8、CDK4、Cyclin D1、Vimentin、β-catenin和辣根过氧化物酶标记的二抗均购自美国Cell Signaling Technology公司。增强型化学发光(ECL)检测试剂盒购自北京康为世纪生物科技有限公司。细胞周期检测试剂盒购自中国凯基公司。Transwell小室购自美国Corning公司。
2.细胞培养及转染:在37°C、5%CO2、饱和湿度的培养箱中,使用含10%胎牛血清的DMEM/F12培养基常规培养MCF-10A、T47D、MDA-MB-231和HEK293细胞,使用含10%胎牛血清的RPMI 1640培养基常规培养BT-549和MCF-7细胞。将对数生长期的T47D细胞以每孔2×105个接种于6孔板。依据Lipofectamine 3000转染试剂盒说明书进行转染,转染浓度为50nmol/L。实验细胞分两组,即实验组(转染miR-664a-3p模拟物)和对照组(转染miR-NC)。
3.荧光实时定量聚合酶链反应(qPCR)检测miR-664a-3p和靶基因mRNA表达:Trizol试剂提取总RNA,依据RNA反转录试剂盒说明书反转录RNA为cDNA,取反转录产物qPCR反应,扩增条件为94℃ 5min,94℃ 30s,60℃ 20s,72℃ 20s,共40个循环。使用2-△△Ct法计算miR-664a-3p相对于内参U6的表达量及TEM8相对于内参GAPDH的表达量。引物序列详见表1。
4.生物信息学软件预测miR-664a-3p靶基因及双荧光素酶活性检测:生物信息学软件miRWalk、TarBase和TargetScan预测miR-664a-3p的靶基因并取交集,miR-664a-3p的靶基因可能为TEM8,互补结合序列详见图1。构建野生型及突变型 TEM8-3′ UTR的报告基因质粒,突变区域详见图1,并将野生型、突变型分别与miR-664a-3p和miR-NC共转染入HEK293细胞中,48h后按照双荧光素酶检测试剂盒说明书,检测各组萤火虫荧光素酶和海肾荧光素酶的活性。以萤火虫荧光强度/海肾荧光强度比值反映各组的相对荧光强度。
5.Western blot法检测目的蛋白表达:分别使用细胞裂解液提取两组细胞总蛋白。取25μg蛋白,行10%聚丙烯酰胺凝胶电泳 (SDS-PAGE),电转至聚偏氟乙烯(PVDF)膜,5%脱脂牛奶26℃封闭3h。一抗4℃孵育12h。Tris-HCl缓冲液漂洗2次,辣根过氧化物酶标记的二抗26℃孵育2h,Tris-HCl缓冲液漂洗2次,滴加增强型化学发光试剂(ECL)发光显影分析比较条带变化。
6.流式细胞术(FCM)检测细胞周期:将两组细胞消化收集,使用磷酸盐缓冲液(PBS)漂洗2次,加入1ml 70%乙醇溶液4℃固定1h,离心去上清,PBS溶液漂洗2次,加入1ml碘化丙啶(PI)试剂,26℃避光孵育30min,流式细胞仪检测并分析各组细胞周期,以细胞所处细胞周期百分率表示。
7.CCK-8法检测细胞活力:将两组T47D细胞重悬后计数,每孔4000个接种于96孔板,每间隔24h每孔加入CCK-8试剂10μl,培养箱内孵育4h,在酶标仪450nm波长处测定吸光度(A)值,连续检测5天,以时间为横轴,A值为纵轴,绘制细胞生长曲线。每组实验重复4次。
8.细胞侵袭实验:Transwell侵袭小室上室面铺以细胞外基质(ECM)胶,培养箱内放置4h使ECM胶凝固。将转染后48h的两组T47D细胞消化,使用无血清培养基重悬并计数,以2×104个/孔接种于上室,下室中加入500μl完全培养基,放入培养箱内孵育24h,吸取培养基,小室内加入1ml甲醇固定20min,加入结晶紫溶液500μl染色20min,自来水清洗,棉签擦去未穿过小室底膜的细胞,倒置显微镜下计数穿过小室底膜的细胞数目。

表1 qPCR引物序列
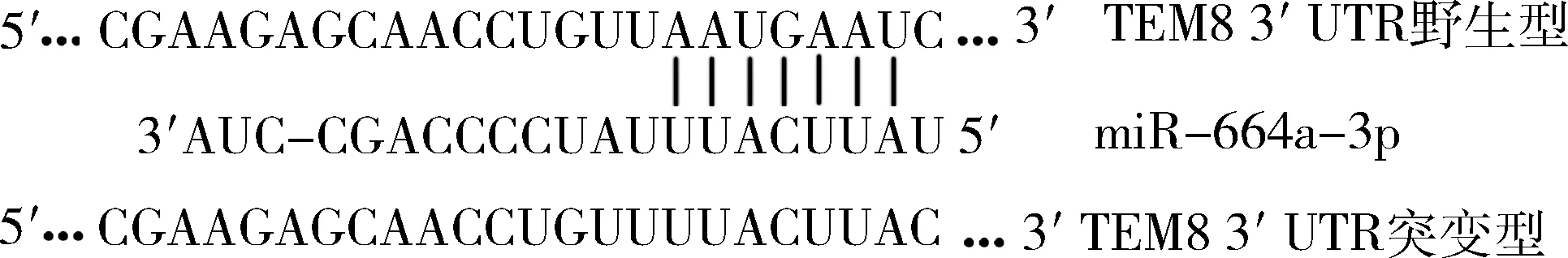
图1 野生型TEM8 mRNA的3′-UTR区域含有miR-664a-3p靶向结合片段

结 果
1.miR-664a-3p在乳腺癌组织的表达:qPCR结果显示(图2),miR-664a-3p在乳腺癌组织和癌旁组织的表达量分别为1.03±0.09、2.10±0.20,miR-664a-3p在乳腺癌组织中表达量显著低于癌旁组织(t=4.83,P<0.01)。
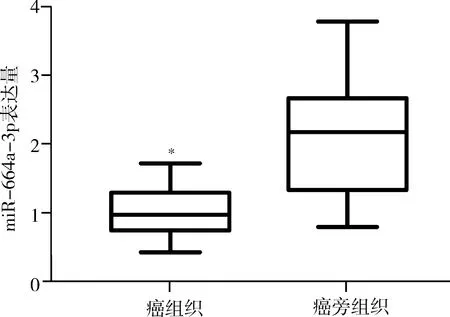
图2 qPCR检测miR-664a-3p在乳腺癌及癌旁组织的表达量与癌旁组织比较,*P<0.01
2.miR-664a-3p在乳腺癌细胞株的表达:qPCR结果显示,miR-664a-3p在乳腺癌细胞T47D、MDA-MB-231、BT-549、MCF-7的表达量明显下调,其中在T47D细胞中的表达量最低,与正常乳腺上皮细胞MCF-10A及其他乳腺癌细胞株比较,差异有统计学意义(P<0.05,图3)。以T47D细胞为对象进行后续实验。
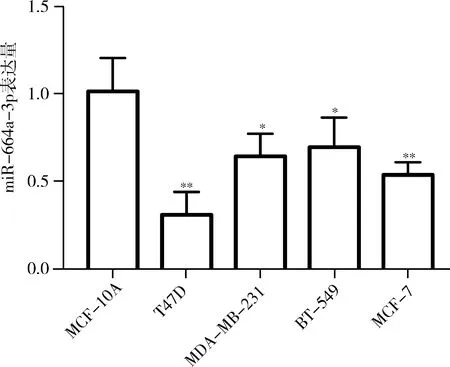
图3 qPCR检测miR-664a-3p在乳腺癌细胞株及正常乳腺上皮细胞的表达量与正常乳腺上皮细胞,*P<0.05,**P<0.01
3.转染miR-664a-3p对T47D细胞miR-664a-3p表达的影响:qPCR结果显示,T47D细胞转染miR-664a-3p后miR-664a-3p表达较对照组明显增加(24.87±2.17 vs 1.02±0.10,t=10.96,P<0.01)。
4.荧光素酶报告基因实验:荧光素酶活性检测结果显示,miR-664a-3p可明显抑制野生型 TEM8-3′ UTR质粒转染细胞的荧光素酶活性(P<0.01),而对突变型TEM8-3′ UTR 质粒转染细胞的荧光素酶活性并无影响(图4)。

图4 荧光素酶报告基因验证miR-664a-3p与TEM8-3′ UTR的靶向结合与“miR-NC+野生型质粒”共转染比较,*P<0.01
5.转染miR-664a-3p对T47D细胞TEM8 mRNA表达的影响:qPCR结果显示,T47D细胞转染miR-664a-3p后TEM8 mRNA表达较对照组明显下调(0.27±0.07 vs 1.00±0.01,t=9.97,P<0.01)。
6.转染miR-664a-3p对T47D细胞TEM8相关蛋白表达的影响:Western blot法检测结果显示, T47D细胞转染miR-664a-3p后TEM8、CDK4、Cyclin D1、Vimentin蛋白表达较对照组显著下调,β-catenin蛋白表达较对照组显著上调(图5)。
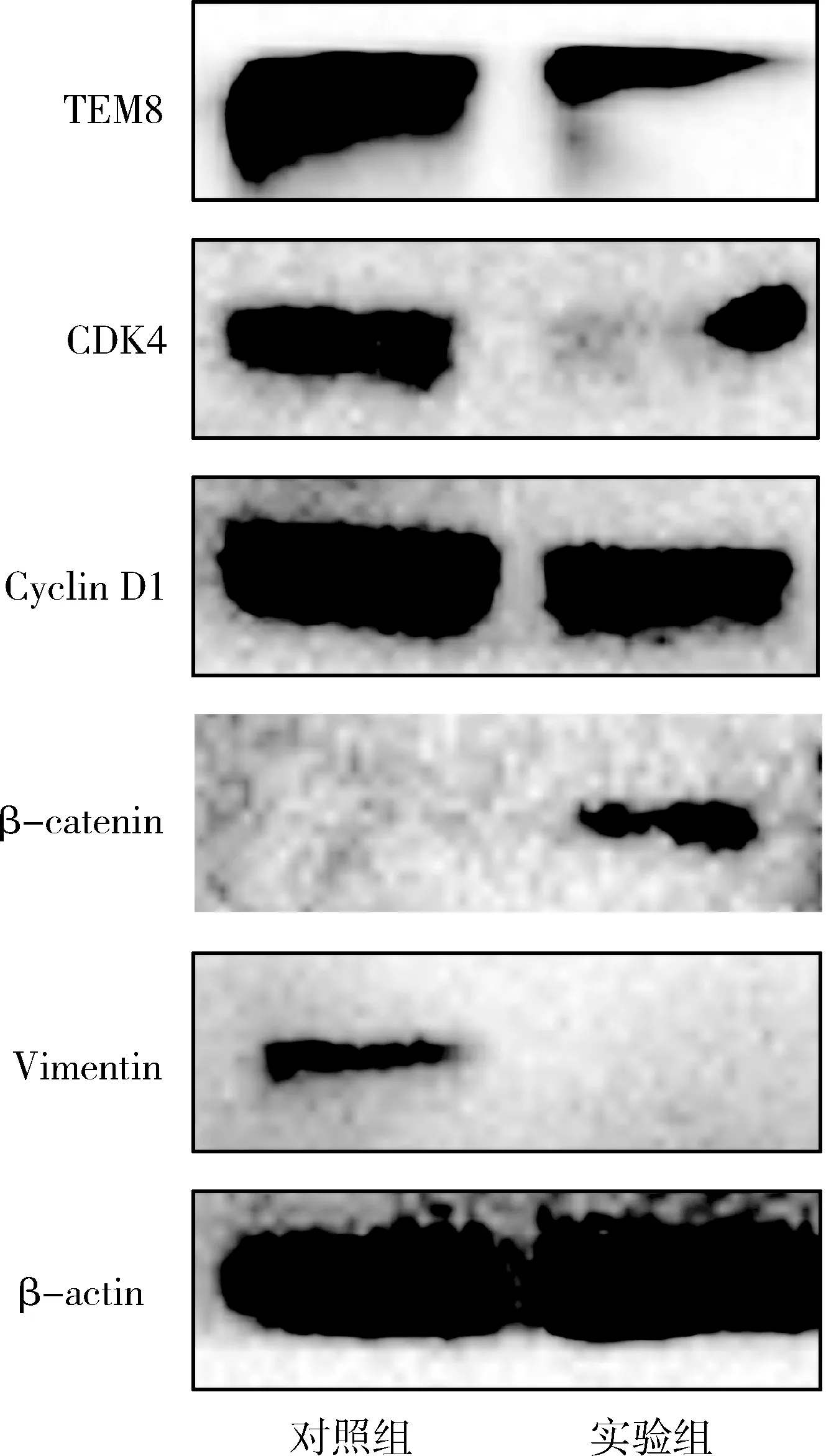
图5 Western blot法检测miR-664a-3p转染T47D细胞后目的蛋白的表达水平
7.转染miR-664a-3p对T47D细胞周期的影响:流式细胞术结果显示,T47D细胞转染miR-664a-3p后在G0/G1期的细胞比例较对照组明显上升,高表达miR-664a-3p可抑制T47D 细胞周期的进展(P<0.01,表2)。
8.转染miR-664a-3p对T47D细胞增殖能力的影响:使用CCK-8连续5天检测T47D细胞的生长,当细胞生长至第4天和第5天,对照组细胞A值显著高于实验组,差异有统计学意义(P<0.01,图6)。
9.转染miR-664a-3p对T47D细胞侵袭能力影响:Transwell实验结果显示,在乳腺癌T47D细胞中高表达miR-664a-3p的细胞穿过小室底膜的细胞数明显低于对照组(96.76±14.54 vs 217.50±17.96,t=5.22,P<0.01)。

表2 miR-664a-3p对乳腺癌细胞周期的影响
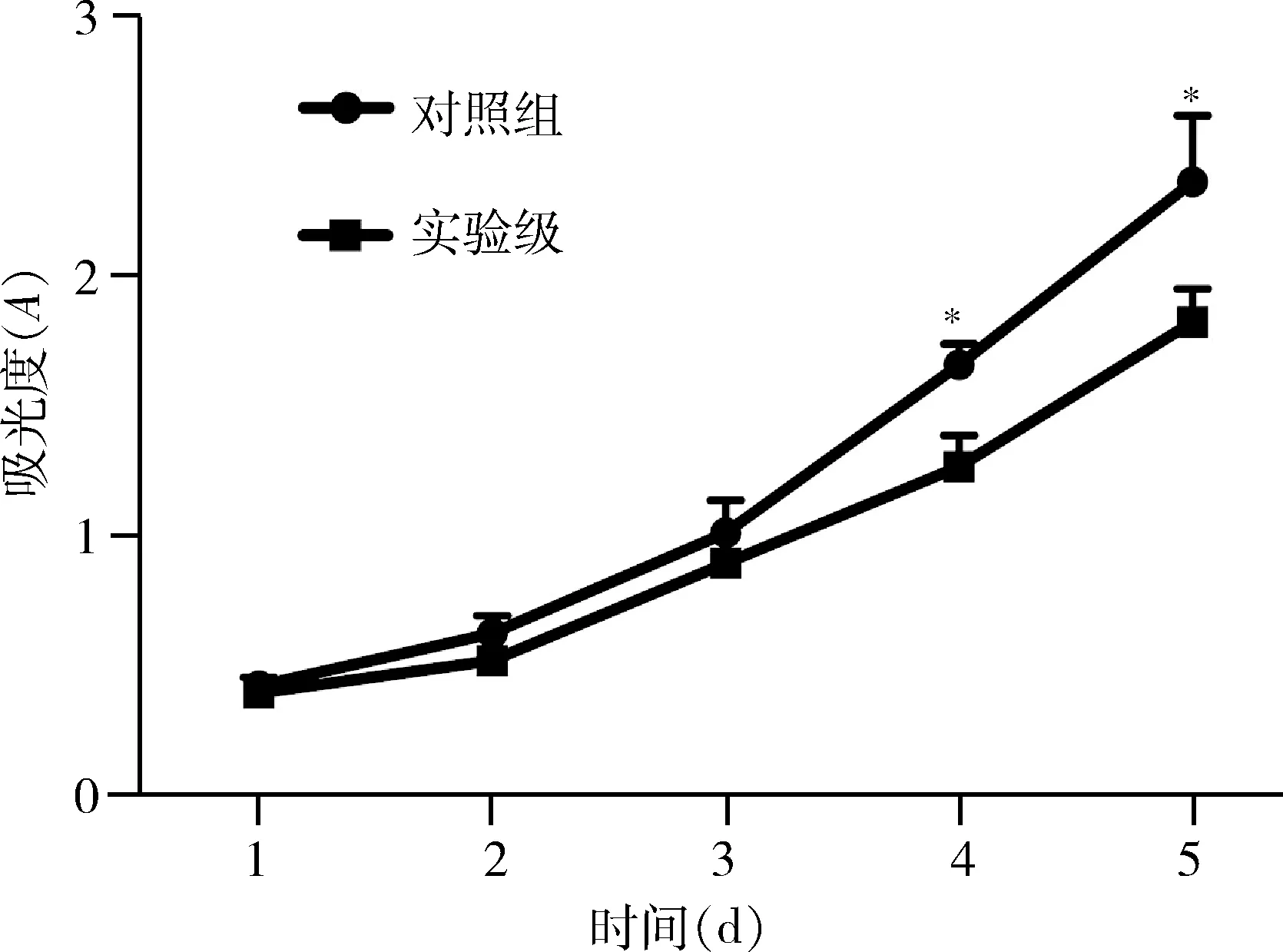
图6 CCK-8 法检测转染miR-664a-3p后不同时点T47D细胞增殖能力的变化与对照组比较,*P<0.01
讨 论
miRNA在转录水平对肿瘤细胞中的抑癌基因或癌基因的表达发挥重要的调节作用[6]。几乎所有的肿瘤中均出现miRNA的异常表达,与肿瘤细胞的恶性生物学行为如增殖、侵袭转移等密切相关[7]。miRNA的异常表达参与乳腺癌的发生和发展。miR-320、miR-770、miR-361-5p等miRNA通过抑制癌基因的表达负向调控乳腺癌细胞的增殖或迁移、侵袭[8~10]。miR-421、miR-1246、miR-27a等miRNA可抑制抑癌基因的表达,促进乳腺癌细胞的增殖、迁移和侵袭[11~13]。miR-664a-3p是miRNA家族的重要一员,可抑制骨肉瘤细胞的迁移和侵袭,然而其在乳腺癌中的作用目前尚不清楚[5]。
本研究结果显示,miR-664a-3p在乳腺癌组织及乳腺癌细胞中低表达,提示miR-664a-3p可能与乳腺癌的发生、进展有一定的关系。生物信息学软件分析显示肿瘤内皮标志物8(TEM8)可能是miR-664a-3p的靶基因。以往的研究表明TEM8在肿瘤血管内皮细胞中高表达,通过促进内皮细胞的迁移进而利于肿瘤血管的生成,在肿瘤血管生成中发挥关键性作用[14]。近年来研究显示,TEM8可促进肿瘤细胞的增殖和侵袭,在越来越多的肿瘤发生、发展中发挥重要作用[15]。有研究表明,TEM8在乳腺癌组织中高表达,其表达水平与患者的预后呈负相关[16]。本研究通过双荧光素酶检测实验进一步验证TEM8是miR-664a-3p的靶基因。本研究结果通过qPCR和Western blot法检测结果发现,过表达miR-664a-3p后TEM8 mRNA和蛋白的表达均明显降低。细胞周期蛋白依赖性激酶4(CDK4)和细胞周期蛋白D1(Cyclin D1)是正向调控细胞周期的重要蛋白。本研究显示TEM8蛋白的下调引起CDK4和Cyclin D1蛋白表达降低。β-链蛋白(β-catenin)和波形蛋白(Vimentin)与肿瘤细胞迁移侵袭能力的变化密切相关,β-catenin蛋白的减少和Vimentin蛋白的增加均是肿瘤细胞迁移侵袭能力增强的表现。本研究显示TEM8蛋白的下调引起β-catenin蛋白表达降低,Vimentin蛋白表达升高。本研究通过转染miR-664a-3p至乳腺癌细胞T47D,发现T47D细胞周期进展明显被抑制,细胞增殖能力和侵袭能力显著降低,提示miR-664a-3p具有显著的抑癌作用。
综上所述,本研究表明miR-664a-3p在乳腺癌组织中处于高表达的状态,通过抑制TEM8基因的表达,抑制细胞增殖能力和侵袭能力,在未来可能具有较好的临床应用价值,并可能成为乳腺癌潜在的肿瘤标志物,用于乳腺癌的临床诊断。

