化学反应在废水处理中的应用
廖宇轩 李远哲 夏雪睿 吴伊琳 唐 骁杨 军 赵 耀
(1.南京师范大学附属中学,南京,210009;2.金陵中学河西分校,南京,210012)
化学在给我们带来丰富的物质和便利生活的同时,也产生了大量的含有毒有害物质的废水。这些废水的随意排放不仅对环境造成了巨大的污染,更会危及人类的健康。因此,如何对含有毒有害成分的废水进行无害化处理甚至资源化利用是实现社会生存和可持续发展的重要前提。
废水处理的主要目的是将废水中所含的有毒有害成分通过分离或转化的方法而去除,从而使水恢复使用功能。根据废水中有毒有害污染组分的理化特性,通过某种化学反应使废水中呈溶解状态的无机物和有机物被氧化或还原为微毒、无毒的无机物的物质,或者转化成容易与水分离的状态(固态或气态),即可达到废水处理的目的。这种采用化学反应转化去除污染组分的方法,称为废水的化学处理方法。
1 化学反应的类型
化学反应是分子破裂成为原子、原子重新排列组合生成新分子的过程,其本质是旧化学键断裂和新化学键生成的过程。
按反应物与生成物,化学反应可分为四类:化合反应、分解反应、置换反应和复分解反应。
如果按元素得失电子的情况,可分为氧化还原反应和非氧化还原反应。置换反应必定是氧化还原反应;复分解反应是离子或离子团的重新组合,反应前后各元素的化合价都没有变化,所以不是氧化还原反应。
在废水处理过程中,化合反应和分解反应的应用较少。由于氧化还原反应 (当然包括置换反应)具有较强的转化能力,能将废水中的污染组分氧化或还原为微毒、无毒的无机物,因此得到了广泛的应用;而复分解反应虽然不是氧化还原反应,但由于生成了难电离物质(如水)或易与水分离的物质(沉淀或挥发性气体),可将废水中的污染物转化去除,因此也得到了广泛的应用。
2 氧化还原反应在废水处理中的应用
氧化还原反应的实质是通过采取不同的方法而实现电子的转移。失去电子的过程称为氧化,失去电子的元素所组成的物质称为还原剂;得到电子的过程称为还原,得到电子的元素所组成的物质称为氧化剂。在氧化还原反应中,氧化剂本身被还原,而还原剂本身被氧化。
2.1 化学氧化法
在废水处理中,实现氧化反应的方法大多是利用氧气(或空气中的氧气)、臭氧、过氧化氢、氯气、高锰酸钾等强氧化性物质使污染组分被氧化成微毒或无毒的无机物,这种方法是纯粹的氧化反应,如利用空气(或富氧空气)焚烧处理高浓度有机废液、通入氯气、臭氧或双氧水对废水中所含的酚、氰化物、有机硫化物以及无机物进行氧化去除。
(1)空气氧化法
空气氧化法就是向废水中鼓入空气,利用空气中的氧气氧化水中的有害物质。
在强碱性(pH=14)溶液中,半反应为:

在中性(pH=7)和强酸性(pH=1)溶液中,半反应式为:

对比式(1)和式(2)可知,降低 pH 值,有利于空气氧化的进行。
在常温常压和中性pH值条件下,分子O2为弱氧化剂,反应性很低,因此常用来处理易氧化的污染物,如 S2-、Fe2+、Mn2+等。 例如,在缺氧的地下水中往往含有溶解性的Fe2+,可通过向水中鼓入空气,将其氧化成Fe(OH)3沉淀物,从而加以去除。其反应式为:
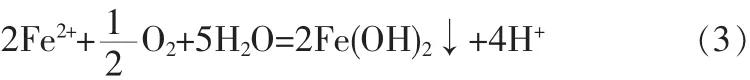
虽然空气氧化能实现某些污染物的去除,但由于常温条件下空气氧化反应的速率较慢,反应过程需要的时间较长,大大限制了其应用。为此,高温空气氧化(即焚烧)得到了快速发展。
焚烧法处理废水是在高温条件下,使有机废液中的可燃组分与空气中的氧进行剧烈的化学反应,将其中的有机物转化为水、二氧化碳等无害物质,同时释放能量,产生固体残渣。
对于高浓度的有机废液,由于其中所含的COD浓度较高,本身具有一定的热焓值,如采用焚烧法进行处理,还可将有机废液的本身所含的热量加以回收利用,达到废物综合利用的目的。同时焚烧处理还具有有机物去除率高(99%以上)、适应性广等特点,所以在发达国家已得到广泛应用。目前国内也越来越重视焚烧方法处理高浓度难降解有机废液,相继建成了技术成熟的焚烧处理装置,用于处理难生化处理、浓度高、毒性大、成分复杂的有机废液。
(2)臭氧氧化
臭氧的分子式是O3,是由3个氧原子组成的氧的一种同素异形体,在常温常压下,较低浓度的臭氧是无色气味的,当浓度达到15%时,臭氧是一种具有鱼腥味的淡紫色气体,具有特殊臭味。在标准状态下,其沸点是-112.5℃,密度为 2.144 kg/m3,是氧气的1.6倍。
臭氧分子中的氧原子具有强烈的亲电子或亲质子性,臭氧分解产生的新生态氧原子也具有很高的氧化活性,因此臭氧是一种极强的氧化剂,在工业废水处理中有着广泛的应用,主要用于炼油废水酚类化合物的去除,电镀含氰废水的氧化,含染料废水的脱色,洗涤剂的氧化以及废水中合成表面活性物质的处理等。除铂、金、铱、氟以外,臭氧几乎可以与元素周期表中的所有元素反应。臭氧可与K、Na反应生成氧化物或过氧化物;臭氧可以将过渡金属元素氧化到较高或最高氧化态,形成更难溶的氧化物。人们常利用此性质把污水中的Fe2+、Mn2+及 Pb、Ag、Cd、Hg、Ni等重金属离子除去。
(3)过氧化氢氧化
过氧化氢的分子式为H2O2,相对分子质量34。其分子是由两个OH所组成的,即结构是H-O-O-H,单分子不是直线形的,气态过氧化氢的每个氧原子连接的H原子位于像半展开的书的两页纸面上,在分子绕着O—O键内旋转时,势垒较低。液态的过氧化氢通过氢键进行缔合的现象比H2O更强。晶体过氧化氢的二面角小于和略大于。纯过氧化氢是一种蓝色的粘稠液体,具有刺鼻臭味和涩味,沸点为152.1℃,冰点为0.89℃,比水重得多(-4.16℃时的密度为1.643 g/cm3)。它的许多物理性质与水相似,可与水以任意比例混合,过氧化氢的极性比水强,在溶液中存在强烈的缔合作用。3%的过氧化氢水溶液在医药上称为双氧水,具有消毒、杀菌作用。
过氧化氢分子中氧的价态是-1,它可以转化成-2价,表现出氧化性,可以转化为0价态,而具有还原性,因此过氧化氢具有氧化还原性。在酸性溶液和碱性溶液中它都是强氧化剂,只有与更强的氧化剂如MnO4-反应时,它才表现出还原性而被氧化。
①过氧化氢的氧化性
在水溶液中,过氧化氢是常用的氧化剂。在用H2O2作为氧化剂的水溶液反应体系中,由于H2O2的还原产物是水,而且过量的H2O2可以通过热分解除去,所以不会在反应体系内引进不必要的物质,去除一些还原性物质时特别有用。
②过氧化氢的还原性
过氧化氢在酸性或碱性溶液中都具有一定还原性。在酸性溶液中,H2O2只能被高锰酸钾、二氧化锰、臭氧、氯等强氧化剂所氧化,在碱性溶液中,H2O2显示出强还原性,除还原一些强氧化剂外,还能还原如氧化银、六氰合铁(III)等一类较弱的氧化剂。H2O2氧化的产物是O2,所以它不会给反应体系带来杂质。
(4)氯氧化
氯氧化法广泛用于废水处理,如处理含氰废水、医院污水、含酚废水等,常用的含氯药剂有液氯、漂白粉、次氯酸钠、二氧化氯等。
①液氯氧化
氯气是一种黄绿色气体,具有刺激性,有毒,质量为空气的2.5倍,密度为3.21 kg/m3(0℃,0.1 MPa),极易被压缩成琥珀色的液氯。
在所有含氯的氧化药剂中,液氯是普遍使用的氧化剂,既可作用消毒剂,也可以氧化污染物。
氯易溶于水,在20℃,0.1 MPa时,其溶解度为7160 mg/L。当氯溶于水中时,可发生水解反应生成次氯酸和盐酸:

生成的次氯酸(HClO)是弱酸,进一步在水中发生解离:

加入的氯和生成的次氯酸根均具有很强的氧化能力,可与水中的氨、氨基酸、含碳物质、亚硝酸盐、铁、锰、硫化氢及氰化物等起氧化作用;同时还是传统的杀菌剂,可用于控制臭味、除藻、除铁、除锰、去色及杀菌等。
液氯与水中的有机物发生反应是以亲电取代反应为主,反应的结果是生成大量的有机氯化物,如三氯甲烷。三氯甲烷是一种致癌物,这就使得液氯在给水处理,特别是饮用水处理中的应用受到限制。
②化合氯氧化
液氯氧化的优点是:经济有效,使用方便。除液氯外,氯氧化的氯源也可采用次氯酸钠溶液、漂白粉等。漂白粉和漂白精等在水溶液中也会生成次氯酸根离子,因此也具有氧化能力。其反应方程式如下:
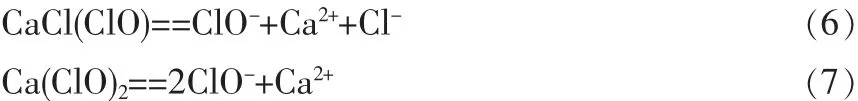
次氯酸钠也是传统的杀菌剂,其氯化作用是通过次氯酸(HClO)起作用,反应式如下:

与液氯相比,次氯酸钠具有价格低廉、使用方便、安全等特点,因而在水处理中有着广泛的使用。
③二氧化氯氧化
二氧化氯的分子式为ClO2,相对分子质量是67.45,熔点是-59℃,沸点11℃。二氧化氯气体呈黄绿色,具有令人不愉快的刺激性气味,与氯气相似,相同浓度时其颜色比氯气略暗。二氧化氯在自然界中几乎完全以游离单体形态存在。气态ClO2的密度是空气的2.4倍。当温度低于10℃时,气态液化成红褐色液体,当温度降到-59℃时,则变成橙黄色固体。
二氧化氯溶于水中后随浓度的提高颜色由黄绿色变为橙红色。其分子中具有19个价电子,有一个未成对的价电子。这个价电子可以在氯原子与两个氧原子之间跳来跳去,因此它本身就像一个游离基,这种特殊的分子结构决定了ClO2具有强氧化性。ClO2在水中会发生下列反应:

氯酸(HClO3)和亚氯酸(HClO2)在酸性较强的溶液里是不稳定的,有很强的氧化性,将进一步分解出氧,最终产物是氯化物。在酸性较强的条件下,二氧化氯会分解生成氯酸,放出氧气,从而氧化、降解废水中的带色基团与其他的有机污染物;在弱酸性的条件下,二氧化氯不易分解污染物,而是直接和废水中的污染物发生作用并破坏有机物的结构。
二氧化氯的氧化能力比氯要强,从理论上讲是氯的2.5倍。它与有机物作用时,发生的是氧化还原反应而不是取代反应。反应的结果可把高分子有机物降解为有机酸、水和二氧化碳,二氧化氯则被还原成氯离子,几乎不形成三氯甲烷等致癌物质,这是与氯氧化法相比最突出的优点。
(5)高锰酸钾氧化
高锰酸钾的分子式为KMnO4,俗称灰锰氧、PP粉,是一种有结晶光泽的紫黑色固体,易溶于水,在水溶液中呈现出特有的紫红色。高锰酸钾的热稳定性差,加热到476 K以上就会分解放出氧气:
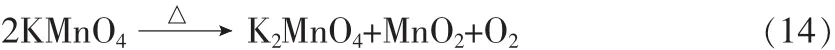
KMnO4中Mn的价态是+7价,是锰的最高氧化态,因此高锰酸钾是一种氧化剂,还原产物可以是 MnO42-、MnO2或 Mn2+,介质的酸、碱性影响MnO4-的还原反应产物。在酸性介质中KMnO4是强氧化剂,它可氧化 Cl-、I-、Fe2+、SO32-,还原产物为Mn2+,溶液呈淡紫色,如果MnO4-过量,它可能和反应生成的Mn2+进一步反应,析出MnO2;在中性、微酸性或微碱性介质中,高锰酸钾氧化性减弱,与一些还原剂反应,产物为MnO2,是棕黑色沉淀;在碱性介质中,MnO4-的氧化性最弱,但仍可以用作氧化剂,还原产物是MnO42-,溶液呈绿色。
高锰酸钾在酸性溶液中具有强氧化性,在中性水溶液中的氧化性要比在酸性水溶液中弱,但对中性天然水体中的微污染物,无论是低相对分子质量、低沸点有机污染物,还是高相对分子质量、高沸点有机污染物的氧化去除效果均很好,明显优于酸性和碱性条件下的效果,有机污染物种类中的50%以上在中性条件下经高锰酸钾氧化后被全部去除,剩余的有机污染物浓度也很低。在酸性和碱性条件下,高锰酸钾对低相对分子质量、低沸点有机污染物有良好的去除效果,但对高相对分子质量、高沸点有机污染物的去除效果很差,有些有机污染物浓度反而高于原水,最高者增高达数倍。
高锰酸钾在中性条件下的最大特点是反应生成二氧化锰,由于二氧化锰在水中的溶解度很低,会以水合二氧化锰胶体的形式由水中析出。正是由于水合二氧化锰胶体的作用,使高锰酸钾在中性条件下具有很高的除微污染物的效能,能与水中的 Fe2+、Mn2+、S2-、CN-、酚及其他致臭味有机物很好地反应,选择适当投量,它能杀死很多藻类和微生物。
在废水处理中,高锰酸钾主要用于去除水中所含的H2S和氰离子。在稀的中性水溶液中,高锰酸钾氧化硫化氢的化学计量关系式为:
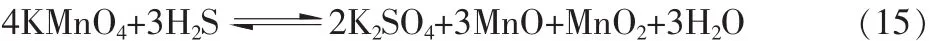
与氰离子的反应为:
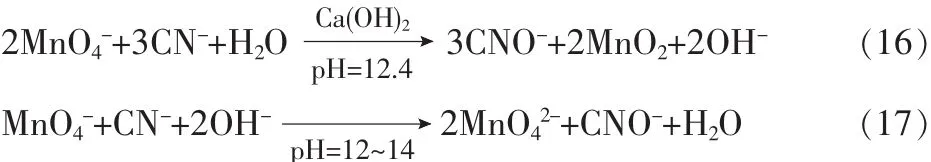
高锰酸盐对无机物的氧化速率比对一般有机物的氧化快得多,铜离子对氧化反应有明显的催化作用。
2.2 化学还原法
化学还原法是通过投加药剂 (如铁粉等),利用药剂的还原性将废水中的有毒物质转化为无毒或毒性较小的物质的方法。常用的还原剂有金属还原剂(如铁屑、锌粉等)、盐类还原剂(如硼氢化钠、亚硫酸钠、亚硫酸氢钠、硫酸亚铁、氯化亚铁等)和气体还原剂(如含硫化氢废气、含二氧化硫废气等),相应的方法称为金属还原法、盐类还原法和尾气还原法。
(1)金属还原法
金属还原法是以固体金属为还原剂,用于还原废水中的污染物,特别是汞、铬、镉等重金属离子。常用的金属还原剂有铁、锌、铜、镁等,其中铁、锌因其价格便宜而作为首选的药剂。
采用金属还原法,主要是利用金属的还原性,将废水中的重金属离子还原为单质而置换出来,因此,金属还原法也称金属置换法。置换出来的重金属可回收利用。
(2)盐类还原法
盐类还原法是利用一些化学药剂作为还原剂,将有毒物质转化为无毒或低毒物质,并进一步将其除去,使废水得到净化。
在生产实践中,采用盐类还原法处理Cr6+时,一般常选用硫酸亚铁作为还原剂和石灰作为碱性药剂,这是因为其价廉易得,经济实用,但石灰中杂质含量较多,产生的泥渣也多。当水量小时,也可采用氢氧化钠和亚硫酸氢钠,其价格较贵,但泥渣量少。如果有二氧化硫和硫化氢废气时,也可以利用尾气还原法,其特点是以废治废,费用低,设备也简单。
3 复分解反应在废水处理中的应用
复分解反应的本质是使溶解的离子结合成难电解的物质(如水)、难溶解的物质(沉淀)或挥发性气体,从而实现废水的无害化处理。在废水处理中,复分解反应的应用主要包括;对酸、碱性废液通过加碱或酸而进行的中和反应;通过投加某种易溶的药剂而与废水中的某些溶解物质反应生成难溶固体物的沉淀反应。
3.1 中和反应
在各工业行业中,因为要大量使用酸或碱,所以酸性废水和碱性废水的排放十分普遍,尤其以酸性废水更为普遍。酸性废水中常含有硫酸、硝酸、盐酸、氢氟酸等无机酸和乙酸、甲酸、柠檬酸等有机酸,pH值在1~2,含酸量可高达5%~10%;碱性废水中常含有苛性钠、碳酸钠、硫化钠、胺类等。无论从数量还是危害程度上,酸性废水的处理都要比碱性废水更为重要。
当废水中存在游离酸或碱时,可利用添加碱或酸使酸和碱相互进行中和反应生成盐和水,这种利用中和过程处理废水的方法称为中和法。中和处理的目的就是中和废水中过量的酸和碱,以及调整废水的酸碱度,使中和后的废水呈中性或接近中性,以适应下一步处理和外排的要求。
(1)酸性废水的中和处理
酸性废水的中和处理主要有三种方法:用碱性废水或碱性废渣中和、投药中和及过滤中和。
①用碱性废水或碱性废渣中和
当有条件应用碱性废水或碱性废渣进行中和处理时应优先考虑以废治废,既可节省处理费用和药剂消耗,又简便实用。但由于酸性废水的数量和危害比碱性废水大得多,因此处理后的水应呈中性或弱碱性。
当酸性废水、碱性废水相互中和仍达不到处理要求时,可再采用投药中和进行处理。
②投药中和
顾名思义,投药中和就是采用投加药剂的方法进行废水中和处理。投药中和可以处理任何浓度、任何性质的酸性废水,中和过程容易调节,容许水量变化范围较大,是应用最为广泛的一种中和方法。
采用投药中和法时,中和药剂的选择,不仅要考虑药剂本身的溶解性、反应速率、成本、二次污染、使用方法等因素,而且还要考虑中和产物的性质。用于酸性废水的中和药剂有石灰(CaO)、石灰石(CaCO3)、碳酸钠(Na2CO3)、苛性钠等(NaOH),也可利用其他工业部门排出的废渣(主要成分为碳酸钠、苛性钠)等,因地制宜地中和处理酸性废水。
③过滤中和
过滤中和过程就是使酸性废水流过石灰石(CaCO3)、白云石(MgCO3·CaCO3)、大理石(CaCO3)等碱性滤料时得到中的方法,一般适用于含酸量不大于23 g/L、生成易溶盐的各种酸性废水的中和处理。
(2)碱性废水的中和处理
对于碱性废水,最经济的方式是能直接利用酸性废水或废酸液进行中和。如果没有酸性废水或废酸液可以利用时,一般可采用商品酸中和或废酸气中和。
商品酸处理碱性废水大多采用无机酸。硫酸因其价格低廉,因此应用较广;盐酸的优点是反应产物溶解度大,泥渣少,但出水中的溶解固体物浓度高,在对溶解固体有严格要求时不宜采用。
烟道气中含有14%~24%的二氧化碳,因此可用于进行碱性废水的中和处理。将烟道气通入碱性废水中,烟道气中所含的二氧化碳就会形成碳酸,并与废水中的碱性物质发生反应,从而实现对碱的中和处理。
3.2 沉淀反应
化学沉淀法是向水中投加某种易溶的化学药剂,使之与废水中的某些溶解物质发生化学反应,形成难溶的固体物(沉淀物,如盐、氢氧化物或络合物),然后进行固液分离,从而除去水中污染物的一种化学方法。采用化学沉淀法可以处理废水中的重金属离子(如汞、铬、镉、铅、锌等)、碱土金属(如钙、镁等)和非金属(如砷、氟、硫、硼等)。对于危害性很大的重金属废水,化学沉淀法是常采用的一种方法。
废水处理中常用的化学沉淀法按其所用沉淀剂的不同,可分为氢氧化物沉淀法、硫化物沉淀法、碳酸盐沉淀法等,最常用的沉淀剂是石灰,其他如氢氧化钠、碳酸钠、硫化氢、碳酸钡等也有应用。
(1)氢氧化物沉淀法
水中的金属离子很容易生成各种氢氧化物,这些金属的氢氧化物都是难溶于水的,尤其重金属离子铜、铬、镉、铅等的氢氧化物,它们在水中的溶解度和溶度积都很小,因此可以采用氢氧化物沉淀法除去。
(2)硫化物沉淀法
许多金属硫化物在水中的溶解度和溶度积都很小,因此工业上常采用硫化物从废水中除去金属离子。溶度积越小的物质,越容易生成硫化物沉淀析出。
采用硫化物沉淀法处理含 Hg2+、Cu2+、Cd2+、Zn2+、Pb2+等重金属离子的废水具有去除率高、可分步沉淀、泥渣中的金属品位高,便于回收利用、适用pH值范围大等优点,因此在生产上均得到了应用。
(3)碳酸盐沉淀法
碳酸盐沉淀法是通过向水体中加入某种沉淀剂,使其与水中的金属离子生成碳酸盐沉淀,从而将废水净化。
(4)钡盐沉淀法
钡盐沉淀法仅限于含Cr6+废水的处理,采用的沉淀剂有 BaCO3、BaCl2、BaS 等, 生成铬酸钡(BaCrO4)沉淀。为了促进沉淀,沉淀剂常投加过量,但出水中含过量的钡,一般通过一个以石膏碎块为滤料的过滤池,使石膏中的钙离子置换水中的钡离子而生硫酸钡沉淀。
(5)卤化物沉淀法
卤化物沉淀法是通过向废水中投加易溶解的卤化物,使其与水中的金属离子反应生成难溶的卤化物沉淀而去除污染物的方法。根据产生的沉淀的种类,卤化物沉淀法可分为氯化银沉淀法和氟化物沉淀法。
4 结束语
随着水污染的加剧,对废水实现深度处理后达标排放或回用不仅能取得明显的节水效果和经济效益,并且具有重要的环境意义和社会意义。
本文分别对氧化还原反应和复分解反应在废水处理中的应用进行了介绍,以期为废水化学处理方法的选择提供指导。然而,由于废水中所含污染组分不同、各种化学反应的发生条件也各异,因此必须具体情况具体分析,以取得满意的处理效果。

