HPLC法测定大鼠血浆华法林及红参对华法林抗凝作用的影响
张 瑜1 郑 宓1 张 宽1 陈 明1 鄢 琳1 叶 华1 李 雪 赖文婷
1.福建中医药大学附属第二人民医院药学部,福建 福州 350003;2.福建中医药大学药学院,福建 福州 350001
华法林(warfarin)是口服香豆素类抗凝药,广泛应用于机械瓣膜置换术、血栓栓塞性疾病、心房颤动[1]。但华法林在临床使用过程中存在治疗窗窄及药物相互作用复杂的问题,使其临床疗效和不良反应个体差异大,剂量难以掌握,一定程度上限制了其临床应用。目前,国内的现状为阿司匹林应用较普及,而华法林的应用率较低,仅为2.5%~3%[2]。据报道[3],约40%的心血管疾病和脑卒中患者均合并使用中药。由于中药通常含有多种药理活性成分,与成分单一的西药相比,中药与华法林产生药物相互作用的可能性更高。近年来,中药对华法林抗凝作用的影响也越来越受到临床的重视。其中人参、西洋参与华法林的相互作用的研究较多[4]。红参是人参的栽培品经蒸制后的干燥根和根茎。但国内外文献均未见红参与华法林相互作用实验研究的相关报道。笔者旨在通过建立高效液相色谱法(High Performance Liquid Chromatography,HPLC)测定大鼠血浆华法林的血药浓度并初步探讨红参与华法林是否存在药物相互作用,为临床合理用药提供参考依据。
1 仪器与材料
1.1 仪器 高效液相色谱仪(赛默飞世尔科技(中国)有限公司);PDA-100 Photodiode Array;AcclaimTM120 C18(250×4.6 mm,5 μm)色谱柱;XY系列精密电子天平(常州市幸运电子设备有限公司);HC-2062高速离心机(安徽中科中佳科学仪器有限公司);CS-2000i全自动凝血分析仪 (希森美康医用电子(上海)有限公司)。
1.2 药品与试剂 红参配方颗粒(批号:17003221,北京康仁药业有限公司);华法林钠片(规格:3 mg/片;批号:1680414;Orion Corporation Orion Pharma);华法林钠标准品(批号:113062,LGC Labor GmbH.Bgm-Germany);乙腈 HPLC级别 (批号:20170314,国药集团化学试剂有限公司);甲醇 HPLC级别(批号:021150601,上海星可高纯溶剂有限公司);冰乙酸(批号:K1315019,Aladdin Industrial);肝素钠注射液(批号:151712098A,常州千红生化制药股份有限公司);3.2%枸橼酸钠抗凝剂(批号:0328A18,上海铭博生物科技有限公司);全自动血液凝固分析装置清洗液[批号:A7118,希森美康医用电子(上海)有限公司];凝血酶试剂[批号:562801,希森美康医用电子(上海)有限公司];凝血质控血浆水平(批号:548029A,Dade Ci-Trol);水为自制纯化水。
1.3 实验动物 实验动物SD大鼠,雄性,体重(250±20)g(福建省福建医科大学动物实验中心提供,SPF级,许可证:SCXK(闽)2012-0001)。
2 方法
2.1 溶液的配制
2.1.1 华法林标准液 精密称取华法林钠标准品10.07 mg置于10 mL容量瓶内,加入甲醇超声溶解后定容,即得1.007 mg/mL的华法林贮备液。精密吸取华法林贮备液1 mL置于100 mL容量瓶内,加甲醇定容,即得10.07 μg/mL的华法林标准溶液。均置于2~8 ℃冰箱中保存待用。
2.1.2 华法林溶液配制 华法林钠3片(3 mg/片)置于研钵研磨成细粉,溶于300 mL水超声溶解时即得浓度为0.030 mg/mL的华法林溶液。
2.1.3 红参水溶液配制 称取红参颗粒5.4 g,加纯化水300 mL,超声溶解,配制成0.018 g/mL红参水溶液(1 g红参颗粒相当于5 g红参饮片)。
2.2 动物实验
2.2.1 动物分组及给药方法 雄性SD大鼠35只,体重(220±20)g,适应性喂养3 d,随机分为五组,每组7只大鼠,分别为:A组(空白组)、B组(红参组)、C组(华法林组)、D组(红参同服组)、E组(红参预服组)。其中A组灌胃蒸馏水;B组灌胃红参颗粒水溶液(0.18 g/kg);C组灌胃华法林溶液(0.3 mg/kg);D组先给予华法林溶液灌胃(0.3 mg/kg),给药1 h后,再灌胃红参颗粒水溶液(0.18 g/kg);E组先预服红参7 d,后华法林和红参给药方法同D组。上述5组大鼠药物连续灌胃给药14 d。
2.2.2 血浆样品的采集与处理 测定凝血酶原时间(Plasma prothrombin time,PT)血浆样本:A组、B组、C组、D组和E组5组大鼠分别于华法林灌胃前(D0)和给药后的D1、D4 、D7、D10、D14 采血点,经大鼠眼眶采血0.9 mL置于含有3.2%枸橼酸钠抗凝剂0.1 mL的抗凝管中,血液与抗凝剂的比例为9∶1(V∶V),充分混匀,立即离心力1500 g,离心15 min,分离血浆,室温保存,24 h内待测。每次采血时间均为华法林给药后3 h。
测定华法林血药浓度血浆样本:C、D、E组大鼠于华法林灌胃给药后的D1、D4 、D7、D10、D14采血点,经大鼠眼眶采血1mL置于肝素钠化EP管中,充分混匀,立即离心力1500 g,离心15 min,分离血浆,保存待测。每次采血时间均为华法林给药后3 h。
2.3 指标测定
2.3.1 凝血酶原时间(PT)及国际标准化比值(INR)的测定 将经3.2%枸橼酸钠抗凝的血浆适量放入测试通道,采用凝血酶原时间测定试剂,通过全自动血凝分析仪自动检测血浆标本PT及INR值,并记录实验结果。
2.3.2 华法林血药浓度的测定 精密吸取肝素抗凝的血浆100 μL,加入乙腈300 μL,涡旋1 min,10000 rpm/min离心15 min,取上清液,进样20 μL。记录色谱图,以外标法进行峰面积定量。
2.4 色谱条件的建立 色谱柱:AcclaimTM120C18(250 mm×4.6 mm,5 μm);柱温:25℃;流动相:乙腈-乙酸水(1%)(70∶30)等度洗脱;流速:1 mL/min;检测波长:308 nm;进样量:20 μL。结果如图1所示。
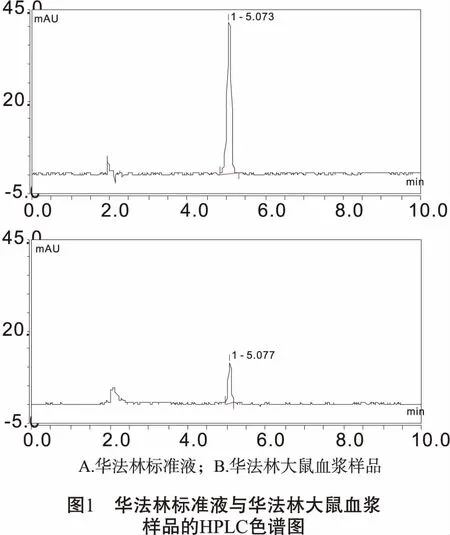

3 结果
3.1 HPLC方法的专属性 取空白大鼠血浆180 μL,加入100.7 μg/mL华法林标准液20 μL配成的含华法林10.07 μg/mL血浆样品200 μL作为阳性对照血浆。分别取空白大鼠血浆、阳性对照血浆、华法林大鼠血浆、红参大鼠血浆、华法林+红参大鼠血浆各100 μL,按2.3.2项下的预处理进行操作,得色谱图(如图2所示)。红参与血浆内源性成分对华法林出峰无干扰,且华法林峰形良好。

3.2 标准曲线的制备 取空白大鼠血浆5份,配制成200 μL华法林终浓度为50.35 μg/mL、10.07 μg/mL、7.552 μg/mL、5.035 μg/mL、2.518 μg/mL、1.007 μg/mL的标准血浆样品,按2.3.2项下的预处理进行操作,每种浓度平行操作5次,记录色谱图华法林峰面积。以华法林色谱峰的峰面积均值为纵坐标y,标准血浆样品的浓度为横坐标x,进行线性回归,绘制标准曲线。如图3所示,得到回归直线方程为y=0.1056x+0.0254,相关系数R=0.9996。结果说明:华法林血浆浓度在1.007~50.35 μg/mL范围内与峰面积呈良好的线性关系。
3.3 最低检测限 配制华法林终浓度为0.1007 μg/mL、0.504 μg/mL、1.007 μg/mL的血浆,按2.3.2项下的预处理进行操作,取上清,进样20 μL。以信噪比为3确定出华法林的最低检出浓度为0.504 μg/mL。

3.4 精密度和准确度考察 配制华法林终浓度为2.518 μg/mL、10.07 μg/mL、50.35 μg/mL的低、中、高浓度的血浆样品分别于同1d内分5次以及连续5 d,每日1次,按2.3.2项下的预处理操作后,进样20 μL,记录色谱峰面积,计算日内精密度、日间精密度以及提取回收率、方法回收率,结果见表1、2。由表1可得该方法测得的血浆中华法林日内和日间精密度的RSD均小于10%,表明该法对含量的重现性和重复性均良好。从表2中得到低、中、高3种浓度的华法林血浆样品提取回收率均值为91.75%、95.29%、85.17%,方法回收率均值分别为97.44%、109.3%、99.77%。参照生物样品分析时的回收率一般要求在85%~115%(样品药浓度≥ 200 μg/L),RSD小于10%的标准,本实验符合生物样品加样回收率的要求。
3.5 稳定性考察 配制成终浓度为低(2.518 μg/mL)、中(10.07 μg/mL)、高(50.35 μg/mL)3种华法林血浆样品,每种浓度平行配制5份。在室温下放置24 h、24 h反复冻融3次后、冷冻(-20℃)半个月,按2.3.2项下的预处理操作后,进样20 μL,记录色谱,结果见表3。从表3可看出,华法林血浆在未经预处理的状态下,室温24 h、24 h反复冻融3次以及冷冻(-20℃)半月后的RSD均在10%以内,可见华法林血浆样品的室温稳定性、冻融稳定性、长期稳定性的测定结果变化均在允许范围内,保证了样品测定结果的可靠性。
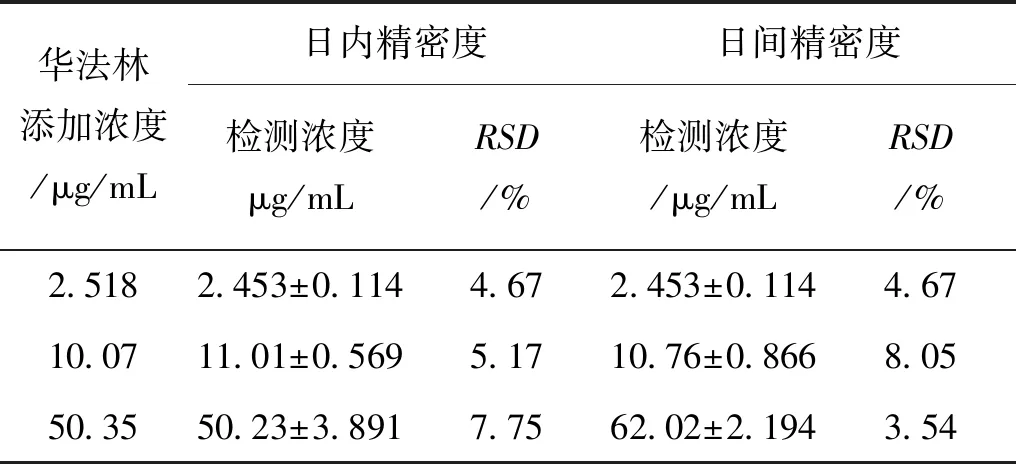
表1 华法林血浆浓度的精密度实验

表2 低、中、高浓度华法林血浆的回收率 (n=5)

表3 低、中、高浓度华法林血浆的稳定性
3.6 红参对大鼠体内华法林抗凝作用的影响 运用全自动凝血分析仪分别测定A、B、C、D、E组大鼠在不同时间点的PT值变化,并根据PT值计算INR结果(见表4和图4)。从表4可以看出,与A组相比,B组对PT没有影响。与C组比较,D组和E组PT值均有不同程度的延长,其中E组在D7和D10时PT值延长具有显著性差异。同样,在INR的变化上,与C组比较,E组在D7和D10呈明显的增高趋势,差异具有统计学意义(P<0.05)。但C、D、E组在D14时,PT和INR未呈现明显的差别。
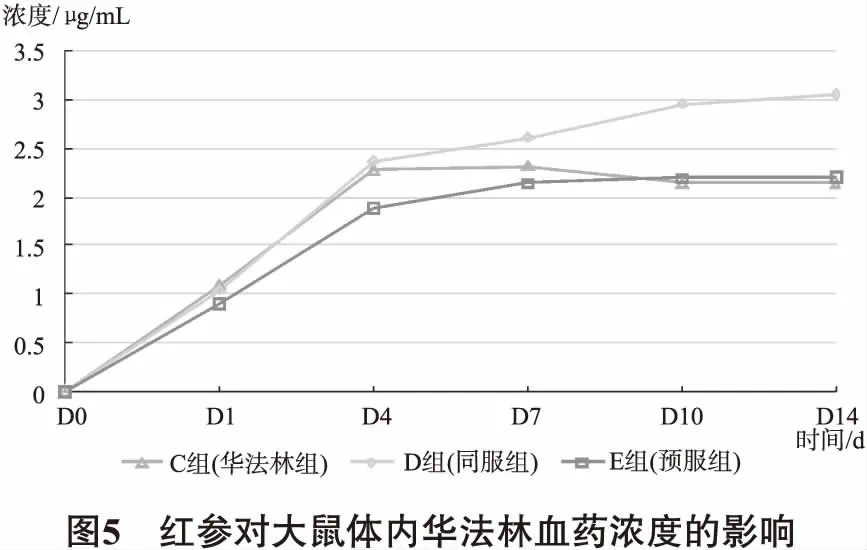
3.7 红参对大鼠体内华法林血药浓度的影响 红参对华法林多次给药大鼠稳态血药浓度的影响。从图5可以看出,在给药后,E组华法林的血药浓度较C组的差异均无统计学意义(P>0.05)。D组华法林的血药浓度较C组有升高的趋势,但亦未达到具有统计学意义的差异(P>0.05)。


PT值(s)D0D1D4D7D10D14A组(空白组)8.09±0.168.31±0.388.07±0.238.10±0.218.07±0.218.20±0.17B组(红参组)8.03±0.228.34±0.238.03±0.148.13±0.288.26±0.198.08±0.17C组(华法林组)8.10±1.018.83±0.2518.37±2.4717.69±4.0918.44±3.4719.31±6.43D组(同服组)8.01±1.009.3±0.5919.43±2.6419.33±2.5721.84±6.2320.57±4.75E组(预服组)7.98±0.078.96±0.1821.81±4.0022.89±4.11∗26.04±8.26∗21.60±4.54
注:与C组(华法林组)比较,*P<0.05。

4 讨论
笔者首探讨并建立了在联用红参和华法林的大鼠血浆中测定华法林含量的HPLC法,该法操作简单,专属性、精密度、重现性和重复性、回收率、稳定性均达到标准,可作为红参与华法林药物相互作用的研究中测定华法林血药浓度的可靠方法。
从红参对华法林药效学影响结果看出:红参单药对PT值无明显影响,表明红参单药对凝血无明显影响。与华法林组比较,预服组大鼠PT和INR值在给药的第7天和第10天显著延长,而同服组PT和INR也有延长的趋势,但未具有统计学差异。实验第14天时,红参同服组和红参预服组与华法林组PT、INR值未再显示明显的差别。验结果提示红参与华法林联合用药后可产生药效学的协同作用,增强华法林的抗凝作用。本研究结果与既往人参和西洋参抑制华法林的抗凝作用的结果不同[5-6],可能是由于红参经过炮制加工后,其所含有效成分与人参或西洋参不同有关。
从血药浓度结果看,红参同服组和预服组华法林血药浓度有升高的趋势但未达到统计学差异。而其PT和INR值却有显著性差异。华法林为S型和R型两种光学异构体组成的消旋体混合物[7]。S-华法林主要经CYP2C9代谢,R-华法林主要经CYP1A2和CYP3A4代谢,且S-华法林的药理作用约为R-华法林作用的3-5倍。由于本研究未对华法林对映异构体浓度进行检测,结合实验结果初步推测,红参可能对S-华法林的影响强于R-华法林,导致虽然华法林总体浓度变化不明显,但仍然可以引起药效学有意义的改变。
笔者观察了红参对华法林稳态血药浓度及抗凝作用的影响,提示红参可能增强华法林的抗凝作用。在临床实践中,应提醒临床对于正在服用红参的患者,在初始处方华法林时应注意剂量调整,适当减少华法林的剂量,并在用药的前2周加强监测INR,以减少红参与华法林两药联合应用可能导致的出血风险。由于笔者未对华法林对映异构体浓度进行检测,红参是否是通过影响CYP2C9的活性而影响S-华法林浓度进而增强华法林抗凝作用值得进一步的探索。在今后的研究中,将可进一步观察红参对S-华法林血药浓度以及对肝药酶CYP2C9的影响,探讨红参与华法林相互作用的机制。

