高温热处理对大豆蛋白消化利用效果的影响
王雅卉,邢霁云,徐婧婷,郭顺堂*
(中国农业大学食品科学与营养工程学院,植物蛋白与谷物加工北京市重点实验室,北京 100083)
大豆蛋白是优质蛋白[1],是广泛用于婴儿配方食品等特殊膳食的配料[2-3]。热处理是婴儿食品加工过程中一种必要的单元操作,工业化生产中常采用120 ℃以上的高温杀菌或降低植物蛋白中胰蛋白酶抑制剂等抗营养因子活性。同时,热处理能破坏蛋白分子紧密的四级结构,显著提高蛋白质的消化性[4-5]。然而,有研究发现,某些高温热处理或不当热处理会降低豆类蛋白的营养有效性[6-10]。例如,将菜豆的7S蛋白和蚕豆的11S蛋白在120 ℃条件下热处理20 min后,置于大鼠小肠内酶解1 h,结果发现,菜豆的7S蛋白可以产生分子质量约23.7 kDa的不可消化聚合物,蚕豆的11S蛋白则产生分子质量约为20 kDa的疏水性不可消化聚合物[6-8]。可见,与一般热处理不同,高温热处理引起了酶解产物的聚合,从而有可能降低了豆类蛋白的营养有效性。然而,目前尚不明确高温热处理是否也改变了大豆蛋白的营养有效性。为此,本研究分析热处理后大豆蛋白的氨基酸组成变化,评价热处理后大豆蛋白中必需氨基酸的营养平衡情况,探讨热处理对大豆蛋白体外模拟消化物组分及分子质量分布的影响,以期阐明高温热处理对大豆蛋白消化利用的效果,为大豆蛋白特殊膳食食品加工的热处理控制提供参考。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粕 山松生物制品有限公司。
胃蛋白酶(P7000)、胰酶(P1750)、β-巯基乙醇、醋酸铀染液、丙烯酰胺、甲叉丙烯酰胺、脲、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、过硫酸铵、甘油、考马斯亮蓝G-250、牛血清白蛋白、Tris Base、乙腈、三氟乙酸(trifluoroacetic acid,TFA)均为国产分析纯。
1.2 仪器与设备
1100高效液相色谱(high performance liquid chromatography,HPLC)系统、ZORBAX SB-C18色谱柱(分析柱) 美国Agilent公司;Protein Pak 60凝胶柱 美国Waters公司;DYY-6D稳压稳流定时电泳仪 北京六一仪器厂;Spectrum SP-2100UV紫外-可见分光光度计上海光谱仪器有限公司。
1.3 方法
1.3.1 SPI的制备
将脱脂豆粕与水以液料比1∶15混合后,调节pH值为8.0,室温搅拌90 min,两层纱布过滤除去其中的不溶性杂质后,接着1 000×g离心10 min得到滤液,将滤液用酸调整pH值至4.5,置于室温静置30 min。将滤液1 000×g离心5 min,去除上清液,沉淀即为大豆分离蛋白(soy protein isolate,SPI);将沉淀取出,加水复溶,不断调整pH值至7.0,待完全溶解后,用液氮速冻后干燥,留样备用[11-12],样品中的蛋白质量分数约为92%。
取冷冻干燥后的SPI配制成质量分数2%的SPI溶液,分别在100、120、140、160 ℃条件下油浴加热20 min后,相应记为SPI-100、SPI-120、SPI-140、SPI-160,冷冻干燥备用。
1.3.2 大豆蛋白氨基酸组成分析
采用氨基酸自动分析仪,分别对SPI-100、SPI-120、SPI-140、SPI-160样品的氨基酸组成进行分析。
1.3.3 大豆蛋白氨基酸营养性评价
根据1.3.2节分析得到的SPI-100、SPI-120、SPI-140、SPI-160氨基酸组成,分别用氨基酸评分(amino acid score,AAS)、化学评分(chemical score,CS)、必需氨基酸指数(essential amino acid index,EAAI)、氨基酸比值系数分(score of ratio coefficient of amino acid,SRCAA)、必需氨基酸相对比值(essential amino acid relative ratio,EAARR)对不同加热后的大豆蛋白氨基酸模式进行营养性评价。
AAS:用于评价待测蛋白质中某一必需氨基酸与参考蛋白模式中相应必需氨基酸含量的接近程度[13]。如公式(1)所示计算。

其中,必需氨基酸中AAS数值最低者定义为AASmin,其AASmin就是该种蛋白质的AAS值。
CS:评价待测蛋白质中某一必需氨基酸的相对含量(其含量与必需氨基酸总量之比)与参考蛋白模式中相应必需氨基酸相对含量的接近程度(世界卫生组织(World Health Organization,WHO)/国际食品法典委员(Codex Alimentarius Commission,CAC))[14],如公式(2)所示计算。

其中,必需氨基酸中CS数值最低者定义为CSmin,其CSmin就是该种蛋白质的CS值。
EAAI:评价待测蛋白质中所有必需氨基酸含量与参考蛋白模式中所有必需氨基酸含量比值的几何平均数(以100 分计)[15]。如公式(3)所示计算。

式中:p为食物蛋白;s为参考蛋白;n为比较的必需氨基酸个数。
SRCAA:评价待测蛋白质的必需氨基酸与参考蛋白模式中相应必需氨基酸的接近程度[16]。先计算出各个氨基酸的比值(AAS),再算出各氨基酸比值的平均数。在此基础上计算氨基酸比值系数(ratio coefficient of amino acid,RCAA)及SRCAA。具体公式如式(4)~(5)所示。

式中:CV为RCAA的变异系数,CV=标准差/平均数。
EAARR:评价标准值与各种必需氨基酸比值距离标准差的平均值之差[17]。如公式(6)所示计算。
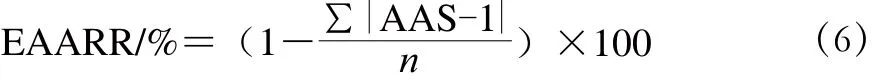
式中:n为待测蛋白质中必需氨基酸的个数。
1.3.4 婴儿体外消化模型的建立
根据Marambe等[18]的方法,并略作改动。用pH 4的0.2%(质量分数,下同)NaCl溶液配制成2.5%的胃蛋白酶溶液(胃液模拟溶液);用pH 7的0.68% KH2PO4和0.062% NaOH混合溶液配制成0.5%胰酶溶液(肠液模拟溶液)。将SPI-100、SPI-120、SPI-140、SPI-160样品的pH值调至4.0,在37 ℃水浴中平衡10 min后,按m(酶)∶m(底物)=1∶5的比例加入胃蛋白酶溶液,在37 ℃条件下分别消化0、1、10、30 min,再将各样品的pH值调至7.0,在37 ℃水浴中平衡10 min,按m(酶)∶m(底物)=1∶40加入胰酶溶液,在37 ℃条件下消化30、60 min后分别取样,作为SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)的样品。肠道消化时间为60 min时记为消化终点,将胃肠道酶解物冷冻干燥备用。
1.3.5 婴儿体外模拟消化物的SDS-PAGE分析
SDS-PAGE参考Ren Chengang等[19]的方法,将一定量样品(2~5 mg,以蛋白质量计)加入1.5 mL离心管,加入0.5 mL的含有体积分数20%甘油、质量分数0.2% SDS、0.063 mol/L Tris-HCl(pH 6.8)的样品处理液,再添加0.36 g脲和20 μL饱和溴酚蓝溶液,加蒸馏水使总体积为1 mL,充分混合均匀,静置过夜后进行SDS-PAGE。
采用Bio Craft Model BE-210N垂直平板电泳装置,胶板厚度为1 mm。分离胶质量分数为12.5%,浓缩胶质量分数4%。电泳缓冲液含有5 mmol/L Tris、38.4 mmol/L甘氨酸和0.1% SDS。上样量为5 μL。SDS-PAGE过程中,浓缩胶部分保持电流15 mA,进入分离胶后,电流为25 mA。
胶片用体积分数33%甲醇溶液和12%三氯乙酸固定液固定4 h,然后用考马斯亮蓝G-250染色液染色3~4 h。染色结束后,用蒸馏水对胶片进行脱色,直至底色基本脱除。
1.3.6 胃肠道酶解物分子质量分布分析
采用体积排阻HPLC(size-exclusion HPLC,SE-HPLC)法分析胃肠道酶解物的分子质量[20]。在待测样品冷冻干燥粉中加入0.03 mol/L、pH 7.4的Tris-HCl缓冲液,配制成5 mg/mL的样品,采用孔径为0.45 μm的微孔滤膜过滤后进样。色谱条件如下:1100 HPLC系统,色谱柱为Protein Pak 60凝胶色谱柱(分离范围1~20 kDa);流动相:0.03 mol/L、pH 7.4的Tris-HCl缓冲液;检测波长为214 nm;流速为0.5 mL/min;上样量为20 μL;检测温度为27 ℃。分子质量校正曲线所用标准品为胰蛋白酶抑制剂(MW20 100 Da)、蛋清溶菌酶(MW14 400 Da)、AB2-80(MW7 823 Da)、AB2-81(MW5 856 Da)、AB2-95(MW3 313 Da),根据标准品分子质量的对数与保留时间作回归分析。再根据样品的保留时间和回归方程计算待测样品的分子质量。
1.3.7 蛋白分子质量分布的测定
SPI-100、SPI-120、SPI-140、SPI-160分子质量的测定采用SE-HPLC法[21]。待测样品冷冻干燥粉溶于含有0.3 mol/L NaCl的50 mmol/L磷酸盐缓冲液(pH 7)中,用直径为0.45 μm的微孔滤膜过滤后进样。色谱条件为:1100 HPLC系统;色谱柱为TSK gel G4000SWXL凝胶色谱柱;流动相为0.3 mol/L NaCl的50 mmol/L pH 7的磷酸盐缓冲液;检测波长280 nm;流速0.5 mL/min;上样量20 μL;检测温度27 ℃。
1.3.8 可溶性蛋白质量分数的测定
配制质量分数为2%的SPI-100、SPI-120、SPI-140、SPI-160样品溶液,室温下溶解60 min后,10 000×g离心10 min得到上清液,用Bradford法[22]测定上清液中可溶性蛋白质量分数。
1.3.9 色氨酸内源荧光发射光谱分析
参照Shen Lan等[23]的方法并略作改进,用荧光光谱仪测定SPI-100、SPI-120、SPI-140、SPI-160样品中的内源(色氨酸)荧光发射光谱。待测样品用0.1 mol/L的磷酸盐缓冲液(pH 6.80)溶解,控制蛋白质量浓度在0.1~0.2 mg/mL。溶液在290 nm波长处激发,扫描300~420 nm的荧光发射光谱,狭缝宽度10 nm,扫描速率200 nm/min。
1.3.10 圆二色光谱分析
在MOS-450/AF-CD分光仪上收集样品的圆二色光谱图。所有样品的蛋白质量浓度均为0.1 mg/mL,在190~250 nm范围内扫描,选用1 mm长度的石英皿并用25 ℃的去离子水作空白,每个圆二色光谱扫描速率为30 nm/min,数据点的记录间隔为1 nm,响应时间为2 s。
1.4 数据处理与分析
所有实验得到的数据用SPSS 16.0软件进行单因素方差分析检验,显著性水平为P<0.05。每个样品平行测定3 次,所有实验重复两次。
2 结果与分析
2.1 热处理大豆蛋白的氨基酸组成分析及营养性评价
蛋白质的氨基酸组成和含量影响蛋白质的营养有效性。对不同温度处理后大豆蛋白的氨基酸组成进行分析,结果如表1所示。
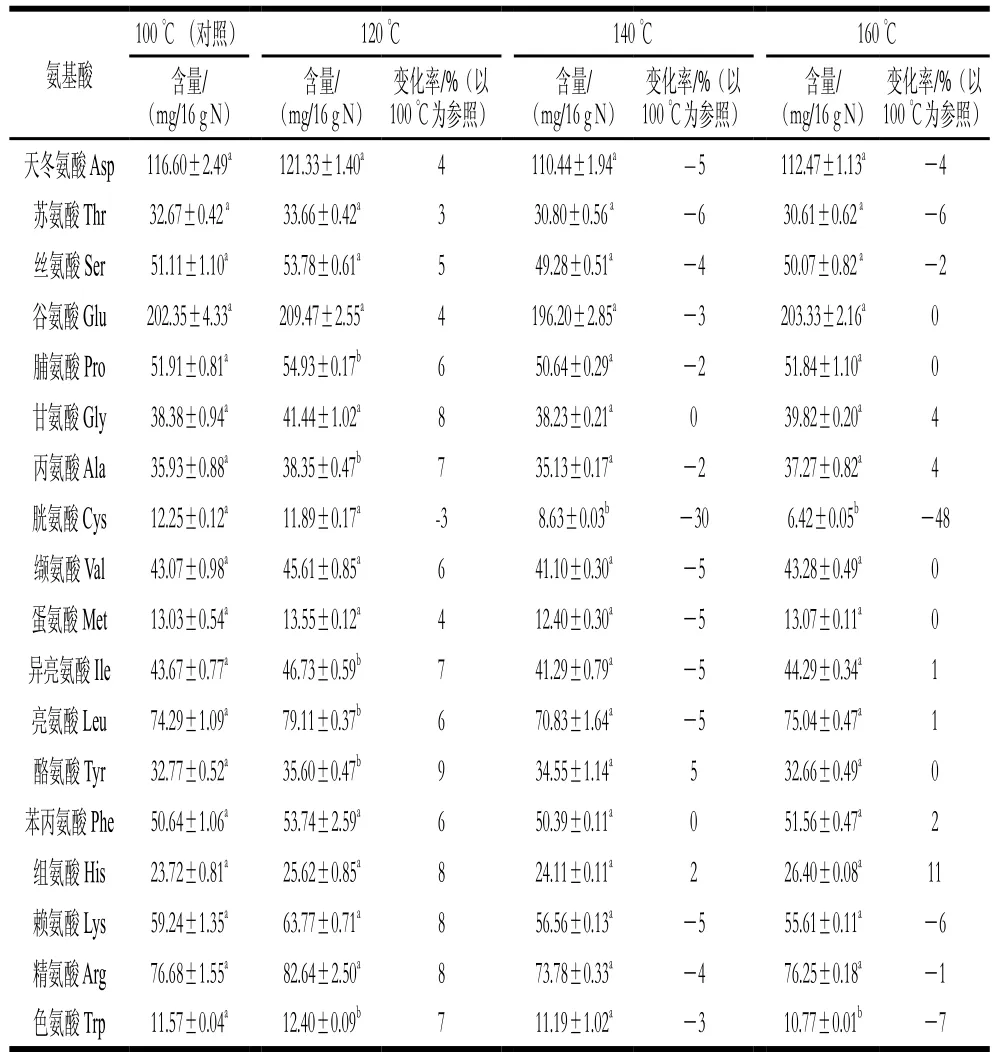
表1 不同温度处理后大豆蛋白的氨基酸组成及含量Table 1 Amino acid composition of soybean protein under different temperature treatments
与100 ℃热处理相比,120 ℃热处理对氨基酸组成及含量影响不大,但随着热处理温度升高,大豆蛋白中的氨基酸存在不同程度的损失,其中,以胱氨酸损失最为严重。140、160 ℃的处理条件分别导致胱氨酸损失了30%、48%。这一结果与Bjarnason等[24]报道牛血清白蛋白在145 ℃加热后胱氨酸大量损失的实验结果相一致。当加热温度过高时,半胱氨酸、胱氨酸会发生脱硫反应,产生不可逆的分解,形成硫化氢、二甲基硫化物、磺基丙氨酸等,造成氨基酸的严重破坏。
为进一步了解不同温度热处理后大豆蛋白中的必需氨基酸的营养平衡情况,本实验采用蛋白质营养价值评价常用的5 种化学分析方法:AAS、CS、EAAI、EAARR、SRCAA,以WHO/CAC母乳蛋白氨基酸参考模式为评价标准,对不同热处理后大豆蛋白的必需氨基酸进行模式评分计算,结果如表2所示。
无论是以WHO推荐的母乳氨基酸含量为评分标准还是以CAC推荐的母乳氨基酸含量为评分标准,不同温度下加热的大豆蛋白化学评分变化趋势基本相同。与100 ℃的加热处理相比,除了SRCAA外,120 ℃的热处理会使得大豆蛋白的其他化学评分略有升高,即越接近母乳蛋白的必需氨基酸比例。然而,当进一步提高温度至140、160 ℃时,大豆蛋白的所有化学评分均明显下降,即140、160 ℃的热处理导致大豆蛋白中必需氨基酸的比例或模式不适于婴儿所需要的各种氨基酸的比例或模式要求,蛋白的营养有效性显著下降。大豆蛋白氨基酸的比例模式变化是由于热处理引起氨基酸的损失造成的。

表2 不同温度处理后大豆蛋白的化学评分Table 2 Nutritional evaluation of soybean protein under different heat treatments
2.2 热处理大豆蛋白体外模拟消化物SDS-PAGE结果分析
蛋白质的营养价值不仅与蛋白质本身的氨基酸含量有关,还取决于蛋白质的可消化性、消化产物性质及其在生物体内的吸收转运过程。为了考察高温热处理大豆蛋白体外消化情况,本研究采用婴儿体外模拟消化的方法,在不同温度处理的大豆蛋白消化不同时间点取样进行SDS-PAGE,通过观测电泳条带变化反映样品的消化情况。如图1所示,100 ℃热处理的大豆蛋白在胃部消化30 min后,各个亚基条带颜色逐渐变浅,其中,7Sβ亚基被消化酶酶解的速率高于α'和α亚基,11S A亚基的酶解速率高于β亚基。在胃部消化结束时,SPI的几个主要亚基的条带仍均有不同程度的保留。而进一步进入肠道消化后,仍然有略低于14 kDa的胃肠道酶解物大量存在。120 ℃热处理后的大豆蛋白体外消化的SDS-PAGE图谱与100 ℃加热处理大豆蛋白的基本相似。
值得注意的是,140、160 ℃热处理后的大豆蛋白SDS-PAGE图谱中并未出现典型的大豆蛋白条带(泳道2),α'、α、β亚基以及A亚基和B亚基条带在SDS-PAGE图谱上不清晰。据报道,当加热温度过高时,半胱氨酸、胱氨酸会发生脱硫反应,肽键断裂,形成硫化氢、二甲基硫化物、磺基丙氨酸等,造成氨基酸的严重破坏[25]。而在一个具有四级结构的蛋白质分子中,由一条多肽链折叠成的三级结构球蛋白才能称为蛋白质亚基。因此,本实验中观察到的140、160 ℃热处理后大豆蛋白无明显电泳条带可能是由于高温破坏了蛋白质的一级结构以及亚基的空间构象。
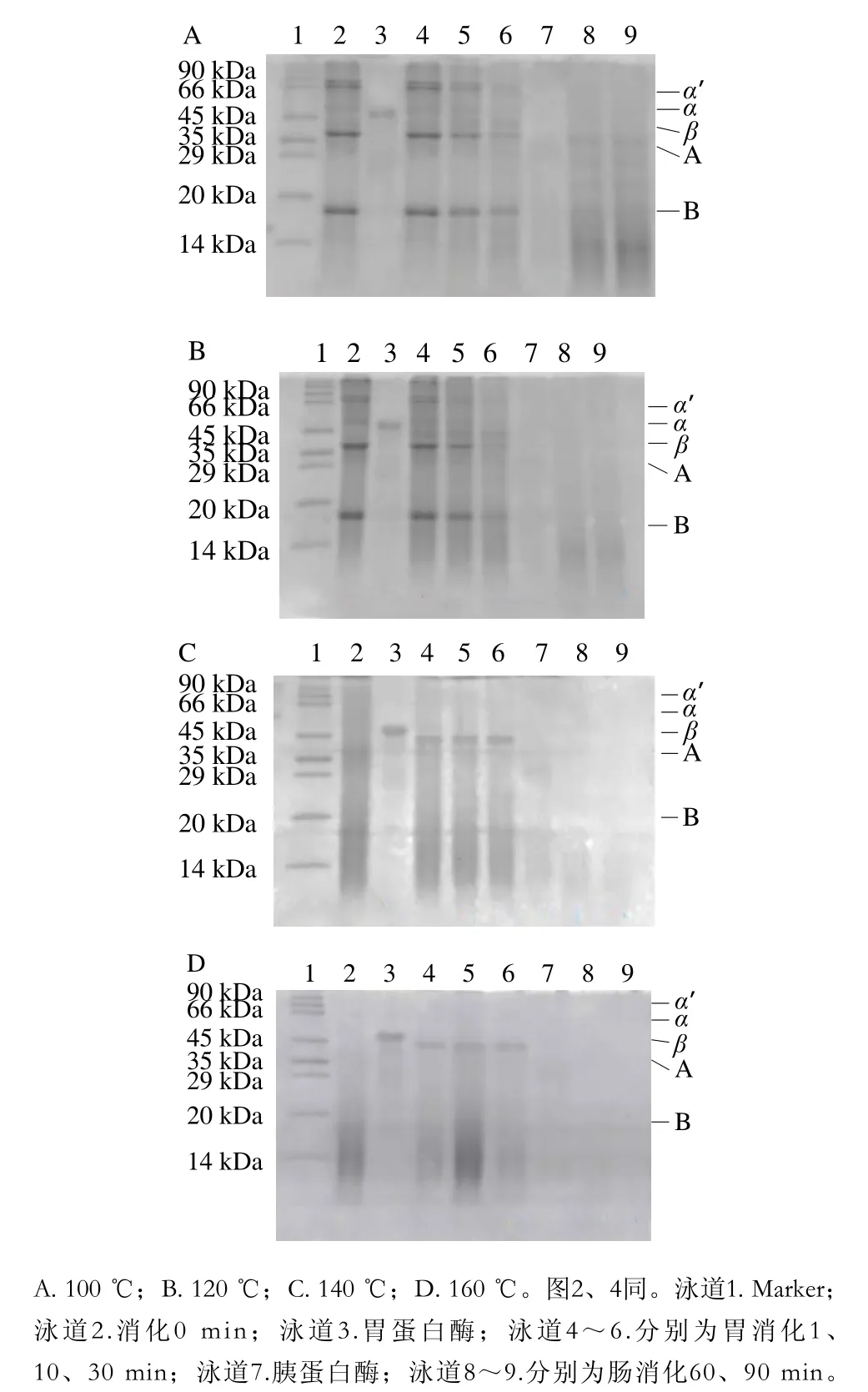
图1 热处理大豆蛋白溶液婴儿体外模拟消化的SDS-PAGE图谱Fig. 1 SDS-PAGE of soybean protein digested in simulated infant gastrointestinal tract
2.3 大豆蛋白胃肠道酶解物分子质量分布分析结果


图2 大豆蛋白体外模拟消化后的SE-HPLC图谱Fig. 2 SE-HPLC profile of soybean protein after in vitro digestion
进一步对不同温度处理的大豆蛋白胃肠道酶解物分子质量分布进行分析。如图2所示,100、120 ℃热处理的大豆蛋白经胃肠道酶解后得到的胃肠道酶解物的分子质量分布没有显著性差异。然而,大豆蛋白经140、160 ℃高温处理后胃肠道酶解物的出峰时间较晚,分子质量明显降低。对样品不同分子质量组分所占比例进一步分析可以看出,随着加热温度逐渐升高,尤其是将大豆蛋白加热至140、160 ℃后,大分子质量(MW>15 kDa)的胃肠道酶解物所占比例显著降低,低分子质量尤其是1~10 kDa的胃肠道酶解物,所占比例显著提高(表3)。

表3 大豆蛋白体外模拟消化后不同分子质量组分所占比例Table 3 Ratios of fractions with different molecular masses in in vitro digested soybean protein
2.4 不同温度加热后大豆蛋白的可溶性蛋白质量分数和分子质量分布结果
蛋白质的聚集程度能影响蛋白质与胃肠道消化酶的相互作用关系,进而影响蛋白质的消化吸收[26-27]。大量研究表明,具有相同氨基酸组成的蛋白质经过不同方式处理后,空间结构发生变化是导致蛋白质胃肠道酶解物性质差异及消化性和营养性不同的主要原因[4-5,28]。本研究从蛋白聚集程度出发,分析蛋白质可消化性与营养有效性的关系。
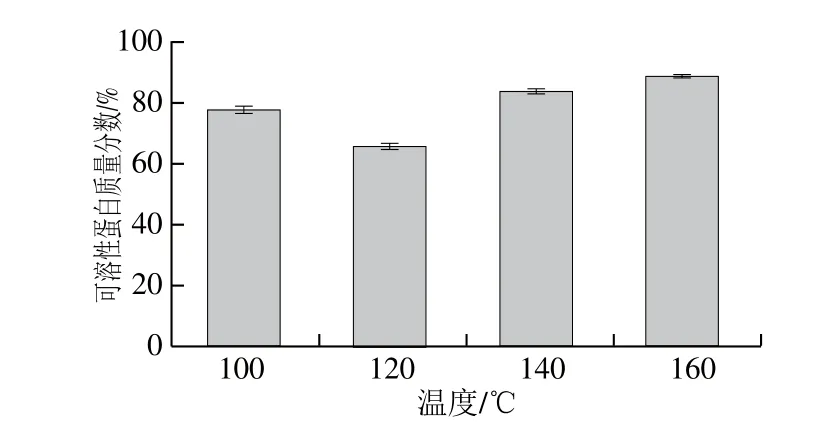
图3 不同温度加热后大豆蛋白的可溶性蛋白质量分数Fig. 3 Soluble protein content of soybean protein under different heat treatments
如图3所示,100、120 ℃热处理的大豆蛋白可溶性蛋白质量分数较低,分别约为77%、67%;而经过更高温度(140、160 ℃)热处理后,溶液中可溶性蛋白质量分数升高。进一步对高温热处理大豆蛋白的分子质量进行了分析。如图4和表4所示,100 ℃热处理后的大豆蛋白高分子化合物所占比例较高(洗脱时间约为13 min),低分子质量化合物所占比例较低(洗脱时间约为26.5 min)。继续提高加热温度,高分子质量化合物所占的比例逐渐减小,低分子质量的化合物所占比例逐渐增多。

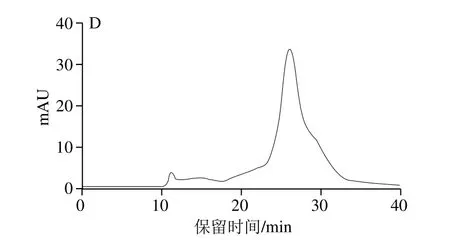
图4 不同温度加热后大豆蛋白的SE-HPLC图谱Fig. 4 SE-HPLC profiles of soybean protein under different heat treatments

表4 大豆蛋白不同分子质量组分所占比例Table 4 Ratios of fractions with different molecular masses in soybean protein under different heat treatments
然而,值得注意的是,本实验中样品首先需要通过0.45 μm的滤膜才能进一步进行SE-HPLC分析。前述的实验已经表明,120 ℃的热处理使得可溶性蛋白含量明显降低(图3),因此,对于120 ℃热处理后大豆蛋白SE-HPLC图谱而言,分子质量大于670 kDa的高分子聚合物含量明显降低并不是由于样品本身聚集程度减少造成的,而是由于在120 ℃热处理的条件下,大豆蛋白更容易相互聚集,形成了更大的聚集体,但这些高分子聚合物不能透过0.45 μm的滤膜而被过滤造成的。因此,与100 ℃相比,120 ℃热处理后大豆蛋白的聚集程度较高,但是,消化后酶解产物的分子质量并没有显著性差异(图2),可以推测,120 ℃热处理后的大豆蛋白尽管形成了更大的聚集体,但是这种聚集体并没有屏蔽胃蛋白酶的酶解位点,造成可消化性降低。
2.5 热处理大豆蛋白的结构表征
色氨酸内源荧光光谱分析是一种被广泛用于蛋白质三级结构变化分析的重要手段。不同温度处理的大豆蛋白色氨酸内源荧光光谱如图5所示。高温热处理导致蛋白质最大内源荧光发射波长发生显著红移(从352.5 nm增加到359.0 nm)。蛋白质内源荧光光谱是通过测定色氨酸残基所处的环境极性得到的,反映了蛋白质构象的变化以及蛋白质之间的相互作用。当生色团暴露在溶剂环境中时,最大荧光发射波长(λm)则会发生显著红移,当生色团与溶剂中或蛋白质本身的猝灭剂作用时,荧光量子产率降低。Dufour等[29]报道了色氨酸残基处于球蛋白内部疏水性区域时,SPI的λm约为335~336 nm。因此,高温热处理后的大豆蛋白质色氨酸残基所处的溶剂环境极性提高,即色氨酸残基从球蛋白内部疏水性区域转移到表面,随着温度的逐渐提高,蛋白质的变性程度逐渐增大,暴露程度也逐渐增加。

图5 不同温度处理大豆蛋白的色氨酸内源荧光发射光谱Fig. 5 Intrinsic emission fluorescence spectra of soybean protein under different heat treatments
远紫外圆二色光谱(250~200 nm)是一种表征蛋白质二级结构的实验手段,它能够表征主链构象,尤其在水溶性的蛋白溶液中。它可以直接用来反映蛋白二级结构4 种类型的含量。SPI包含4 种类型的二级结构:α-螺旋、β-转角、β-折叠以及无规卷曲,其中以β-折叠以及无规卷曲的含量较多[30]。

图6 不同温度处理大豆蛋白的圆二色光谱Fig. 6 Circular dichroism spectra of soybean protein under different heat treatments
图6 是不同温度处理后大豆蛋白的圆二色光谱图。208 nm和222 nm波长处负凹糟是由于α-螺旋结构引起的负科顿效应造成的,而205~218 nm的负肩峰可以表征β-折叠结构,负肩峰越偏向左移则表征无规卷曲结构含量越多。在本实验中,随着加热温度的逐渐升高,负肩峰左移越来越明显,说明体系内的β-折叠结构含量减少并正在向无规卷曲转化。且温度越高,转化量越多。Carbonaro等[6]报道食品蛋白的消化性与β-折叠的含量的相反,β-折叠的含量与加工时形成稳定的聚合物有关,豆类蛋白的β-折叠复合物的形成是蛋白质水解减少的关键。Yang Yong等[31]研究5 种不同品种大豆蛋白的体外消化性,也发现β-折叠含量与蛋白的体外消化性呈负相关。
140、160 ℃的高温热处理会导致肽键断裂数增多,生成更多更低分子质量的肽段,体外消化率显著提高(图2)。因此推测,在140、160 ℃的高温热处理条件下,大豆蛋白体外消化率的提高是由于体系内β-折叠结构含量降低导致的。
3 结 论
大豆蛋白是具有较高营养价值的优质蛋白,是广泛用于婴儿配方食品等特殊膳食的配料。热处理是婴儿食品加工过程中一种必要的单元操作。然而高温热处理是否改变了大豆蛋白的营养价值目前尚不清楚。因此,本实验考察了高温热处理大豆蛋白溶液导致的营养和消化性的差异。结果表明,一方面,高温热处理直接破坏了体系内的氨基酸组成,损坏了大豆蛋白氨基酸合理的模式比例,降低了蛋白质的营养价值;另一方面,高温热处理有利于大豆蛋白与胃蛋白酶的相互作用,生成更多更低分子质量的酶解产物。然而高温热处理是否改变了这些胃肠道酶解物的结构特征以及是否降低了小肽转运载体(PepT1)转运肽段的能力从而导致生物吸收能力的低效化等问题则需要进一步的探究。

