葡萄酒中的酚类物质I:种类、结构及其检测方法研究进展
张欣珂,赵 旭,成池芳,齐梦瑶,石 英,*
(1.中国农业大学食品科学与营养工程学院,葡萄与葡萄酒研究中心,农业农村部葡萄酒加工重点实验室,北京 100083;2.新疆中信国安葡萄酒业有限公司,新疆 玛纳斯 832200)
葡萄酒是受世界各国消费者喜爱的酒精饮品,在我国人民的日常消费中也占据愈发突出的比例。根据国际葡萄与葡萄酒组织2017年的最新统计(http://www.oiv.int/en/)显示:2015年我国葡萄酒总产量达11.5亿 L,居世界第7位;我国葡萄酒消费量已经超过16亿 L,居世界第5位;近10 年以来,我国年度新增酿酒葡萄的栽培面积以及每年酿酒葡萄和葡萄酒产量的增速均居世界第一。葡萄酒消费在我国的迅速崛起除了其带给消费者丰富多样的感官体验和其自身深厚多样的历史文化底蕴外,能起到一定的生物活性功效也是其备受青睐的一个重要原因。“法兰西悖论”也被国内外学者和消费者广泛讨论。究其原因,葡萄酒中的酚类物质被认为是影响葡萄酒感官和保健功能的重要因素。近些年来,有关葡萄酒中酚类物质的研究愈发热烈,在Web of Science中以“Phenolics,Wine”为关键词检索,可得到8 398 个检索结果。而纵观其历年发表SCI文章数目,也有迅速上升的趋势(图1)。本文对葡萄酒中酚类物质的种类、结构、性质以及检测手段进行了综述,以期为葡萄与葡萄酒中多酚的研究提供依据,也为我国葡萄和葡萄酒产业的发展提供参考。
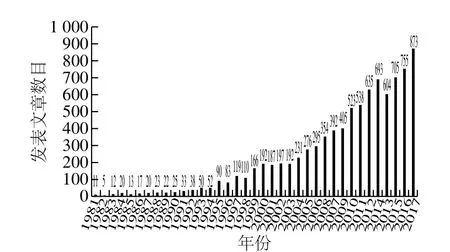
图1 1981年以来关于葡萄酒中酚类物质研究的SCI论文数量(数据来源于Web of Science)Fig. 1 Annual numbers of SCI papers concerning wine phenolics published since 1981 (data from Web of Science)
1 类黄酮类物质
1.1 花色苷及其衍生物
1.1.1 单体花色苷
花色苷是花色素糖苷化后的产物,具有C6-C3-C6结构(图2),属于类黄酮类物质,主要存在于酿酒葡萄(Vitis vinifera L.)的皮中和一些染色品种的果肉中。根据B环上取代基的不同,欧亚种葡萄及葡萄酒中的花色素主要分为以下6 种:花葵素、花翠素、花青素、甲基花翠素、甲基花青素和二甲花翠素,其中二甲花翠素含量最高。花葵素的含量极低,往往不予考虑,但其也在欧亚种葡萄中被鉴定出[1]。花色素不能稳定存在,极易降解。在红葡萄酒中稳定存在的是通过在花色素C环上C3位羟基经过糖苷化形成的花色苷分子。新鲜型干红葡萄酒中的单体花色苷能够达到数百毫克每升,陈酿型干红葡萄酒中由于降解和聚合作用,单体花色苷质量浓度下降至几十毫克每升甚至更低[2]。欧亚种葡萄中只含有单糖苷化的花色苷,但最近的一些研究也证明了极低含量的C3和C5取代的双糖苷化花色苷的存在,同时也找到了催化C5位糖苷化的5-O-糖苷转移酶和相关的基因[3]。在葡萄果皮细胞液泡中,由于酰基转移酶的作用,单体花色苷C环上C3位连接的葡萄糖与具有酰基基团的分子被催化酰化为酰化花色苷[4]。常见的酰化类型有乙酰化和香豆酰化,也有少数的咖啡酸酰化[5-6]。酰化花色苷含量普遍要低于单体花色苷,但是由于自身结构的稳定性和分子内辅色作用,酰化花色苷分子稳定性要高于单体花色苷[7]。
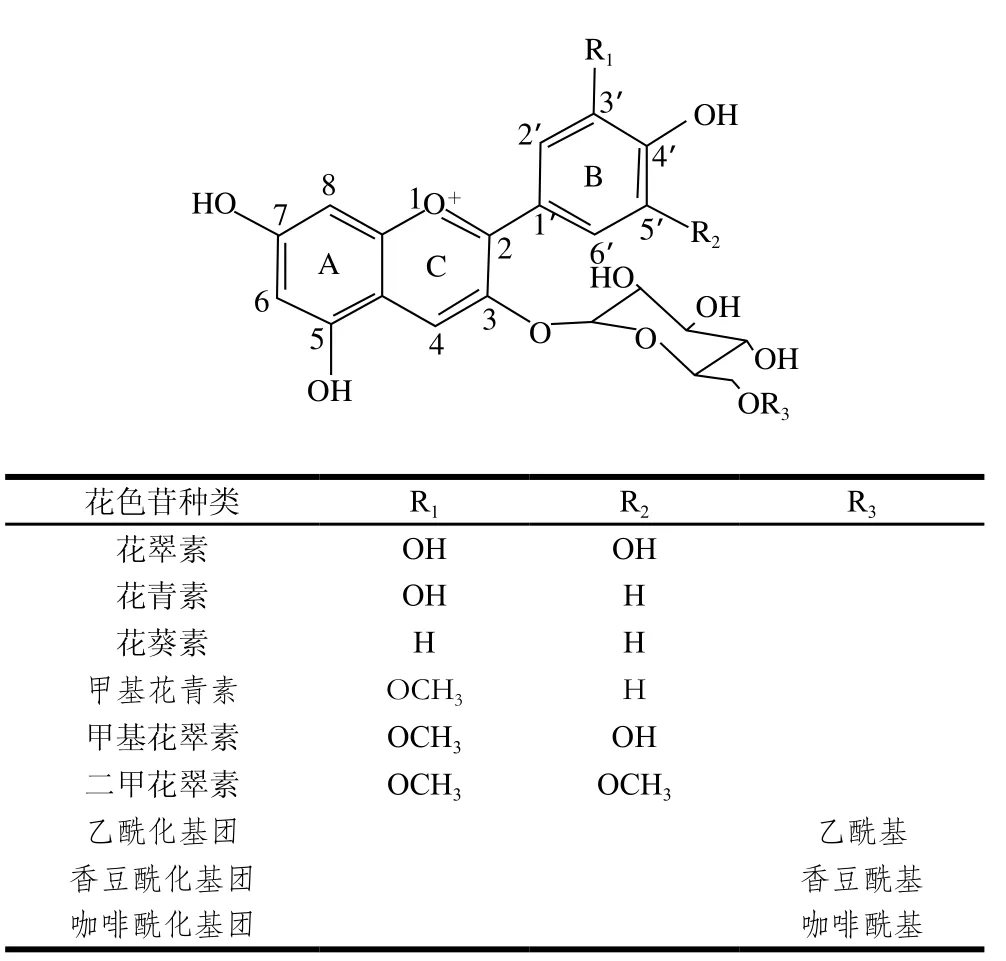
图2 葡萄与葡萄酒中花色苷的结构与种类[8]Fig. 2 Anthocyanin structure and categories in wine grapes and wines[8]
花色苷分子在水溶液中存在着酸碱平衡(图3A),在不同pH值下呈现不同的颜色。在葡萄酒的pH值(3.5)下,花色苷主要以无色的半缩醛和红色的烊盐离子的形式存在。当pH值升高,花色苷分子的酸碱平衡向蓝紫色的醌式碱和无色半缩醛方向移动,半缩醛的杂环进一步断裂形成查耳酮。查耳酮并不稳定,进一步裂解为酚醛和酚酸(图3B)。
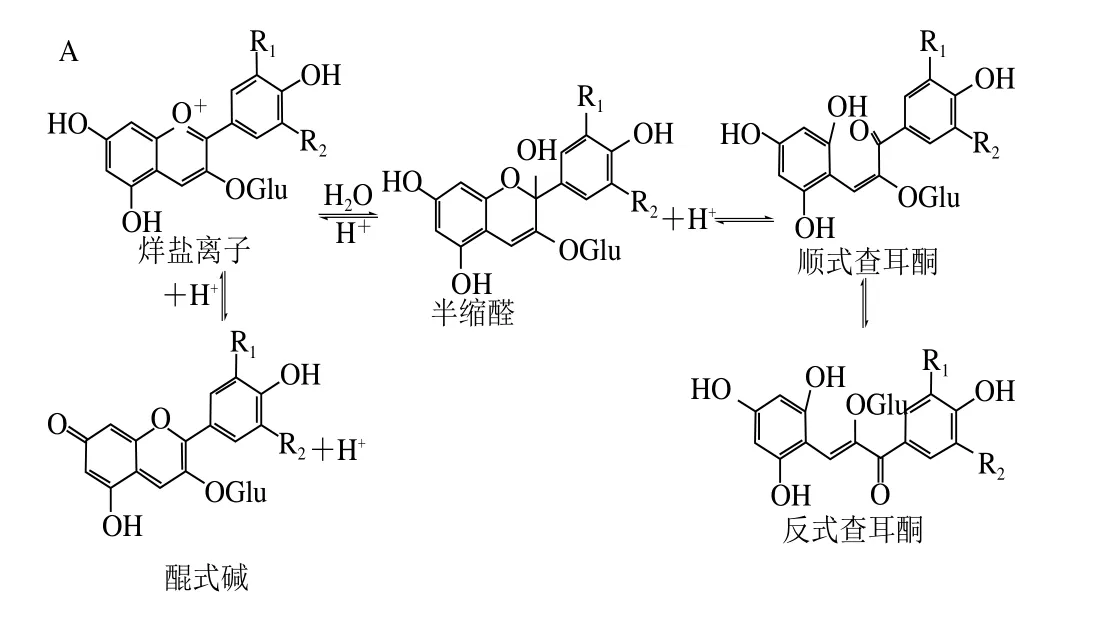
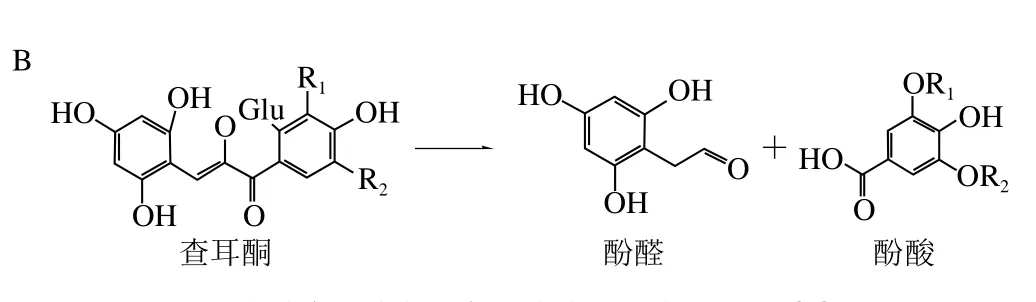
图3 各状态下花色苷在水溶液中的酸碱平衡(A)和查耳酮的裂解(B)[8-9]Fig. 3 Equilibria among various structural forms of anthocyanins (A)and decomposition of chalcone (B) in wine[8-9]
除单体花色苷以外,花色苷可与多种分子反应形成花色苷衍生物,其在陈酿葡萄酒中含量丰富。吡喃花色苷是花色苷衍生物的重要组成,主要包括Vitisins、Pinotins和Portisins等(图4)。
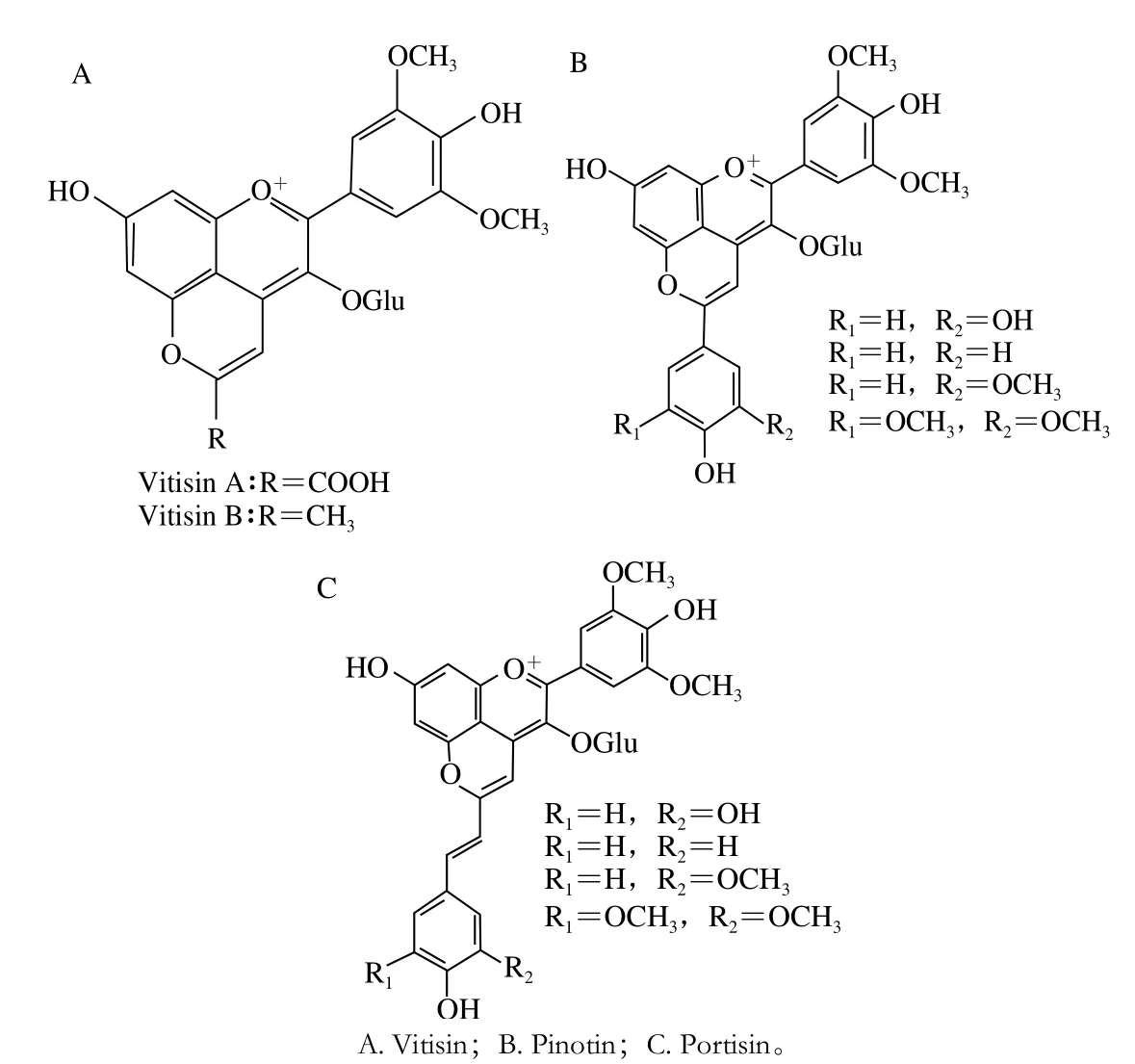
图4 葡萄酒中3 种吡喃花色苷的结构[10]Fig. 4 Structures of three types of pyranoanthocyains[10]
1.1.2 Vitisins
Vitisin族是最早被发现的一类花色苷衍生物之一,在1997年首次被人们发现[11];它是由花色苷分子和酵母代谢产物如丙酮酸、乙醛、丙酮等小分子亲电亲核加成成环的产物(图4A)。Vitisin族中最重要的花色苷为Vitisin A和Vitisin B,分别由二甲花翠素-3-O-葡萄糖苷和丙酮酸、乙醛反应生成。由于在花色苷分子C环的C4位和A环C5位的羟基加成形成吡喃环,Vitisin族被归属于吡喃花色苷类物质[10]。Vitisin由于吡喃环的存在,增大了共轭结构,分子稳定性大幅增加。此外,由于吡喃环的存在,Vitisin能够避免二氧化硫分子亲核攻击导致的降解,从而避免了二氧化硫的漂白作用[12]。有研究表示,由于更加广阔的共轭体系和吸电子基团的存在,比起单体花色苷,Vitisin A具有较小的pKa值,这也就意味着Vitsin A更不容易受到pH值的影响[13]。Vitisin分子最大吸收波长较单体花色苷往短波长方向移动,表现出橙红色色调[14]。此外,一些吡喃花色苷被认为有着更深的颜色,其摩尔消光系数也被证实大于单体花色苷[15]。Vitisin族物质的质量浓度在酒中很高,能够达到数毫克每升,因此对红葡萄酒的感官影响不可忽略。
1.1.3 Pinotins
除了Vitisin,具有肉桂酸结构的酚类物质也能参与形成吡喃花色苷,这类花色苷在1996年的Pinotage酒中被分离和鉴定,因此被命名为Pinotin(图4B)[16],也称之为酚基型吡喃花色苷。Pinotin是由花色苷分子和羟基肉桂酸结构上的碳碳双键亲电亲核进攻后重排脱羧后形成[10]。参与反应的物质主要是肉桂酸类,如对香豆酸、咖啡酸、阿魏酸、芥子酸。羟基肉桂酸脱羧产物也会与花色苷反应形成Pinotin,如对香豆酸的脱羧产物4-乙烯基苯酚[17]。Pinotin也有和Vitisin类似的光谱性质,即最大吸收波长向短波长方向移动,所表现出的颜色为橙红色[18]。
1.1.4 Portisins
另外一类重要的吡喃花色苷为Portisin(图4C),2003年该类物质首次在波特酒中被分离鉴定[19]。Portisin是由Vitisin A和乙烯基苯酚化合物缩合而成,其合成机理与Pinotin类似,都是被乙烯基双键进攻然后氧化重排形成[10]。因此含有乙烯基的一些化合物,如被乙醛亲核进攻形成的乙烯基黄烷醇,也能形成类似的Portisin结构。Portisin也是吡喃花色苷中重要的一类,但表现出的光谱性质与Vitisin和Pinotin相反。Portisin的最大吸收波长能够达到570 nm,即表现出蓝色色调,其更加广阔的π电子共轭体系被推测是其独特色调的产生原因[19-20]。
1.1.5 花色苷和黄烷-3-醇的缩合产物
黄烷醇类物质与花色苷的反应产物也构成了花色苷衍生物中重要的一类。其中最重要的是单体黄烷-3-醇、寡聚原花色素与花色苷发生直接聚合反应的产物。不同酸碱解离平衡形态下的花色苷分子与黄烷-3-醇的反应机理不同,反应产物也不同。根据花色苷与黄烷-3-醇的位置不同可以将该类化合物分为T-A型(或F-A)(图5A)和A-T型(或A-F)。其中A-T型还会因为分子加成在C环处的C2位和黄烷醇分子A环C7位的羟基反应生成醚键,形成A型聚合色素(图5B),其结构类似于A型原花色素[21]。两类物质的形成机理完全不同:T-A型聚合色素的形成首先是由经原花色素分子断裂,暴露出带碳正离子的黄烷-3-醇分子(C4位),其次半缩醛形式的花色苷A环上亲核的C6或C8位亲核攻击碳正离子,后经脱水重排得到[22-23];而A-T型聚合花色苷的形成则是由烊盐形式花色苷亲电的C4位,攻击黄烷-3-醇单体(或原花色素多聚体的延伸单元)亲核的C6或C8位,然后经过氧化重排形成[10]。前者必须有原花色素的酸催化裂解才能反应,后者则不需要这一步骤。水溶性的花色苷-黄烷醇聚合物多为花色苷与单体小分子黄烷-3-醇和寡聚原花色素的反应产物。对于与大分子单宁形成的聚合色素,其溶解性随着单宁聚合度的提高而下降,容易沉淀,因此在红葡萄酒中含量很低。T-A型的花色苷和黄烷-3-醇聚合物最大吸收波长由520 nm左右移至535 nm左右[24],A-T型的花色苷和黄烷-3-醇聚合的产物则进一步环化形成橙色(最大吸收波长约为430 nm)的呫吨鎓离子[25]。
花色苷除了与黄烷-3-醇直接聚合,还可以通过乙醛介导形成桥连的聚合花色苷(图5C)。这类花色苷早在1995年被发现并被研究[26-27]。乙醛介导的花色苷-黄烷-3-醇聚合物被认为能更有效地抵抗水分子和SO2分子的攻击[28],并且最大吸收波长向长波长方向移动[27,29]。此外,黄烷-3-醇分子的C8位被乙醛亲和进攻后形成的乙烯基,能和花色苷分子发生类似于形成Vitisin的反应,生成吡喃型黄烷醇花色苷聚合物[18,30](图5D)。和Vitisin一样,这类花色苷的最大吸收波长向短波长方向移动至490~511 nm范围内,表现出橙红色色调[26]。
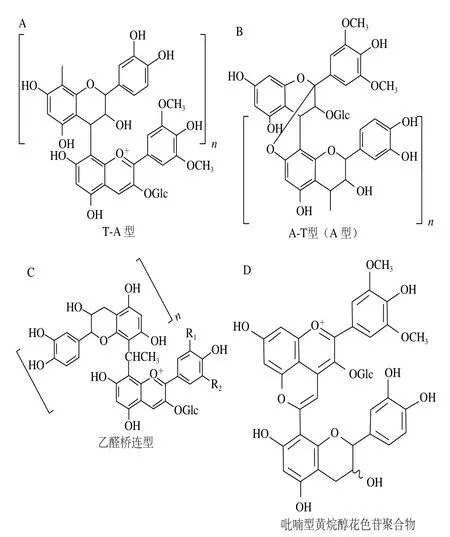
图5 葡萄酒中花色苷与黄烷-3-醇聚合物的种类与结构[10]Fig. 5 Categories and structures of condensed products of anthocyanins and flavan-3-ols in wines[10]
1.1.6 花色苷和与花色苷的反应产物
花色苷分子之间也能反应形成重要的花色苷衍生物。花色苷之间反应形成的聚合体在葡萄酒中也被检测到[31]。目前被广泛所知的仅仅是花色苷之间聚合的产物和一些乙醛介导的花色苷聚合物[32-33]。最近,一些由乙烯基成环加成形成具有吡喃环的花色苷-花色苷聚合物被发现[34]。但目前关于花色苷-花色苷聚合物机制的研究比较少,其化学性质以及其光谱特性并不明确,其反应合成途径和合成机制有待于进一步研究。
1.1.7 其他种类的聚合花色苷
除上述几类主要的聚合花色苷外,红葡萄酒中还存在其他类型的花色苷衍生物,如Vitisin A经过脱羧、氧化、脱水等步骤形成的Oxovitisins[35];羧基吡喃花色苷和甲基吡喃花色苷形成的吡喃花色苷二聚体[36];黄烷-3-醇和吡喃花色苷形成的F-A结构的聚合花色苷[37]以及花色苷和鞣花单宁形成的一些聚合物[38]。这些物质含量普遍很低,多在波特酒和合成的模拟溶液中被检测到,而在干红葡萄酒中没有被广泛地报道。尽管这些物质表现出了独特的光谱性质(如吡喃花色苷二聚体呈现蓝色)[36],但由于含量极低,其对干红葡萄酒颜色贡献的重要性还有待商榷。
1.2 黄烷醇类物质
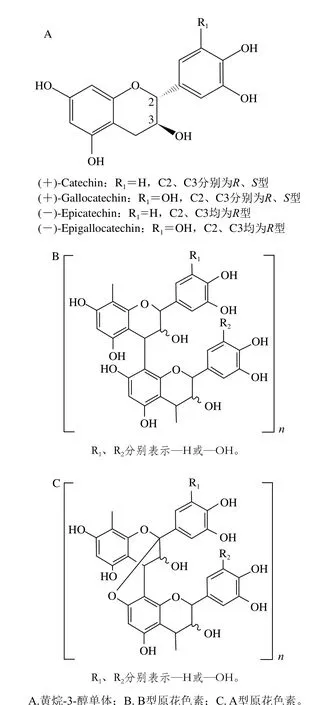
图6 葡萄与葡萄酒中黄烷醇类物质[39]Fig. 6 Structures of flavan-3-ols in wine grapes and wines[39]
黄烷醇类物质是葡萄酒中最重要的成分之一,为葡萄酒提供苦味和收敛性的感官特征。尤其在干红葡萄酒中,黄烷醇物质支撑起了酒的“骨架感”。黄烷-3-醇在红葡萄酒的酚类物质中占有很高的比例,在新酒中约有25%~50%的酚类物质为寡聚或者高聚的黄烷醇,其质量浓度为0.5~1.5 g/L之间(有的更高)[2]。酒中黄烷醇含量取决于原料的情况和酿造工艺。黄烷醇的含量和组成决定了干红葡萄酒的陈酿潜力,是影响干红品质的重要因素之一。
1.2.1 黄烷-3-醇单体
红葡萄酒中的黄烷醇类物质主要由黄烷-3-醇单体和原花色素构成,它们主要存在于葡萄浆果的种子、果皮和果梗部分[40]。黄烷-3-醇单体是黄烷醇类物质的基本单元,具有C6-C3-C6结构,属于类黄酮类物质。根据B环上取代基的不同,黄烷-3-醇分为儿茶素类和棓儿茶素类物质(图6A)。由于C环上手性碳原子的存在,儿茶素和棓儿茶素存在手性同分异构体(图6A)。同时C3位羟基可以被没食子酸酯化,形成(表)儿茶素没食子酸酯和(表)棓儿茶素没食子酸酯。这几类物质是黄烷-3-醇类物质的基本单元。
1.2.2 原花色素
原花色素又被称为缩合单宁,是由黄烷-3-醇单体通过C4-C8或者C4-C6直接缩合而成,但其生物合成机理到目前为止尚不清楚。原花色素在酸性条件下加热可以水解,根据水解后成分的不同可以分为原花青素和原花翠素[41]。原花青素主要由儿茶素和表儿茶素(含没食子化)构成,主要存在于葡萄籽和皮中;原花翠素主要由棓儿茶素和表棓儿茶素(含没食子化)构成,主要存在于葡萄皮中[41]。葡萄皮中还存在各种单体混合构成的原花色素[40]。原花色素还可以根据聚合度区分为寡聚体和多聚体。通常认为,寡聚体为2~4 个单体构成的聚合物,而多聚体则由4 个以上的单体组成[39-40]。研究表明,葡萄不同组织的原花色素的聚合度也不同,果皮中的平均聚合度约为30[42],而种子和果梗约为10[43]。此外,不同组织中表没食子儿茶素的比例也不同,在果皮、种子、果梗中的比例分别为5%、15%和30%[41]。天然存在的原花色素多为顶端单元上C4连接末端单元C8的B型原花色素(图6B),C4-C6型的比较少见。此外,也存在顶端单元C2位与末端单元C5或者C7位通过醚键连接的A型原花色素(图6C)[44]。
红葡萄酒中的黄烷-3-醇大部分以大分子聚合的单宁形式存在,在红葡萄酒的弱酸性环境下,长链的单宁分子会发生裂解[45]。长链原花色素裂解后上端单元暴露出C4位的碳正离子,会引起其他原花色素或者黄烷-3-醇以及半缩醛形式的花色苷的亲核攻击[45]。当亲核攻击分子为聚合度比较高的原花色素时,形成更高分子质量的原花色素。当攻击的分子为黄烷-3-醇单体或低聚原花色素时,形成的分子聚合度降低[22]。由于原花色素的水溶性随着聚合度的增大而降低,因此大分子的单宁会因沉淀而析出。当环境中含有较多黄烷-3-醇单体时,更多的原花色素被单体黄烷-3-醇攻击,平均聚合度降低。因此在红葡萄酒陈酿过程中,由于大分子的单宁逐渐沉淀和氧化降解,酒中的单宁含量逐渐减少。
黄烷-3-醇也会在含有醛基的物质的介导下参与聚合反应,如乙醛、乙醛酸(酒石酸的氧化产物)。首先,这些醛类物质通过异构和质子化后形成带有亲电性的半缩醛类,攻击黄烷醇C6或C8位亲电的碳原子;半缩醛脱水后形成带黄烷醇的碳正离子,进一步攻击其他黄烷醇分子或者花色苷半缩醛分子亲电的C6或C8位,形成聚合黄烷醇或者聚合花色苷[46-47],前者进一步脱水氧化成呫吨鎓[48-49]。该反应被认为是导致葡萄酒尤其是白葡萄酒颜色褐化的原因之一[50]。决定乙醛介导的黄烷-3-醇的聚合反应的因素有很多,主要包括底物尤其是乙醛的浓度、pH值。酒精的氧化会使葡萄酒中的乙醛含量保持稳定,从而使得反应持续不断地发生。此外pH值越低,质子化率越高,反应也就更容易进行[48]。
1.3 黄酮醇类物质
黄酮醇是葡萄酒中重要的一类酚类化合物,它来源于葡萄果皮,是植物组织为减少过度紫外线照射而产生的次生代谢产物[51]。黄酮醇类物质的最大吸收波长在325~400 nm范围内[2,52],为葡萄酒提供黄色色调。黄酮醇类物质具有C6-C3-C6的结构,区分依据为B环上不同的取代基(图7)。在欧亚种葡萄中,黄酮醇类物质主要有以下几种:杨梅酮、槲皮素、山柰酚、异鼠李亭、西伯利亚落叶松黄酮和丁香亭[53-54]。这几种黄酮醇C环C3位的羟基同时存在着糖苷化的形式,其中包括葡萄糖苷化、半乳糖苷化、鼠李糖苷化和葡萄糖苷酸化。和花色苷一样,这些糖苷化的形式都是在果实中被类黄酮-3-O-葡萄糖基转移酶催化形成[55]。黄酮醇的糖苷化形态往往是以3-O-葡萄糖苷为主,其次为3-O-半乳糖苷和3-O-葡萄糖苷酸;但槲皮素-3-O-葡萄糖苷酸含量比槲皮素-3-O-葡萄糖苷和槲皮素-3-O-半乳糖苷含量高[53],这些糖苷化上的羟基也可以被酰化[56]。在葡萄果实中,黄酮醇以糖苷化的形式存在,但在酿造过程中,糖苷会被酸解或酶解,因此在酒中也能检测到单体的存在[56-57]。黄酮醇是葡萄酒中三大类黄酮物质中含量最少的一类,其质量浓度在干红葡萄酒中通常低于100 mg/L[2]。在白葡萄酒中仅仅检测到槲皮素、山柰酚和异鼠李亭,这是白葡萄品种中催化黄酮醇B环上3号位和5号位羟基形成的羟化酶不表达的缘故[58]。红葡萄酒中能检测到多种黄酮醇类物质,其中以槲皮素类物质的含量最高[57]。
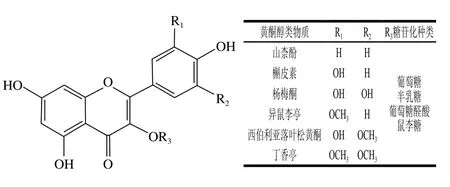
图7 葡萄与葡萄酒中黄酮醇类物质种类与结构[40]Fig. 7 Categories and structures of flavonols in wine grapes and wines[40]
黄酮醇是比较稳定的化合物,目前并没有发现黄酮醇参与聚合反应。被广为研究的是黄酮醇物质的辅色作用。在葡萄酒中,黄酮醇表现出了良好的辅色效果。黄酮醇物质之所以相对于其他酚类物质有着更好的辅色作用是因为它们特殊的分子平面结构:黄酮醇C环上的C2和C3位之间的双键提供了更广阔的π共轭体系,有利于色素-辅色素之间π-π堆积;平面分子结构避免了自身分子间氢键的结合;同时B环上的供电子基团(羟基和甲氧基)和C环C4位上吸电子基团(酮基)能够提供更强的色散力维持色素-辅色素复合物的稳定性[59]。
2 非类黄酮类物质
非类黄酮类物质是不具有类黄酮类C6-C3-C6结构的物质,按结构可以分为羟基苯甲酸类、羟基肉桂酸类和芪类物质,前两者又统称为酚酸。
2.1 羟基苯甲酸
羟基苯甲酸是具有C6-C1骨架的物质(图8)。常见的羟基苯甲酸类物质有没食子酸、龙胆酸、p-羟基苯甲酸、原儿茶酸、丁香酸、水杨酸和香草酸。这些物质主要以游离体的形式存在于葡萄酒中,同时也存在一些酯化类的衍生物[60]。其中没食子酸是葡萄中最主要的羟基苯甲酸类物质,其以单体形式或黄烷醇酯的形式存在于葡萄果实中。葡萄酒中的羟基苯甲酸类物质不仅来源于葡萄果实,在陈酿过程中橡木多酚的浸入也为葡萄酒提供了重要的酚类物质来源[61]。
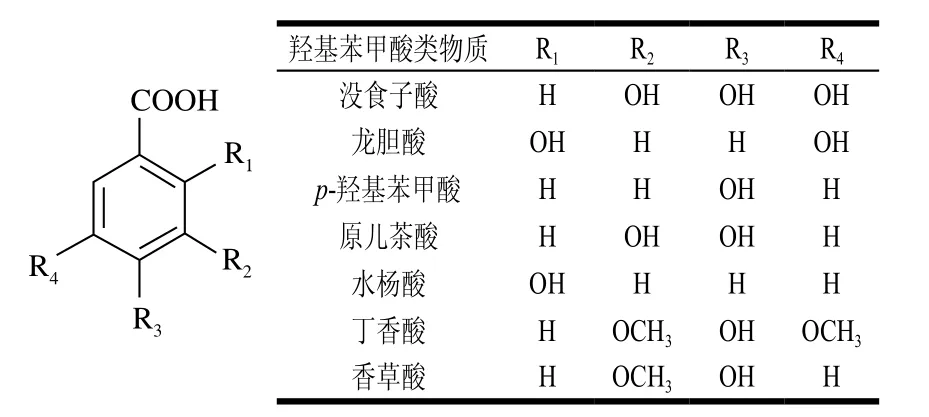
图8 葡萄与葡萄酒中羟基苯甲酸类物质的种类与结构[62]Fig. 8 Categories and structures of hydroxybenzoic acids in wine grapes and wines[62]
2.2 水解单宁
水解单宁包括没食子单宁和鞣花单宁,前者是由多元醇(葡萄糖或奎宁酸)和没食子酸酯化形成,后者是由多元醇和六羟基邻苯二酚酸(hexahydroxydiphenic acid,HHDP)酯化形成[63]。虽然被称为水解单宁,存在碳碳双键连接的HHDP结构的鞣花单宁并不能被完全水解[64]。水解单宁在葡萄和橡木中均有存在[65],被认为是能够保护葡萄酒颜色的重要的酚类物质之一[66]。
2.3 羟基肉桂酸
羟基肉桂酸是具有C6-C3骨架的物质(图9)。常见的羟基肉桂酸类物质有咖啡酸、对香豆酸、阿魏酸和芥子酸。在葡萄和葡萄酒中主要以酒石酸酯的形式位于葡萄皮和果肉细胞的液泡中[53],它们多以反式结构存在[67]。在这些肉桂酸中,咖啡酸酒石酸酯含量最高(高达肉桂酸总量的50%),其次是对香豆酸酒石酸酯和阿魏酸酒石酸酯[68]。葡萄酒中羟基肉桂酸含量跟葡萄的品种、地域、栽培和酿造时采取的工艺有关,通常在酒中的质量浓度约为100 mg/L。由于发酵工艺的差别,白葡萄酒中肉桂酸含量远低于红葡萄酒[69]。随着葡萄酒储存和陈酿,酒石酸酯化的羟基肉桂酸逐渐被水解,释放出更多游离的羟基肉桂酸[70]。
羟基肉桂酸属于非挥发性酚类物质,但在酵母的脱羧酶的作用下,可以转变为挥发性的乙烯基酚和乙基酚。例如,对香豆酸和阿魏酸的脱羧产物为4-乙烯基苯酚和4-乙烯基愈创木酚,这些挥发性酚类物质往往是在储存过程中由酒香酵母的脱羧酶催化羟基肉桂酸脱羧所产生[71]。由于红葡萄酒中高含量的多酚物质能够抑制脱羧酶的活性,这些挥发性酚类物质多出现在白葡萄酒中[72]。由于带有异味,挥发性酚含量往往是判断葡萄酒败坏的一个指标。
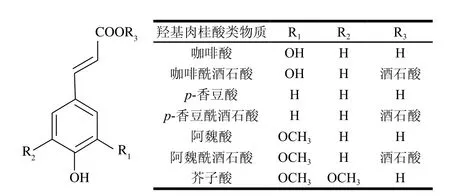
图9 葡萄与葡萄酒中羟基肉桂酸类物质的种类与结构[62]Fig. 9 Categories and structures of hydroxycinnamic acids in wine grapes and wines[62]
2.4 芪类
芪类是具有C6-C2-C6结构的酚类物质(图10),它包含两个被乙烯桥联的芳香环结构,主要存在于葡萄的叶片、果皮和根中,是葡萄受到外界胁迫(真菌感染、紫外照射)后的产物[40]。其中,最常见的芪类物质为反式白藜芦醇、葡萄素、紫檀芪、云杉新苷、白皮杉醇等。芪类物质中最著名的为白藜芦醇,其因显著的生物学活性[73]备受人们追捧。但由于其在葡萄和葡萄酒中含量极低,现在其营养学价值被广泛质疑[74]。

图10 葡萄与葡萄酒中的芪类物质的种类与结构[70]Fig. 10 Categories and structures of stilbenes in wine grapes and wines[70]
2.5 其他化合物
除了酚酸类和芪类物质,葡萄酒中还存在一些其他的非类黄酮类物质。如具有2 个C6-C3结构的木脂素和新木脂素已经在雷司令葡萄酒中检测出[75];具有苯并吡喃酮的香豆素既是橡木酚类物质中的组成[76]又可以以羟基肉桂酸类物质为底物被生物合成[53];具有C6-C2结构的苯乙醇的衍生物如3,4-二羟基苯乙醇(羟基酪醇)和4-羟基苯乙醇(酪醇)来源于发酵过程中微生物分解氨基酸[77]。与上述类黄酮类物质和酚酸类物质相比,这些物质的含量很低,在众多葡萄酒酚类物质中并不是研究热点。
3 葡萄酒中酚类物质的检测手段
3.1 葡萄酒中酚类物质的分离技术
葡萄酒尤其是红葡萄酒复杂的组成对酚类物质的分离和检测造成了巨大的困难。由于酚类物质的非挥发性和热不稳定性,葡萄酒中的多酚大都采用液相色谱技术进行分离。最初的对葡萄酒中酚类物质的检测方法只能依靠普通的色谱技术和紫外-可见光谱技术进行粗糙的分离和判断[78-80]。但是由于其分离度低,只能对其整体的含量进行粗略的估计。随着色谱技术的进步和发展,高效液相色谱技术(high performance liquid chromatography,HPLC)日趋成熟,已经成为分析葡萄酒中酚类物质必不可少的工具。自20世纪70年代末应用以来[81-84],色谱技术也衍生出了多个类型,近些年来一些分离技术也发生了进步,以下对这些分离类型和技术在葡萄酒酚类物质的分析上进行简要的介绍。
3.1.1 反相液相色谱
反相液相色谱(reversed phase liquid chromatography,RP-LC)是葡萄酒中多酚类物质分离最常见的技术,其主要特点为所使用流动相的极性大于固定相的极性。常见的反相色谱的固定相为十八硅烷基键合的C18颗粒,同时C8、C12和苯基或苯乙基键合也有使用,但相对较少。目前针对葡萄酒中不同种类酚类物质的RP-LC分析方法已有大量报道,如针对花色苷及其衍生物类物质[85-87]、黄烷醇类物质[88-91]、黄酮醇类物质[56,92-93]及酚酸类物质[94-98]的分离和检测技术。除了个别分析需求,RP-LC几乎是葡萄酒中常规酚类物质分析的首选手段。
3.1.2 正相液相色谱
正相液相色谱特点为流动相的极性小于固定相的极性,因此非极性有机溶剂常常作为正相液相色谱的流动相,也因为这个特点,正相液相色谱常常不作为分离方法的首选。在葡萄酒的酚类物质分析中很少采用正相液相色谱技术。但在葡萄皮或籽中的寡聚黄烷醇分离检测中正相液相色谱技术有一定的应用[42-43,99]。
3.1.3 亲水作用色谱
亲水作用色谱(h y d r o p h i l i c i n t e r a c t i o n chromatography,HILIC)类似于正相液相色谱,其固定相一般为极性较强的硅胶或者二氧化硅颗粒,但其分离机理和正相液相色谱不同,所采用的流动相组成和RP-LC类似[100]。此外HILIC还能够分离不易在RP-LC上保留的极性物质,以及离子交换色谱上保留的带电性不够强的物质。目前已有多篇关于HILIC技术应用于葡萄酒中多酚物质的报道[101-102],甚至有用于葡萄酒代谢组学的分析[103]。此外,由于分离原理的不同,HILIC和RP-LC互补的二维液相色谱(LC×LC或2D-LC)分离技术在葡萄和葡萄酒多酚类物质尤其是聚合多酚(聚合色素、单宁)的分离检测上也展现了极大的优势[104-106]。
3.1.4 体积排阻色谱
体积排阻色谱(size exclusion chromatography,SEC)是根据溶质分子大小进行分离的色谱技术,常见的有凝胶渗透色谱和凝胶过滤色谱[107]。其固定相为多孔的凝胶或者颗粒,分子质量不同的溶质在色谱柱中停留的时间也不同,从而达到不同分子质量物质分离的效果。分子质量较大的物质无法进入固定相的孔径,其洗脱路径较短,较早洗脱出来;分子质量小的物质,由于可以自由出入固定相的空间,其移动距离也相应变长,较晚被洗脱。通常对于摩尔质量较小的物质(小于5 000 g/mol)采用的SEC孔径在几十埃左右,而对于一些摩尔质量较大的物质(5 000~500 000 g/mol),孔径通常为数百埃[107]。SEC在葡萄酒酚类物质的分析上应用较为有限,仅限于高分子质量的单宁类物质[88]和聚合色素[108],而在小分子单体酚类物质如花色苷、黄酮醇和酚酸的分离中并不适用。
3.1.5 逆流色谱
逆流色谱(countercurrent chromatography,CCC)或者高速逆流色谱(high-speed CCC,HSCCC)与常规柱色谱的分离原理不同,其固定相和流动相为互不相溶的溶剂,依靠离心力场建立起的液-液间快速分配达到溶质的分离[109]。因为不需要固定相,CCC避免了固定相颗粒对样品的不可逆吸附[110]。此外,CCC不需要使用价格昂贵的固体填料色谱柱,也不需要进行分析前预平衡,节约了溶剂,常被用来做制备型分析,尤其在天然产物和制药上的分析[110]。CCC在葡萄酒酚类物质分析上也有应用,如黄烷醇和花色苷的分析[111-113]、酚酸类物质的制备分析[114]。但是上述分析都需要对葡萄酒样品进行预处理(粗分离或者提取溶解),而葡萄酒本身则在常规HPLC上可以直接进样分析,CCC需要预处理这一特点则使得其在葡萄酒酚类物质的分析应用上受到限制。
3.1.6 超高效液相色谱
超高效液相色谱(ultrahigh pressure liquid chromatography,UHPLC)是在HPLC的基础上发展出来的能够达到更加快速和高通量分析的技术。塔板理论认为更小的固定相粒径能够减少范德姆特方程中的A项(涡流扩散项)和C项(传质阻力项),从而降低塔板高度,提高塔板数[115]。同时,为了减小径向扩散,色谱柱的内径也需要减小。这种类型的超高液相色谱柱(亚2微米粒径,2.1 mm内径)的使用会显著提升色谱系统的背压,因而在传统HPLC系统中无法耐受(40 MPa),因此压力耐受更高的UHPLC系统(130 MPa)应运而生。同时,UHPLC可以耐受较高的流速,也就意味着可以缩短分离时间。相同的分离度下,UHPLC的分离速度是HPLC的2~9 倍,而同样的时间下,UHPLC的分离效率约是普通HPLC色谱柱(250 mm,5 μm)的2.4 倍[116]。目前采用UHPLC分析葡萄酒中的酚类物质已经有广泛报道[117-122]。尽管UHPLC有着高通量和高速的分析特点,但其仪器成本较高,在一些小型实验室并不适用,因此一些列色谱柱被陆续开发出来弥补HPLC在压力上限上的缺陷,如核壳柱[123-124]或者整体柱[125]。这两个类型的色谱柱均在固定相的物理特性上做出了改变,从而提高了流动相的穿透性而减少背压。而核壳柱的柱效被认为是高于整体柱的,且更适用于串联质谱分析[116]。对于这两个类型的色谱柱已有多篇文章对其原理和应用进行了综述[126-129],这里不过多介绍。
3.1.7 二维液相色谱
LC×LC技术是通过增加一个分离维度,对第一维度下未分开的组分进行再次分离的技术。在一维液相色谱中,即便是UHPLC对一些复杂基质中的物质分离能力也有限。峰容量是衡量一个色谱系统分离能力的指标,其基本定义为在指定体系和条件下,一定时间内色谱柱理论上能分离出达到一定分离度的色谱峰的数目[130]。如对芦丁在梯度洗脱的测试结果表明,对于UHPLC来说其峰容量约为700(HPLC为420)[131],远不足复杂基质中分析物的数目。而LC×LC的理论上峰容量可以达到两个峰容量的乘积。尽管在实际上还达不到这个数值,但是相对于传统液相色谱,其分离能力可以得到显著提高[116]。为达到更高效的分离,LC×LC常采用两个分离原理不同的技术(即所谓的正交),如RP-LC×HILIC,或者SEC×RP-LC。LC×LC在葡萄或葡萄酒酚类物质的分析上已有应用[104-105,132-135],但由于仪器设备的高成本,其只限于高精度和高通量的精细分析,而并不适用于葡萄酒中酚类物质的常规分析。
3.2 葡萄酒中酚类物质的检测技术
3.2.1 光谱检测技术
在液相色谱中对葡萄酒酚类物质检测的常见光谱检测器有变波长检测器、二极管阵列检测器(diode array detector,DAD)和荧光检测器。其原理均为根据不同分析物的吸收光谱特性来检测,如花色苷及其衍生物的红色波段吸收(波长520 nm)、黄酮醇类物质的黄色波段吸收(波长360 nm)、酚类物质共有的紫外波段吸收(波长280 nm)以及黄烷-3-醇类物质的荧光吸收特点[136]。此外,DAD还具有全波长扫描的功能,可以对某一痕量物质的光谱特性进行记录。但由于HPLC技术并不能完全分离一些保留因子极其相似的物质(如酚基型吡喃花色苷),上述检测器并不能根据分析物的光谱特性区分共流出的色谱峰。目前光谱检测器能够做到对葡萄和葡萄酒中主要的酚类物质进行定性定量分析[137-142],可以满足一般的分析要求,至于痕量物质或者难分离物质的分析,则需要引入质谱检测器。
3.2.2 质谱检测技术
质谱检测器的出现使得即便是色谱上未完全分离的物质也能够根据其质荷比被完全监测。目前在酚类物质分析领域(不限于葡萄酒)常用的质谱仪包括低分辨质谱如离子阱、三重串联四极杆,高分辨质谱仪如飞行时间质谱仪或四极杆飞行时间质谱仪、傅里叶变换离子回旋共振质谱仪(Fourier transform ion cyclotron resonance,FT-ICR)、轨道阱质谱仪或四极杆轨道阱质谱仪[116]。目前在葡萄以及葡萄酒多酚领域,应用较多的还是离子阱、三重串联四极杆以及四极杆飞行时间质谱仪[123,139,143-144]。在多酚物质的分析上,质谱常配备的离子源类型为大气压电离源,如电喷雾离子源(electrospray ionisation,ESI)[124]、大气压化学电离源[145]、基质辅助激光解析电离源[146-147]以及快原子轰击源[148],其中ESI的应用最为广泛。ESI的电离方式属于“软电离”,即仅在目标分析物上加上正电荷(如H+、Na+、NH4+或丢失电子)或者负电荷(e-、Cl-、HCOO-或丢失质子),并不碎裂分子,使得酚类物质质量信息能够清楚地展现。同时,通过碰撞诱导解离可以获得检测物质的二级质谱信息,能够大大增加定性的准确性。对于不同的酚类物质,目前已经总结出了大量二级质谱的碎裂规律[149-150]。串联质谱技术极大地增强了葡萄酒多酚分析的可靠性和灵敏度,离子阱质谱仪的多级质谱功能和三重串联四极杆中的多反应监测模式已经成为常规的定性定量手段。但由于上述两种仪器分辨率的缺陷,无法对痕量物质和具有相同质荷比的同分异构体进行区分,因此在酚类物质更深入的研究上应用仍然有限。而高分辨质谱仪的应用如四极杆飞行时间质谱仪和FT-ICR也为葡萄酒中未知酚类物质的鉴定,以及新品种中酚类物质的筛选提供了有力的手段[151-154]。
3.3 其他技术
由于非挥发的特性,气相色谱质谱联用技术在葡萄酒中多酚物质的检测上应用很少。此外,即使通过衍生手段增加挥发性,由于电子轰击离子源所带来的“硬电离”的效果,多酚物质的定性效果往往不佳。虽然有过尝试[155],但因为其操作和结果的复杂性极少采用气相色谱质谱的手段进行检测。
核磁共振技术(nuclear magnetic resonanc,NMR)在多酚的结构鉴定方面应用的比较广泛。在葡萄酒中NMR已经被用来鉴定某些糖苷态类黄酮物质中糖苷或者酰化糖苷的位置构象[156],以及确定一些辅色状态分子构象[157-158]。但是准确的NMR结构鉴定需要一定纯度和浓度的样品,这使得葡萄酒中的一些低含量、难分离的酚类物质仍然得不到准确的结构式。即使一些LC-NMR技术已经被开发出来并取得了一些应用[159],但是其高昂的成本也使得其在葡萄酒分析领域非常有限。
4 结 语
葡萄酒中主要的酚类物质有两大类:类黄酮类物质和非类黄酮类物质。前者包括了花色苷及其衍生物、黄烷醇类物质、黄酮醇类物质,后者包括了羟基苯甲酸、羟基肉桂酸、芪类物质和其他一些低含量的酚类物质。这些酚类物质是葡萄酒风味物质的重要组成部分,液相色谱、质谱是葡萄酒中多酚物质分析检测的最主要的手段。
综上所述,由于葡萄酒愈发受到国内消费者追捧,其复杂的酚类体系也成为了许多研究热点。结合目前的研究现状,有关葡萄酒多酚风味化学方向仍有许多挑战,如对于大分子单宁和聚合色素的检测方法仍不完善,其对葡萄酒风味的贡献也缺乏足够的报道;葡萄酒中酚类物质的演变和反应机制仍缺乏直接有效的证据;多酚类物质之间的互作机制(分子间的共价反应和非共价相互互作)及其对葡萄酒感官的贡献尚不明晰;我国本土一些葡萄品种的多酚组成和调控合成机制鲜见报道。解决这些问题,需要引入精确的仪器和先进的技术、培养专业的人才、将感官品评和检测技术相结合。葡萄酒中酚类物质的风味化学是一门涉及多学科的交叉学科,既需要人才的培养又需要仪器的进步。而我国在此方面起步较晚、基础较差,虽然有了较大的进步,但是对于上述葡萄酒多酚风味化学的研究还不够深入。因此,建立起系统的葡萄酒酚类物质风味化学的学科群、完善葡萄酒化学科研队伍体系是开拓我国葡萄酒研究发展的关键。

