基于分子标记技术的苦瓜育种材料遗传多样性快速分析
王国莉
(惠州学院 生命科学学院,广东 惠州 516007)
苦瓜(MomordicacharantiaL.)是葫芦科苦瓜属1年生攀缘草本,主要分布于热带、亚热带和温带地区[1-2]。苦瓜是一种药食两用植物,在中国及世界其他国家都有药用历史[3-5]。苦瓜的形态学分类可以依据栽培方式[6]、果皮颜色以及果实大小等标准进行。张长远等[7]依据瓜的大小和瓜瘤形状,把苦瓜分为麻点苦瓜和滑身苦瓜。黄月琴[8]根据瓜形将苦瓜分为长棒形、短棒形、棒形、圆锥形、纺锤形5类。张凤银等[9]从形态学上研究44份苦瓜的26个性状发现,它们的果形、果色、单瓜种子数、瓜瘤大小和单瓜质量差异大。黄如葵等[10]通过对33份苦瓜28个形态学性状的聚类分析,将所有材料分为3大类群。黄月琴等[11]从表型性状上分析46份苦瓜的31个性状,得出变异系数为5.39%~89.96%,并将其归为4大类群。张燕等[12]采用调查和多元统计分析相结合的方法,对51份苦瓜材料进行分析,发现23个性状的变异系数为5.88%~47.90%,并指出其性状和果实品质有关联,聚类分析将51份苦瓜分为5大类群。虽然从形态学上分析苦瓜的遗传多样性具有经济简单的优点,但这种方法也需要耗费大量的时间和精力,而且季节因素、环境因素、栽培方法以及观察者的实际经验也会影响结果的准确性。所以单纯利用形态学指标并无法准确揭示不同苦瓜材料间的差异性以及遗传规律。
目前,分子标记技术已经在遗传育种、遗传多样性分析、基因组作图、物种鉴定等方面广泛应用,多种分子标记技术被应用于包括苦瓜在内的葫芦科植物的遗传分析中。汪自松[13]应用简单序列重复(Simple sequence repeats,SSR)、序列相关扩增多态性(Sequence related amplified polymorphism,SRAP)和扩增片段长度多态性(Amplified fragment length polymorphism,AFLP )3种分子标记技术,构建了苦瓜子二代的遗传图谱。王莎[14]开发出400对瓠瓜SSR引物,并从中筛选出200对,对苦瓜、丝瓜、南瓜和西瓜进行PCR扩增以及亲缘关系的比较分析。杨衍等[15]选用8对AFLP引物对36份苦瓜进行PCR扩增,共扩增出1 142条条带,多态性条带992条,说明供试苦瓜的变异性强,聚类分析将36份苦瓜分为2个类群。SRAP作为一种新型的分子标记具有很多优点,现已被应用到遗传多样性分析和品种鉴定等方面[16]。张景云等[17]应用SRAP和SSR标记技术分析了46份苦瓜的遗传多样性,遗传相似系数为0.656时,可将供试苦瓜分为4大类。赵秀娟等[18]用61对SRAP引物将43份苦瓜分为2大类群。刘萌芽等[19]采用正交设计试验优化了苦瓜SRAP-PCR的反应体系。SSR技术现已被广泛应用到物种的鉴定、基因组作图、遗传多样性分析等方面。WANG[20]设计出33对SSR引物用来扩增37份供试苦瓜,最后开发出12对SSR引物,共扩增出36条条带,平均每对引物扩增3条。王心迪等[21]用正交分析法优化了苦瓜SSR标记的PCR反应体系。王国莉等[22]应用SSR和SRAP技术鉴别苦瓜品种,采用8对SSR引物对11个苦瓜品种进行扩增,共扩增出860条带,多态性条带比率为68.0%,最少用3对SSR引物即可区分出11个苦瓜品种。李光光等[23]应用SSR和SRAP标记分析46份苦瓜种质资源遗传多样性,分别扩增出70、637条条带,多态性条带分别为60、90条,表明供试苦瓜具有丰富的遗传多样性,并将其归为4类。
虽然已有研究对SSR和SRAP分子标记技术的反应体系进行了优化,并将其应用于苦瓜材料的遗传多样性分析和品种鉴定中[19-23],但如何高效和即时分析苦瓜育种材料的亲缘关系和遗传多样性,依然是分子标记辅助苦瓜育种的重要研究课题。鉴于此,采用一管式植物DNAout试剂盒法,从苦瓜种子中快速提取基因组DNA,并采用11对SSR引物和13对SRAP引物分别对10份苦瓜材料基因组进行PCR扩增,并对苦瓜材料的遗传多样性进行分析,为实现分子标记辅助选择苦瓜育种提供借鉴。
1 材料和方法
1.1 试验材料
供试10份苦瓜材料均来源于广东惠州市农业科学研究所苦瓜种质资源库,种植于惠州学院山晖园,2017年11月收种完毕,材料信息见表1。
1.2 方法
1.2.1 苦瓜基因组DNA的快速提取 采用一管式植物DNAout试剂盒(Andy Bio公司)提取苦瓜种子的基因组DNA。该方法快速提取的DNA不能用电泳方法检测,只能作为PCR反应扩增模板。在离心管中加入0.1 mL 37 ℃恒温下已经完全溶解的溶液A。将苦瓜种子捣碎,取一碎片(约1/4粒豌豆大小)加入离心管中。将离心管置于95 ℃下保温10~15 min,保温时间一定要足够,否则易产生非特异性扩增。保温结束后不用离心,直接取上清液作为模板进行PCR反应,模板的体积占PCR反应体积的1/10为宜。剩余样品置于4 ℃保存。
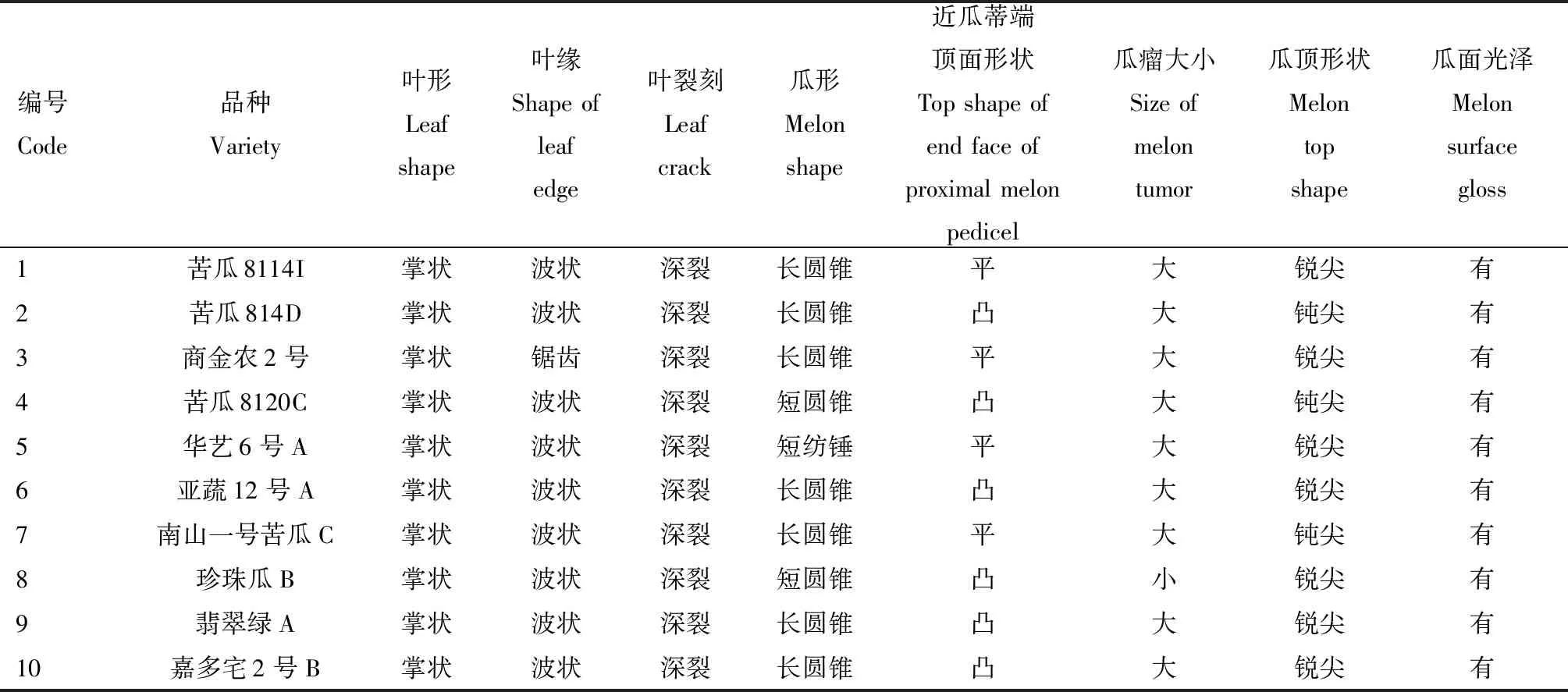
表1 供试苦瓜材料信息
1.2.2 苦瓜SSR-PCR反应体系 SSR-PCR体系参照WANG[20]和王国莉等[22,24]建立的体系,并进一步优化而成,PCR体系25 μL,成分及用量见表2。
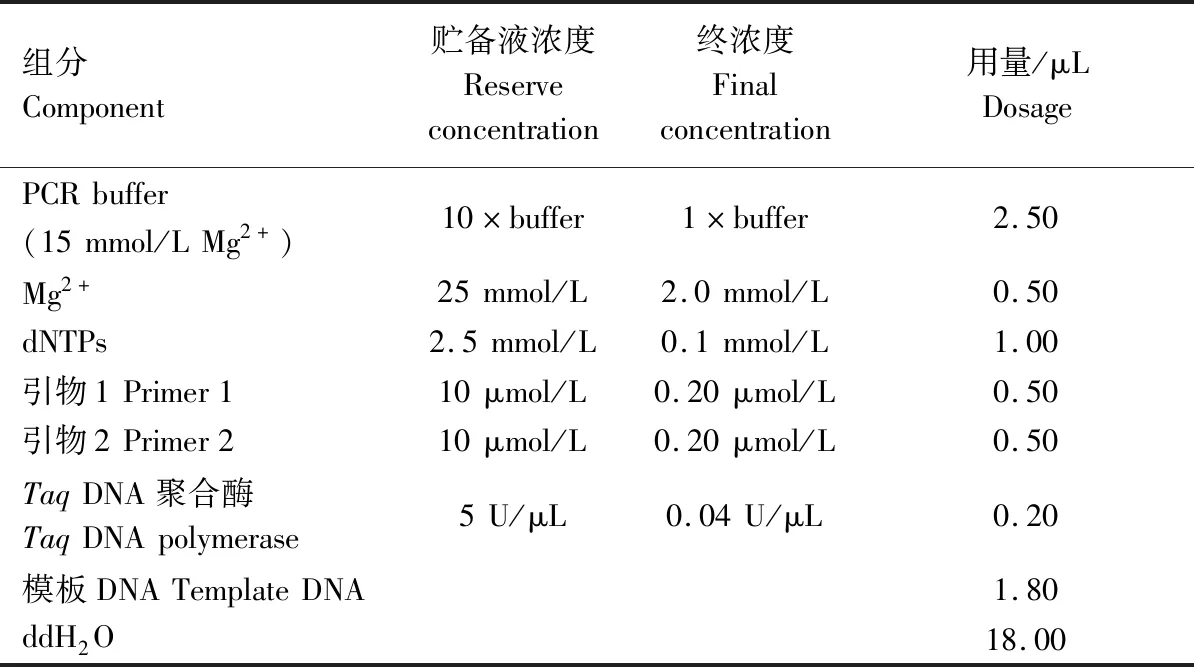
表2 苦瓜SSR-PCR反应体系
PCR扩增程序:94 ℃变性4 min;94 ℃变性40 s,55 ℃退火45 s,72 ℃延伸40 s,35次循环;72 ℃延伸7 min;4 ℃保存[22]。
1.2.3 苦瓜SRAP-PCR反应体系 SRAP-PCR体系参照王国莉等[22,24]建立的体系,并进一步优化而成,PCR反应体积25 μL,成分及用量见表3。
PCR扩增程序:94 ℃变性5 min;94 ℃变性1 min、35 ℃复性1 min、72 ℃延伸1 min,5次循环;94 ℃变性1 min、50 ℃复性1 min、72 ℃延伸 1 min,35次循环;72 ℃延伸10 min;4 ℃保存[22]。
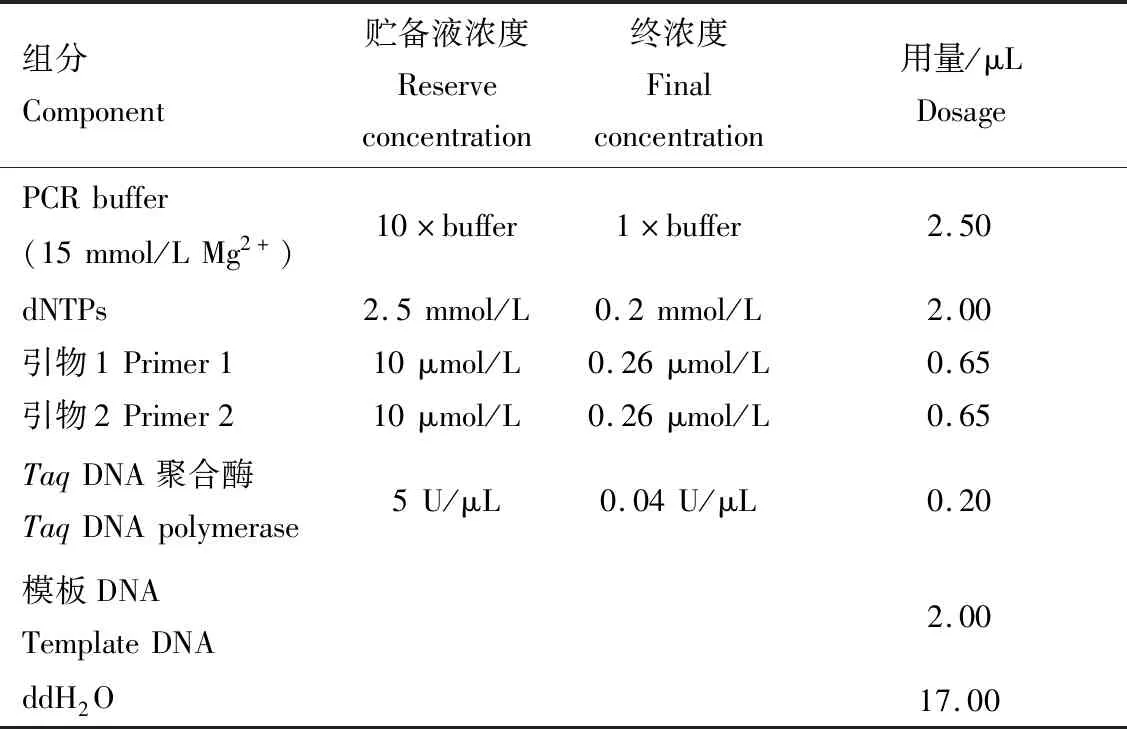
表3 苦瓜SRAP-PCR 反应体系
1.2.4 SSR标记扩增引物 SSR标记扩增引物参照WANG[20]设计的引物序列,11对SSR引物序列如表4所示。
1.2.5 SRAP标记扩增引物 13对SRAP标记扩增引物组合和序列如表5所示。
1.2.6 PCR产物的检测 选用6%聚丙烯酰胺凝胶电泳分离PCR产物,0.1% AgNO3溶液染色,显色后拍照记录结果。
1.3 数据处理
电泳得到的条带代表基因位点,采用二元性状对每一个基因位点进行编码,用“1”表示等位基因存在,用“0”表示等位基因不存在,形成矩阵。
利用软件NTSYS-pc2.10e计算供试苦瓜材料之间的遗传相似系数并进行聚类分析。

表4 SSR标记扩增引物

表5 SRAP标记扩增引物
2 结果与分析
2.1 SSR和SRAP标记的扩增结果
采用一管式植物DNAout试剂盒法,可以从苦瓜种子中快速提取基因组DNA,相比于CTAB(十六烷基三甲基溴化铵)、SDS(十二烷基苯磺酸钠)等传统的DNA提取方法,提取步骤简单、耗时短,在1个离心管内,只需20 min左右即可提取完毕。但是,该方法提取的DNA因浓度较低不适宜直接用电泳检测,所以浓度存在未知性。
2.1.1 SSR标记扩增结果 部分SSR引物扩增结果见图1。从图1可知,扩增条带的分子质量主要介于100~1 000 bp。利用11对SSR引物扩增10份苦瓜材料并进行条带统计,结果见表6。从表6可知,11对SSR引物共扩增出195条条带,其中,多态性条带164条,每对引物扩增的条带数介于12~28条不等,平均每对引物扩增17.7条,各对引物扩增的条带多态性比率介于66.7%~100.0%,平均多态性条带比率为85.7%,说明SSR分子标记的多态性较高。N6F/N6R扩增出22条多态性条带,数量最多;S9F/S9R扩增出的多态性条带最少,只有10条。扩增出多态性条带比率最高的引物对为N1F/N1R、N5F/N5R和S24F/S24R,均为100.0%;扩增出多态性条带比率最低的引物组合为S33F/S33R,仅为66.7%。
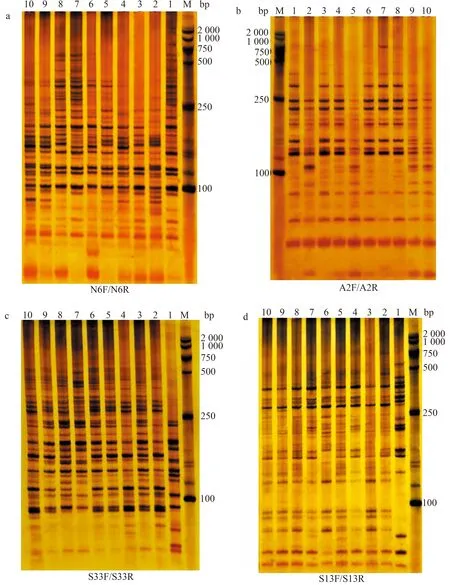
数字1—10代表苦瓜材料编号(表1),图2—5同;M.DL2000 DNA marker;a、b、c、d分别代表不同引物的扩增结果,图2同
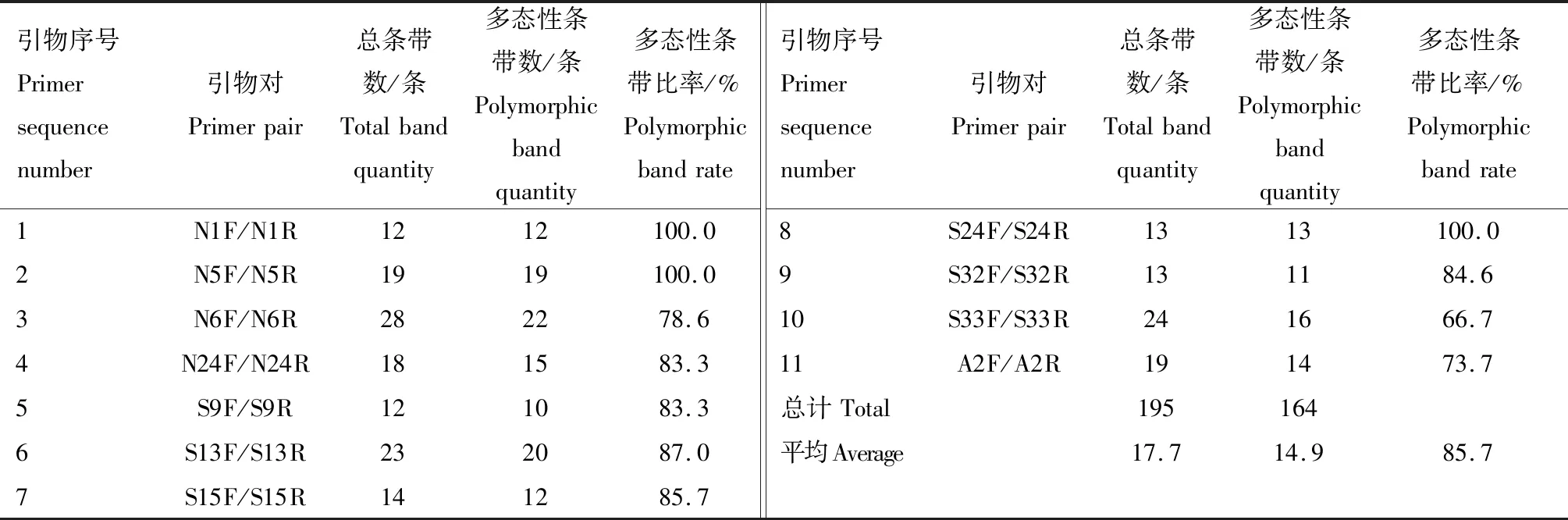
引物序号Primersequencenumber引物对Primerpair总条带数/条Totalbandquantity多态性条带数/条Polymorphicbandquantity多态性条带比率/%Polymorphicbandrate引物序号Primersequencenumber引物对Primerpair总条带数/条Totalbandquantity多态性条带数/条Polymorphicbandquantity多态性条带比率/%Polymorphicbandrate1N1F/N1R1212100.08S24F/S24R1313100.02N5F/N5R1919100.09S32F/S32R131184.63N6F/N6R282278.610S33F/S33R241666.74N24F/N24R181583.311A2F/A2R191473.75S9F/S9R121083.3总计Total1951646S13F/S13R232087.0平均Average17.714.985.77S15F/S15R141285.7
2.1.2 SRAP标记扩增结果 部分SRAP引物扩增结果见图2。由图2可知,扩增条带的分子质量主要介于100~1 000 bp。利用13对SRAP引物扩增10份苦瓜材料并进行条带统计,结果见表7。从表7可知,13对SRAP引物共扩增出231条条带,其中,多态性条带201条,每对引物扩增的条带为13~23条,平均每对引物扩增17.8条,各对引物扩增的条带多态性比率介于73.9%~100.0%,平均多态性条带比率为87.5%,说明SRAP分子标记的多态性较高。me9/em11引物组合扩增出20条多态性条带,多态性条带数量最多,且多态性比率也最高,为100.0%;me5/em1和me6/em1引物组合仅扩增出12条多态性条带,数量最少;多态性条带比率最低的引物对为me9/em14,仅为73.9%。
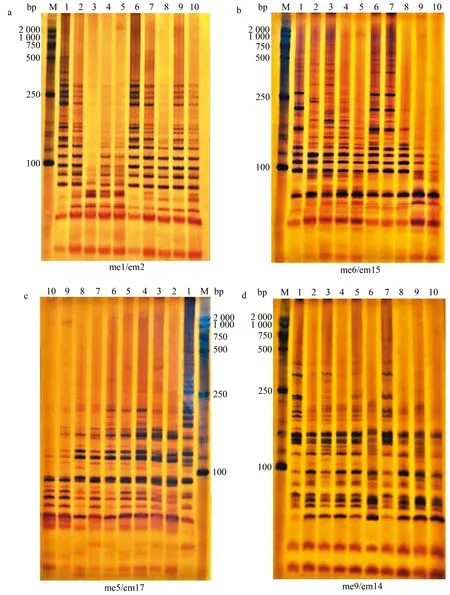
图2 SRAP标记扩增结果
以上结果说明,采用优化后的SSR和SRAP反应体系对苦瓜材料进行扩增,均能获得丰富的多态性条带,说明此方法可以用于快速分析苦瓜的遗传多样性,提高分子标记辅助选择的效率。
2.2 苦瓜材料的遗传多样性分析
2.2.1 基于SSR标记的苦瓜遗传多样性分析
2.2.1.1 遗传相似系数 对SSR标记的扩增结果进行分析计算,得到10份苦瓜材料的遗传相似系数,结果见表8。从表8可以看出,10份苦瓜材料的遗传相似系数介于0.533~0.845,平均为0.690。苦瓜8114I(品种1)和苦瓜814D(品种2)的遗传相似系数最小,为0.533;翡翠绿 A(品种9)和嘉多宅2号B(品种10)的遗传相似系数最大,为0.845。

表7 SRAP引物扩增信息
2.2.1.2 聚类分析 如图3所示,在阈值0.69处,可将10份苦瓜育种材料分为2大类群。第1类群有6个材料:苦瓜8114I(品种1)、商金农2号(品种3)、华艺6号A(品种5)、亚蔬12号A(品种6)、珍珠瓜B(品种8)、南山一号苦瓜C(品种7),此大类除南山一号苦瓜C的瓜顶形状为钝尖外,其余都为锐尖,除珍珠瓜B外,瓜瘤大小都表现为大瓜瘤。第2类群包含4个材料:苦瓜814D(品种2)、翡翠绿A(品种9)、嘉多宅2号B(品种10)、苦瓜8120C(品种4),此大类叶形均为掌状,叶缘呈波状,叶裂刻为深裂,瓜面有光泽。
在阈值0.75处,又可将第1类群和第2类群都归为3个亚类。第1类群的苦瓜8114I为第1亚类;商金农2号和华艺6号A为第2亚类,其遗传相似系数为0.751;第3亚类包含亚蔬12号A、珍珠瓜B和南山一号苦瓜C,而南山一号苦瓜C又与其他2个品种的亲缘关系较远。第2类群的第1亚类为苦瓜814D;第2亚类包含翡翠绿A和嘉多宅2号B,其遗传相似系数高达0.845,亲缘关系非常相近;苦瓜8120C单独为第3亚类。
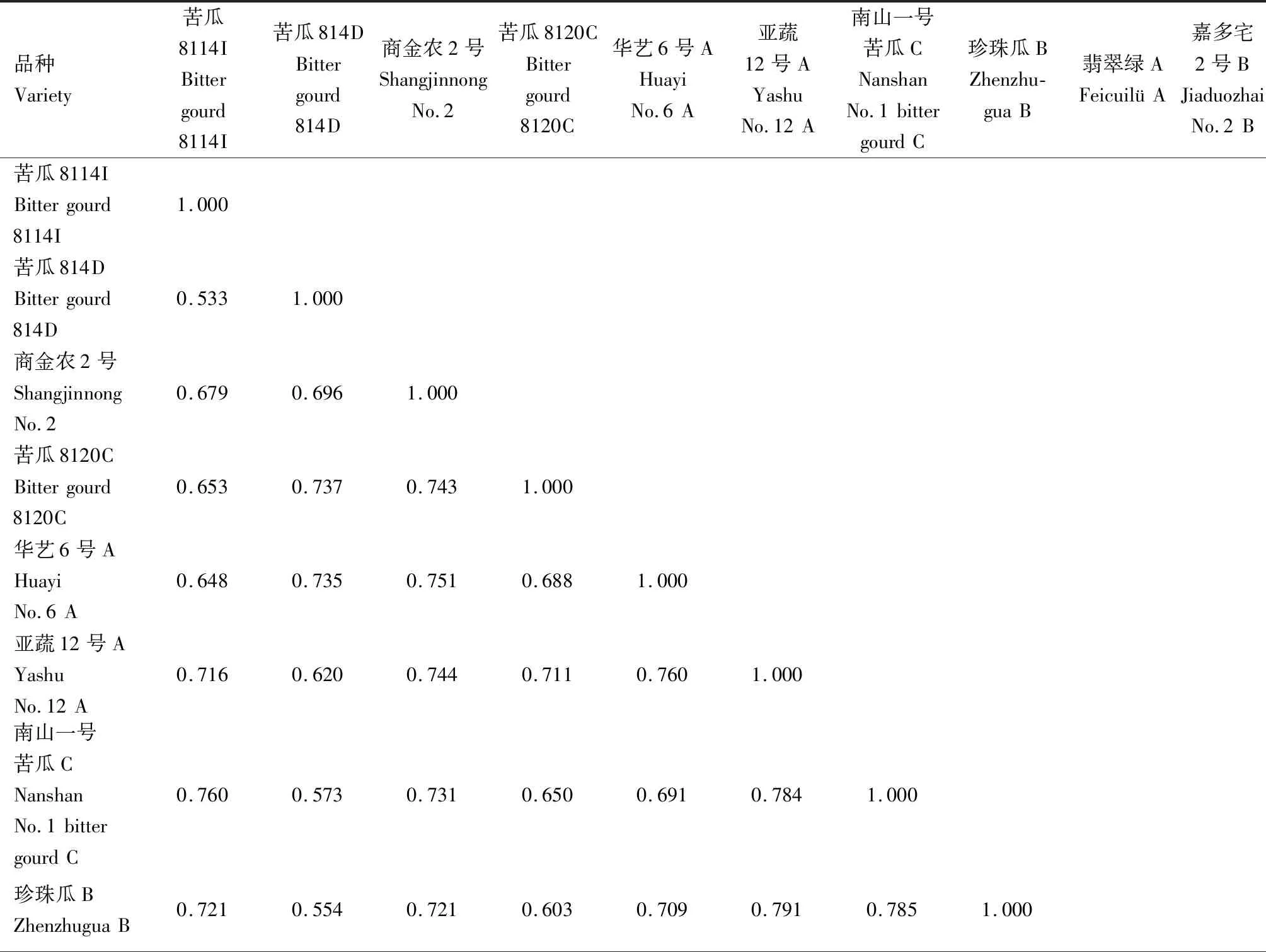
表8 基于SSR标记的苦瓜材料遗传相似系数

续表8 SSR标记的苦瓜材料遗传相似系数
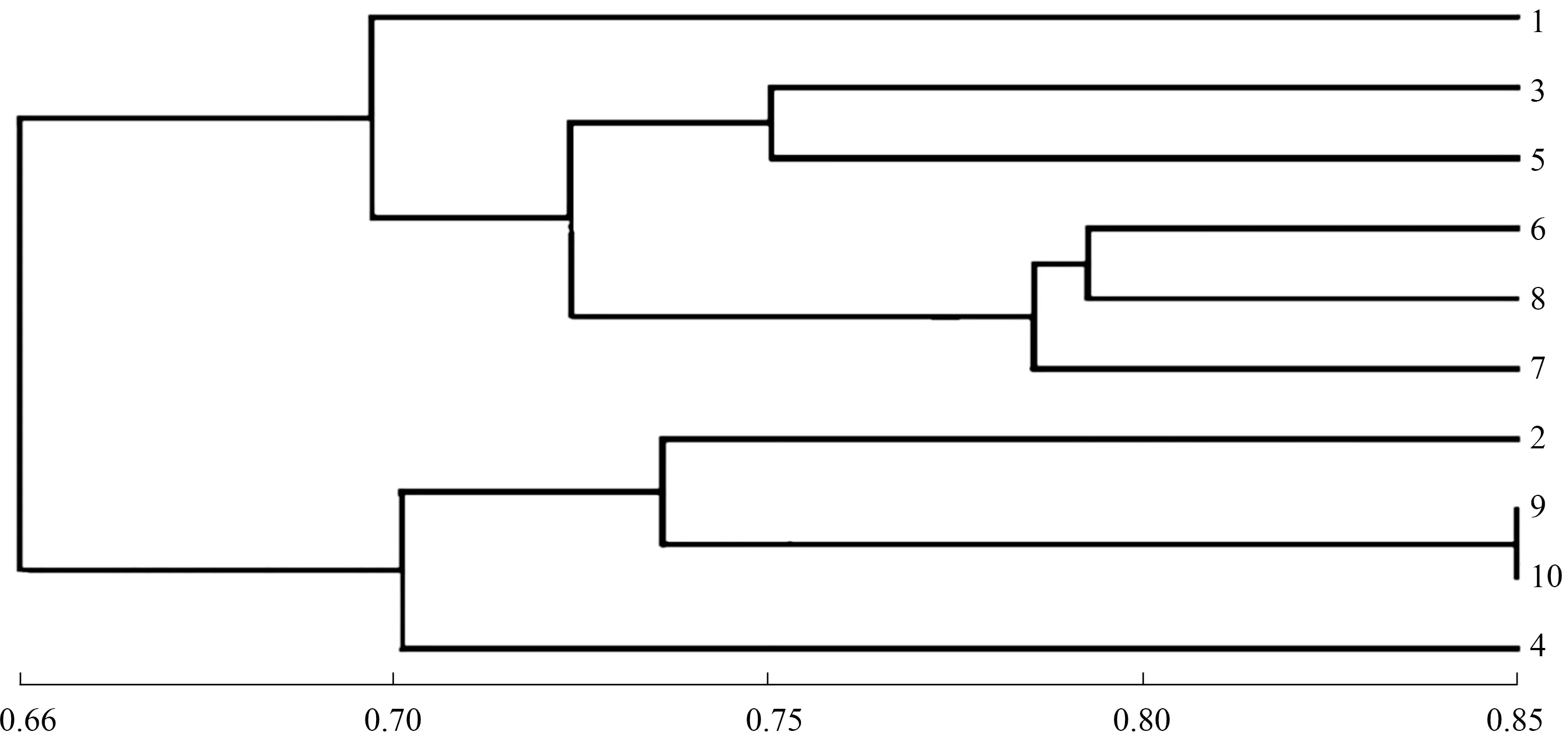
图3 10份苦瓜材料的SSR聚类分析
2.2.2 基于SRAP标记的苦瓜遗传多样性分析
2.2.2.1 遗传相似系数 对SRAP标记的扩增结果进行分析计算,得到10份苦瓜材料的遗传相似系数,结果见表9。从表9可以看出,10份苦瓜育种材料的遗传相似系数介于0.554~0.775,平均值为0.662。苦瓜8114I(品种1)和苦瓜814D(品种2)的遗传相似系数最小,为0.554;翡翠绿A(品种9)和嘉多宅2号B(品种10)的遗传相似系数最大,为0.775。
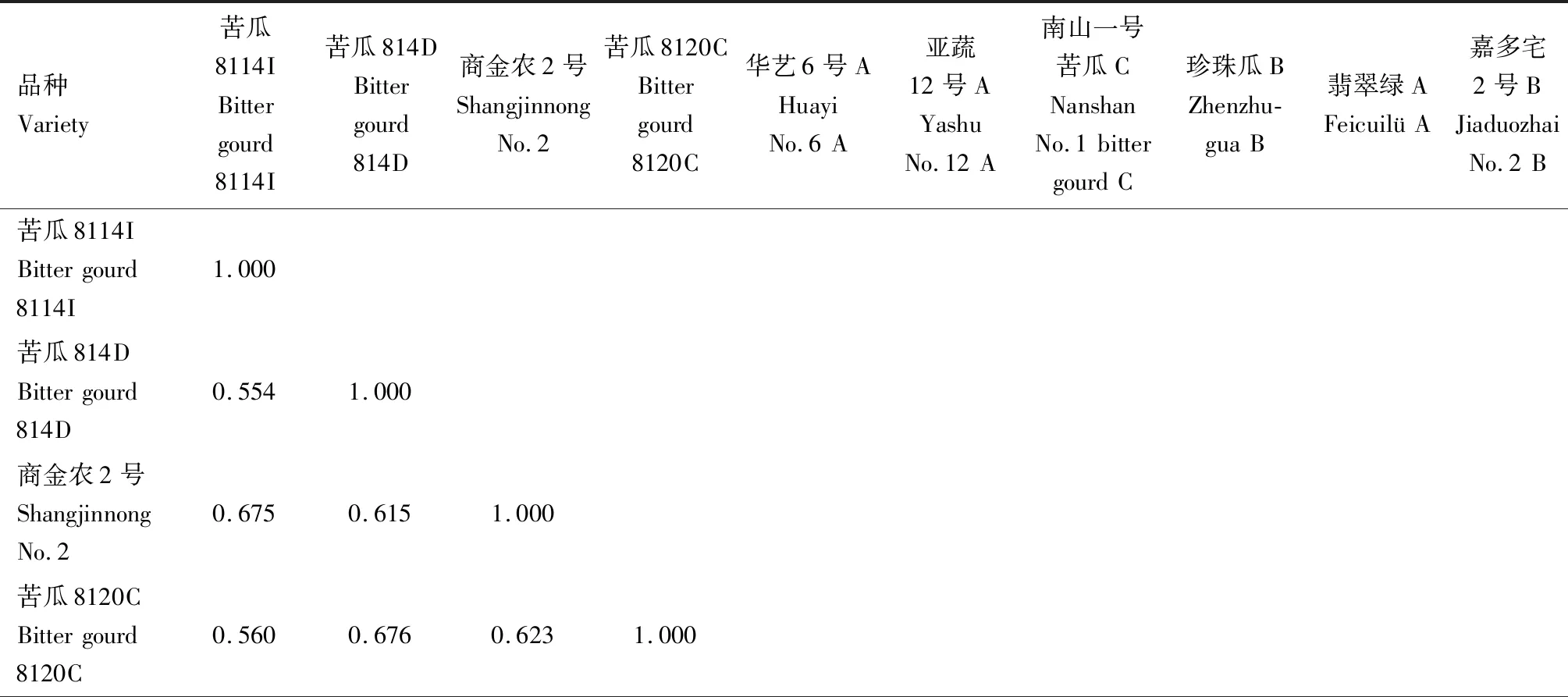
表9 基于SRAP标记的苦瓜材料遗传相似系数

表9 SRAP标记的苦瓜材料遗传相似系数
2.2.2.2 聚类分析 经过聚类分析,建立了基于SRAP的苦瓜材料之间的遗传关系树状图,结果如图4所示。由图4可以看出,在阈值0.66处,可将10份苦瓜育种材料归为2大类群。第1类群包含苦瓜8114I(品种1)、南山一号苦瓜C(品种7)和商金农2号(品种3),其中,商金农2号与该类群其他2个品种的亲缘关系较远,此大类瓜瘤稀疏、大,且瓜瘤呈条状,近瓜蒂端瓜面形状平,瓜形为长圆锥;第2类群包含苦瓜814D(品种2)、苦瓜8120C(品种4)、华艺6号A(品种5)、亚蔬12号A(品种6)、珍珠瓜B(品种8)、翡翠绿A(品种9)、嘉多宅2号B(品种10),此大类叶色深绿,掌状叶,叶裂刻为深裂。
在阈值0.70处,第1类群又可分为2个亚类,第1亚类包含苦瓜8114I、南山一号苦瓜C,其遗传相似系数为0.705;第2亚类仅有商金农2号。遗传相似系数为0.70时,第2类群可归为4个亚类,苦瓜814D单独为第1亚类;苦瓜8120C和华艺6号A聚为第2亚类;亚蔬12号A和珍珠瓜B为第3亚类,遗传相似系数达到0.770;第4亚类包含翡翠绿A和嘉多宅2号B,遗传相似系数高达0.775。
2.2.3 综合SSR和SRAP标记分析苦瓜材料的遗传多样性 采用2种标记综合分析10份苦瓜材料的遗传多样性结果见表10和图5。从遗传相似系数上看,SSR标记技术得到的遗传相似系数在0.533~0.845,平均值为0.690;SRAP标记技术得到的遗传相似系数在0.554~0.775,平均值为0.662。可见SSR检测的遗传距离变异幅度比SRAP大。结合SSR和SRAP 2种标记技术分析发现,遗传相似系数介于0.554~0.808,与两者单独分析得到的结果非常接近。SSR和SRAP标记技术均检测出亚蔬12号A和珍珠瓜B、翡翠绿A和嘉多宅2号B 2组品种间的遗传相似系数较大,这与两者综合分析的结果是一致的,其中翡翠绿A和嘉多宅2号B的遗传相似系数最大(SSR为0.845,SRAP为0.775),亲缘关系最接近;且2种标记技术都检测到苦瓜8114I和苦瓜814D的遗传相似系数最小(SSR为0.533,SRAP为0.554),亲缘关系最远,同样地,对表10中SSR和SRAP综合分析得出了相同的结论。
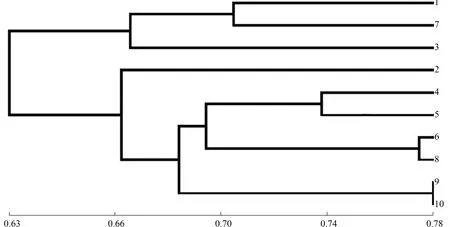
图4 10份苦瓜材料的SRAP聚类分析Fig.4 Cluster analysis of 10 bitter gourd materials based on SRAP marker
从聚类结果看,SSR和SRAP标记技术的聚类结果有相同之处,在阈值0.66处,苦瓜8114I、商金农2号和南山一号苦瓜C均聚为一类,苦瓜814D、苦瓜8120C、翡翠绿A和嘉多宅2号B这4个品种也聚为一类,而且亚蔬12号A和珍珠瓜B聚为一个亚类,翡翠绿A和嘉多宅2号聚为一个亚类,充分说明这些苦瓜品种之间存在相似的遗传背景。SSR和SRAP技术综合分析得出的结论与每种标记单独分析的结果一致,说明应用SSR和SRAP技术分析苦瓜的遗传多样性具有较高的一致性与可信度。但2种标记的聚类结果也存在差异,在阈值0.70处,SSR标记将苦瓜8114I单独聚为一类,而SRAP标记则将苦瓜8114I和南山一号苦瓜C聚为一类;在阈值0.73处,SRAP标记将苦瓜814D单独聚为一类,而SSR标记则将苦瓜814D和翡翠绿A、嘉多宅2号B聚为一类。这可能是因为SSR是对基因组的高度重复序列进行扩增,而SRAP是对启动子或内含子区域进行扩增。从聚类分析的信息量考虑,采用SRAP标记获得的遗传距离和聚类结果更可靠。
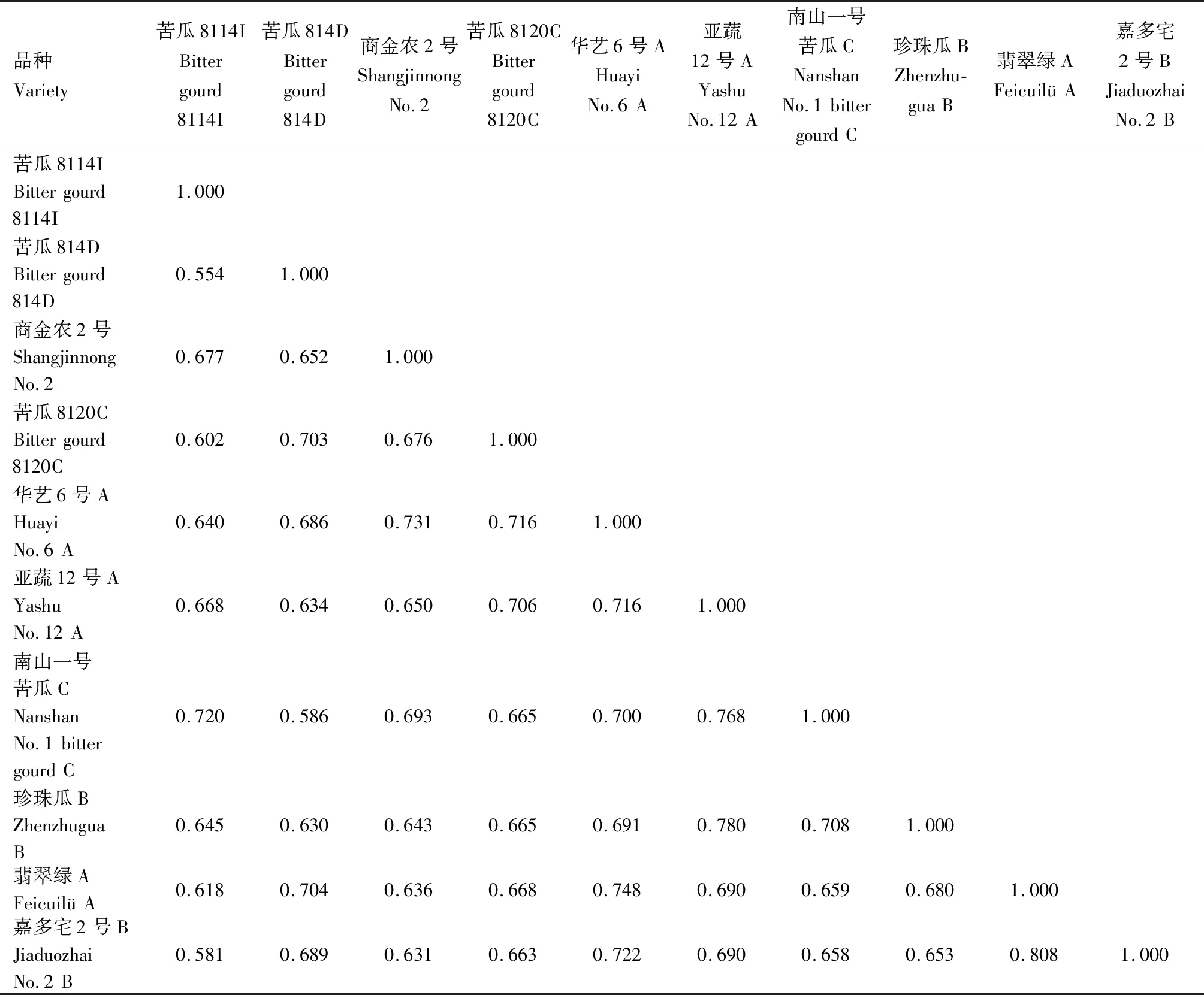
表10 综合SSR和SRAP标记的苦瓜材料遗传相似系数

图5 10份苦瓜材料的SSR和SRAP聚类分析
3 结论与讨论
以往对于苦瓜的遗传多样性研究,大多为表型性状的聚类分析,但苦瓜的遗传背景非常复杂,传统的形态学研究不能准确地分析苦瓜丰富的遗传多样性,因此采用分子标记技术开展苦瓜遗传多样性的研究不断增加。陈禅友等[25]应用简单序列间重复(Inter-simple sequence repeat,ISSR)技术分析30份苦瓜的遗传多样性,将供试苦瓜归为6大类群,指出苦瓜的遗传距离与形态学性状相关联,且在一定程度上受地域的影响。张景云等[17]研究表明,供试46份苦瓜含有丰富的遗传信息,可用于遗传改良和优势品种的筛选;同时通过聚类分析将供试苦瓜归为4大类群,与形态学性状的聚类结果相同,说明SSR和SRAP技术应用于苦瓜遗传多样性分析具有可靠性。聚类后发现供试苦瓜的分布具有很强的地域性,与陈禅友等[25]的结论一致。此外,李光光等[23]用SSR标记,高山等[26]采用随机扩增多态性DNA(Randomly amplified polymorphic DNA,RAPD)标记,王国莉等[22,24]用SSR和SRAP标记开展了苦瓜遗传多样性、品种鉴定方面的研究。
本研究采用一管式植物DNAout试剂盒法,从苦瓜种子中快速提取基因组DNA,并经过不断的试验优化,成功地获得了扩增条带清晰、条带数量以及多态性丰富的SSR和SRAP扩增体系,为进一步实现2种分子标记技术辅助选择苦瓜育种奠定了坚实的基础。虽然本研究的苦瓜样品仅为10份苦瓜材料,但使用11对SSR引物扩增出195条条带,多态性条带164条,平均多态性条带比率高达85.7%,13对SRAP引物扩增出231条条带,多态性条带201条,平均多态性条带比率高达87.5%,均高于王国莉等[22]、张景云等[17]的研究结果。对比SSR、SRAP、ISSR、RAPD标记技术的扩增结果发现,SSR和SRAP标记技术扩增产物的多态性高于ISSR和RAPD标记技术。当多态性条带比率大于50%时,可以认为遗传多样性是丰富的。本研究揭示了10份苦瓜之间丰富的遗传多样性,表明SSR和SRAP技术可应用于苦瓜的遗传多样性分析,且结果具有较高的可信度。
本研究发现,SSR和SRAP技术均能扩增出较多的多态性条带,SRAP扩增的总位点数高于SSR,平均每对引物扩增出的多态性条带(15.5条)高于SSR(14.9条),且SRAP的平均多态性条带比率(87.5%)也高于SSR(85.7%),说明SRAP 标记的多态性优于 SSR 标记。但SSR标记的遗传距离的变异幅度大于SRAP。两者的聚类分析结果大致相同,但也存在一定的差异,存在差异的原因可能是:(1)SSR扩增的是生物体基因组的高度重复序列,而SRAP是对启动子、内含子区域进行扩增,两者的扩增片段不同;(2)检测位点不足,不能完整反映苦瓜基因组情况,导致谱系偏离;(3)在进行试验或数据统计时存在误差,导致聚类结果有偏差,可通过增加扩增引物数量获得更多条带来解决这一问题。
本研究建立了一种应用SSR和SRAP技术快速分析苦瓜材料遗传多样性的方法,通过对10份苦瓜材料的分析,得到了与形态学标记相关性较高、2种标记相对一致的分类结果,为分子标记辅助选择苦瓜育种提供了理论和实践的应用证据,对缩短苦瓜育种进程、推动新品种选育及品种改良研究应用是非常有益的。

