衰老原代小鼠成骨细胞模型的建立与评价
鲁晴 谭海涛 贺锦桥 杨心妮张鑫 黎静
1.广西医科大学基础医学院生理学教研室,广西南宁 530021;2.广西医科大学第八附属医院广西数字医学3D打印临床研究中心,广西贵港 537100
骨质疏松是中老年人的一大常见疾病,以低骨量,骨显微组织损坏为主要特征,易引起老年人骨折,致残甚至死亡[1]。成骨细胞的主要功能是负责骨的形成,分泌与矿化,其特异性分泌的多种生物活性物质,可以调节骨的形成和重建过程[2]。其功能随着衰老的过程而发生显著的变化[3]。乳鼠颅盖骨由于含有骨膜和骨松质,具有良好的表达成骨细胞蛋白合成以及繁殖的能力,培养条件较为简单,因而被普遍选作体外培养成骨细胞的组织来源[4]。该试验旨在运用酶消化法和组织块相结合的培养法获取原代成骨细胞,并采用D-半乳糖法构建成骨细胞衰老模型,为后续对成骨细胞衰老机制的探讨打下基础。
1 实验材料
1.1 实验动特
实验动物新生5~7 d的昆明乳鼠,雌雄均可,购自广西医科大学实验动物中心。
1.2 主要试剂
MEM α培养基,胶原酶Ⅱ型,BCIP/NBT碱性磷酸酶显色试剂盒,PBS,胰蛋白酶-EDTA消化液(0.25%),β-半乳糖苷酶细胞衰老染色试剂盒,D-(+)半乳糖,cDNA逆转录试剂盒,riboFECT CP Transfection Kit。
2 方法
2.1 提取细胞
取5只新生5~7 d昆明乳鼠,剥离颅骨的顶骨和额骨,剔除骨片上附着的多余血液和结缔组织。随后将骨片置于含0.25%EDTA胰酶的离心管中浸没,37℃消化10 min。取适量培养基中和胰酶。将骨碎块加至0.1%Ⅱ型胶原酶中,37℃水浴箱消化30 min。弃上清液,将骨碎片置于25 cm2的培养瓶中平铺,置于37℃、5%的CO2培养箱倒置干涸培育。约2~4 h后翻正培养瓶,加入4 mL MEM完全培养基继续培养3 d后换液。
2.2 成骨细胞传代和纯化
骨组织块爬出的细胞生长铺至培养瓶80%满时,进行细胞传代。经胰酶消化后,加入MEM完全培养基终止消化,取细胞悬液静置3min,弃掉沉淀的骨组织块。上清液离心1 000 rpm×5 min。弃上清液后重新加入MEM完全培养基重悬均匀细胞,加入25 cm2细胞培养瓶中。运用差速黏附法[4]分离混杂其中的成纤维细胞:即把培养瓶内的细胞悬液在细胞孵箱中静置15 min,吸取上清液至新培养瓶内,再静置15 min,如此连续转瓶2~3次,成纤维细胞便可去除。
2.3 成骨细胞形态学观察
每天用倒置相差显微镜察看原代培育,传代细胞的爬出以及生长状况,察看细胞状态并拍照记录。
2.4 成骨细胞碱性磷酸酶染色
显微镜下进行细胞计数第三代生长状态良好的原代细胞,将细胞接种于六孔板。待细胞生长至80%后,按照试剂盒说明书进行碱性磷酸酶染色实验,显微镜下观察染色情况,显微镜下挑选细胞散布均匀的视野计数100个细胞,计算阳性细胞所占比例。
2.5 D-半乳糖诱导细胞衰老
将生长状态良好的小鼠成骨细胞接种于六孔板,待细胞生长至50%左右,D-半乳糖处理组更换为含有D-半乳糖MEM培养基 (20 g/L),对照组给予无D-gal培养基,培养48 h。
2.6 β-半乳糖苷酶染色
六孔板内原代成骨细胞长到70%,按照β-半乳糖苷酶染色试剂盒进行操作,并在显微镜下各组随机挑选并计数100个细胞中的阳性细胞数,计算阳性细胞率(%)。
2.7 RT-PCR法检测BMP2、ALP基因表达
Trizol法提取细胞总RNA并进行逆转录,采取RT-PCR法检测各组基因表达程度(引物信息见表1)。每个样本重复测量3次,以GAPDH为基因内参参照标准,按照2^-△△Ct计算基因相对表达量。

表1 引物序列
2.8 统计方法
应用SPSS 25.0统计学软件进行数据比较分析。 组间比较(±s)表示,采用t检验,P<0.05 为差异有统计学意义。
3 实验结果
3.1 倒置相差显微镜下观察细胞形态
骨块贴壁2 d后有细胞自骨碎片爬出,贴壁逐渐展开(如图1A)。3 d左右细胞数量显著增多,以骨块为中心向周围放射状生长,呈梭形,三角形,非规则鳞片形(如图1B)。4 d左右生长的细胞基本铺满整个培养瓶(如图 1C)。

图1 不同天数细胞爬出骨片状况 (×100)
3.2 碱性磷酸酶染色结果
体外培养的成骨细胞能够合成大量碱性磷酸酶,分析结果表明,分离培养的细胞经染色后呈现明显的深蓝色和蓝黑色,其中阳性细胞所占比例约为90%,见图 2。
3.3 β-半乳糖苷酶染色结果
经β-半乳糖苷酶染色后观察可发现,衰老阳性细胞显现出蓝绿色,阴性细胞无着色。结果表明,与对照组相比,D-半乳糖处理组阳性细胞数显著增多(P<0.01),如图 3。

图2 原代细胞碱性磷酸酶染色观察(A:×4 B:×100)

图3 成骨细胞β-半乳糖苷酶染色情况分析
3.4 RT-PCR分析>BMP2、ALPmRNA表达
如图4结果显示,D-半乳糖诱导48 h后成骨细胞中基因BMP2、ALPmRNA表达较对照组表达显著降低(P<0.05)。
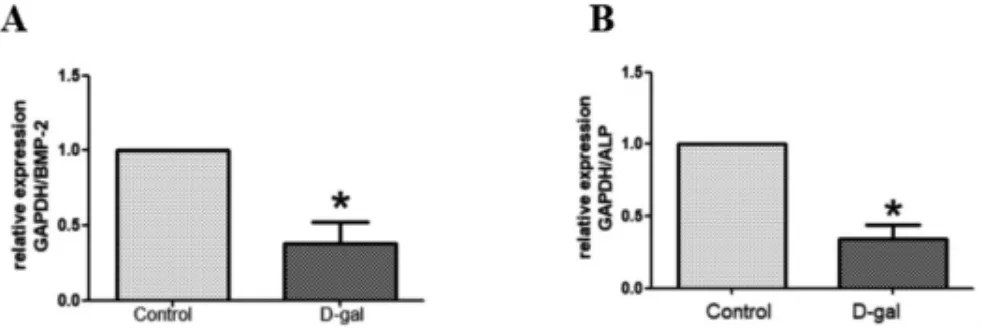
图4 成骨细胞基因BMP2及ALP表达变化(±s)
4 讨论
骨质疏松以骨量减低,骨脆性加重,骨密度减少为主要特征。成骨细胞是参与骨重塑的主要细胞之一[5],原代培养是其体外培养主要细胞来源之一[6]。由于新生乳鼠的顶骨和额骨能够产生较多成骨细胞且附着的成纤维细胞较少[7],因此选择其颅骨进行取材保证成骨细胞的增殖数量与纯度。该实验使用酶化法与组织块法联合进行原代成骨细胞的培育。此方法不但提取成骨细胞成功率较高,易于实验操作,且取得的成骨细胞数量多。
对成骨细胞进行生物形态学特征的观察,是对其鉴别的常用方法之一[8]。该实验观察发现分离培养的细胞形态为不规则梭形,三角形,鳞片形,有多个长短不一的细胞突起,细胞核卵圆形位于胞质中央,符合其他文献报道的成骨细胞特性[9]。此外,碱性磷酸酶(ALP)的高表达被广泛看作是成骨细胞早期分化的重要指标[10],该实验发现90%的细胞都被碱性磷酸酶染色,表明所培养的细胞分泌碱性磷酸酶,符合其他文献报道[4]的成骨细胞的生物学特征。
D-半乳糖是一种正常生理性营养成分,能在机体内通过酶解转变为葡萄糖为机体生命活动提供能量,但是过量的D-半乳糖会导致机体代谢异常,并引起机体生理功能发生显著变化[11]。因此,D-半乳糖建立的动物衰老模型已经被国内外认可并广泛应用于医学研究的多方领域。X-Gal在细胞衰老特异性的β-半乳糖苷酶催化下会产生深蓝色产物。碱性磷酸酶(ALP)是成骨细胞通过基质小泡释放的参与钙磷代谢的一种重要酶,能够加速细胞的成熟、钙化,ALP活性加强会加速骨基质矿化形成,因此ALP活性表达被看作是反应成骨细胞分化程度和功能状态的重要指标[12]。RUNx转录因子蛋白家族中的RUNx2是成骨细胞分化的特异性转录因子,也称骨形态发生蛋白,具备诱导间充质细胞分化成骨细胞的作用[13]。该实验原代成骨细胞经D-半乳糖诱导4后,β-半乳糖苷酶染色发现其阳性率明显增加,而且D-半乳糖处理后成骨细胞ALP、RUNxmRNA均呈低表达,提示D-半乳糖诱导导致细胞活力降低,增殖分化能力削弱,细胞呈衰老表现。
综上所述,该实验通过Ⅱ型胶原酶消化联合组织块培养建立了原代小鼠成骨细胞培养方法,并通过D-半乳糖诱导法建立了小鼠成骨细胞衰老模型,为后续对成骨细胞衰老机制以及老年骨质疏松相关疾病的研究提供了实验基础。

