内皮祖细胞来源的外泌体减轻血管内皮细胞缺氧性损伤*
李罗成 王志维 吴红兵 任宗力 任 伟
血管内皮功能失调和损伤是心脑血管疾病发生的关键环节。引起血管内皮细胞功能失调和损伤的因素很多,缺氧是常见的因素之一。根据文献报道,患有睡眠呼吸暂停综合征或慢性阻塞性肺部疾病的患者,心脑血管疾病的发病率是正常人群的3-4倍[1]。内皮祖细胞(Endothelial Progenitor Cells,EPCs)在血管内皮细胞损伤和修复过程中主要通过两种方式发挥重要作用:一是直接分化为成熟内皮细胞进行修复,二是通过旁分泌多种生物因子促进内皮细胞增殖、迁移及损伤状态下的存活[2]。
在细胞进行旁分泌过程中,外泌体(Exosomes,EXOs)起着类似货仓的作用。EXOs是由真核细胞分泌的一种小囊泡,大部分直径约30-100nm。因其在体液中可稳定存在,并包含多种生物调节因子,可产生与其来源细胞相同的作用,近年来作为一种理想的基因载体引起广泛关注[3-4]。EXOs通过细胞间质或循环系统将细胞产生的生长因子、mRNA和miRNA转运至靶细胞,被靶细胞摄取后调控靶细胞的生物学行为[5]。来源于EPCs的外泌体(EPCs-EXOs)是否也能执行转运功能,从而实现EPCs的部分甚至全部生物学功能,值得探讨。本文利用EPCs-EXOs干预经缺氧处理的人脐静脉内皮细胞(Human Umbilical Vein Endothelial Cells,HUVECs),以明确EPCs-EXOs对内皮细胞缺氧损伤的影响。
1 材料与方法
1.1 主要材料和试剂
EPCs和HUVECs(Lonza公司,瑞士),鼠抗CD63多克隆[TS63]抗体、兔抗α-tubulin多克隆抗体、HRP标记羊抗兔IgG、HRP标记兔抗鼠IgG(Abcam,英国)。兔抗CD81多克隆抗体(Santa Cruz,美国),EXOs提取液(Total Exosome Isolation Reagent)(Invitrogen,美国)。RIPA lysis buffer、BCA蛋白检测试剂盒、CCK-8试剂盒(碧云天生物技术有限公司,中国)。
1.2 方法
1.2.1EPCs培养及传代:冻存的EPCs细胞株复苏后,放入预涂过I型鼠尾胶的6孔培养板,采用含有5%胎牛血清和细胞因子的EGM-2 MV培养基,于37℃、5% CO2的培养箱中培养。每2天更换一次培养液直至传代。于倒置相差显微镜下观察,当细胞生长达到培养板底部的80%-90%时进行传代,第2-6代细胞用于实验。
1.2.2外泌体提取:传代后的EPCs用无外泌体血清的培养基培养48h,收集培养液,2 000g 离心30 min去除细胞和细胞碎片。将离心后的培养基以比例2∶1(v/v)添加EXOs提取液,4℃孵育过夜后10 000g离心1h。离心沉淀物即为外泌体,-80℃保存。
1.2.3Western blot检测EXOs膜性标志物:在提取的EXOs中加入适量RIPA lysis buffer,BCA蛋白检测试剂盒测定蛋白浓度。根据蛋白定量结果,取50μg蛋白质经15%聚丙烯酰胺凝胶电泳,半干法转移到PVDF膜。转膜后置于含5%脱脂奶粉的TBST中进行封闭,加入一抗室温孵育2h,TBST洗涤后再加入HRP标记的二抗,37℃孵育1h。ECL化学发光,胶片曝光,采用Image J软件对Western blot结果进行条带灰度分析。以a-tubulin蛋白为内参照,目标蛋白与a-tubulin蛋白条带灰度比值为该蛋白的相对表达量。
1.2.4EXOs电镜样本制备和观察:取出-80℃冰箱中保存的EXOs,放于冰水混合物中解冻,用4℃ 1×PBS将EXOs稀释为0.5mg/ml的悬液。将碳包覆镍网置于滤纸上,吸取20μl EXOs悬液,滴至碳包覆镍网上,红外灯下烘烤5min,烘干后在碳包覆镍网上滴加1-2滴1%磷钨酸,再次烘烤5min,于透射电镜下观察EXOs形态。
1.2.5HUVECs分组处理:HUVECs复苏后,采用含10%胎牛血清和1%双抗(青链霉素混合液)的RPMI 1640 培养液,置于37℃、5% CO2的培养箱中培养,2-3天更换培养液。通过倒置相差显微镜观察细胞,当细胞生长面积达到培养板底部的80%或出现接触抑制时,进行传代。传代次数为3-7次的HUVECs用于实验。缺氧处理时,当细胞生长面积达到培养板底部的80%,将培养板放置于低氧培养箱(1% O2,5% CO2,94% N2)中培养8h。低氧处理后,再将细胞移到常规培养条件下培养,并在不同时间点检测细胞增殖、凋亡和迁移情况。实验分为三组:(1)正常对照组,按上述方法培养,但不作缺氧处理;(2)缺氧组,采用上述方法培养的HUVECs;(3)缺氧+EPCs-EXOs组,进行缺氧处理前,在HUVECs中加入EPCs-EXOs,随后即开始缺氧处理。
1.2.6CCK-8试剂盒检测HUVECs增殖:将各组HUVECs按每孔4×103个接种至96孔板中,按照实验分组处理后置于细胞培养箱中培养(37℃,5% CO2),培养0h、24h、48h后弃培养基,每孔加入新鲜配制的10μl毒性检测液CCK-8,将培养板在培养箱孵育4h后,用酶标仪测450nm波长处的吸光度(OD值),根据公式计算相对细胞增殖率:细胞增殖率=实验组OD值/正常对照组OD值×100%。
1.2.7流式细胞仪检测HUVECs凋亡:将培养0h、24h、48h的HUVECs通过流式细胞术进行凋亡检测。收集培养液中悬浮的细胞和培养瓶内贴壁的细胞,离心后弃去上清,滴加200μl Annexin V-FITC结合液,震荡重悬细胞后再加入5μl Annexin V-FITC并混匀,在4℃下避光孵育15min。再在上述重悬细胞中加入5μl PI 染色液,混匀后于4℃下避光孵育5min,随后通过流式细胞仪检测分析凋亡细胞比例。
1.2.8划痕法检测HUVECs迁移:先将6孔板背后用直尺和标记笔均匀划上间隔为0.5cm的横线,每孔至少穿过5条线;然后每孔加入约5×105个HUVECs,并加入培养基进行培养;第二天用移液器枪头对6孔板底部的细胞进行划痕,再用PBS洗细胞3次,去除划下的细胞,根据实验分组对细胞进行处理,然后放入37℃、5%CO2培养箱培养,分别于0h、24h、48h拍照,比较各组细胞在各时间点迁移率:细胞迁移率=1-实测划痕面积/初始划痕面积,因拍照所取的划痕长度一致,实际计算细胞迁移率=1-实测划痕宽度/初始划痕宽度。
1.3 统计学处理
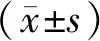
2 结 果
2.1 EPCs-EXOs的结构
经透射电镜观察EXOs的外观结构,可见EXOs呈椭圆形或杯状膜性囊泡,大小不等,直径约40-110nm,较多EXOs聚集在一起呈葡萄状排列。囊泡因内容物不同呈现出不同的透亮度。见图1。

图1 EPCs-EXOs镜下形态(透射电镜)
2.2 EPCs-EXOs标志蛋白表达
与EPCs相比,EPCs-EXOs中CD63和CD81呈强阳性表达,相对表达量均显著高于EPCs(P<0.01),见图2、表1。

图2 EPCs和EPCs-EXOs标志蛋白CD63、CD81表达(Western blot)

表1 EPCs及EPCs-EXOs CD63、CD81的相对表达量
注:与EPCs比较,1)P<0.01
2.3 EPCs-EXOs对低氧条件下HUVECs增殖的影响
0h时各组细胞增殖差异无统计学意义(P>0.05)。24h时,与正常对照组比较,缺氧组细胞增殖率明显降低(P<0.05);缺氧+EPCs-EXOs组细胞增殖率较缺氧组明显改善(t=5.96,P<0.01),接近对照组水平(t=1.47,P>0.05)。48h时,各组间统计分析结果与24h相近(缺氧组vs正常对照组:t=5.51,P<0.05;缺氧+EPCs-EXOs组vs缺氧组:t=2.88,P<0.05;缺氧+EPCs-EXOs组 vs 正常对照组:t=0.45,P>0.05),见表2。

表2 各组细胞相对增殖率
注:与正常对照组比较,1)P<0.05;与缺氧组比较,2)P<0.05,3)P<0.01
2.4 EPCs-EXOs减少低氧条件下HUVECs凋亡
0h时各组细胞凋亡率差异无统计学意义(P>0.05)。24h时,与正常对照组比较,缺氧组HUVECs凋亡率明显增加(t=7.74,P<0.01);与缺氧组比较,缺氧+EPCs-EXOs组HUVECs凋亡率显著下降(t=4.76,P<0.01),但仍高于正常对照组(t=4.38,P<0.01)。48h时,各组间统计分析结果与24h相近(缺氧组vs正常对照组:t=16.12,P<0.01;缺氧+ EPCs-EXOs组 vs 缺氧组:t=14.12 ,P<0.01;缺氧+ EPCs-EXOs组 vs 正常对照组:t=5.83,P<0.01)。见表3及图3。

表3 各组细胞凋亡率比较
注:与正常对照组比较,1)P<0.01;与缺氧组比较,2)P<0.01

图3 各组HUVECs凋亡(流式细胞术)
2.5 EPCs-EXOs改善低氧条件下HUVECs的迁移能力
24h时,与正常对照组比较,缺氧组HUVECs迁移率明显降低(t=17.53,P<0.01);与缺氧组比较,缺氧+EPCs-EXOs组HUVECs迁移率明显改善(t=8.91,P<0.01),且与正常对照组差异不显著(t=0.55,P>0.05)。48h时,各组HUVECs爬片划痕宽度进一步减小,与正常对照组比较,缺氧组HUVECs迁移率明显降低(t=7.35,P<0.01);缺氧+EPCs-EXOs组HUVECs迁移率仍明显高于缺氧组(t=7.84,P<0.01),与正常对照组相比较无明显差异(t=0.58,P>0.05)。见图4及表4。

图4 各组细胞划痕实验

表4 各组细胞迁移率比较
注:与正常对照组比较,1)P<0.01;与缺氧组比较,2)P<0.01
3 讨 论
低氧可引起内皮细胞损伤,体外缺氧环境中培养的HUVECs增殖、迁移能力下降,凋亡细胞比例随着时间推移明显上升。本研究显示,在缺氧HUVECs中加入EPCs-EXOs,可以改善缺氧对HUVECs细胞增值和迁移能力的影响,并能抑制内皮细胞凋亡。这些结果表明EPCs-EXOs可减轻内皮细胞缺氧性损伤,具有一定的抗凋亡作用。
内皮细胞缺氧可发生在多种病理生理状态下,如冠状动脉粥样硬化引起的冠状动脉供血不足,脑血管栓塞引起的脑血管缺血,睡眠呼吸暂停综合征和慢性阻塞性肺部疾病引起的全身缺氧等,都对血管内皮细胞直接或间接造成缺氧,引起内皮细胞损伤。缺氧可以引起内皮细胞的炎症和氧化应激反应,从而导致内皮细胞损伤,并诱发凋亡[6]。内皮损伤是多种心脑血管疾病发生的关键环节,并与心脑血管疾病形成恶性循环,随着心脑血管疾病的进展,内皮损伤日趋加重,继而进一步促进心脑血管疾病的发展,最终引起致死性疾病的发作。
基于干细胞的心脑血管疾病治疗曾经给研究者带来曙光。EPCs是内皮细胞的前体细胞,可以分化成为成熟的内皮细胞,对血管新生和再生有直接作用,还可通过旁分泌的方式的促进血管细胞增殖和迁移,从而刺激新生血管的形成。但应用到临床上因为免疫排异、染色体差异和栓塞形成等问题,受到极大的局限[7]。研究发现,EPCs还可通过分泌细胞因子实现功能,这与EPCs改变靶细胞所处的微环境有关,近年的研究更是发现EPCs的旁分泌机制在血管新生和再生中更为重要[8]。EXOs作为一种重要的旁分泌方式,可以通过转运遗传物质和蛋白分子到靶细胞,在细胞间信息传输方面起着关键作用。EPCs的免疫原性主要来自其大分子蛋白和多糖等成分,而EXOs的内容物以小分子为主,且主要是不具有免疫原性的核酸分子,故EXOs虽具有来源细胞的相似功能特性,但不具有免疫、血管栓塞等方面的副作用,提示使用EXOs可能是一种比干细胞移植更安全的治疗模式[9]。
本文提取了EPCs分泌的EXOs,并将其用来干预缺氧的内皮细胞。本文研究结果显示,当细胞缺氧处理24h后,其增殖和迁移能力下降,细胞凋亡水平增加。而在缺氧的内皮细胞中加入EPCs-EXOs时,缺氧的内皮细胞增殖和迁移能力有一定程度的恢复,其凋亡比例也出现下降,与正常组相比,其增殖、迁移能力相近。尽管外泌体处理后缺氧内皮细胞的凋亡比例稍高于正常对照组,但其凋亡仍得到了明显的减轻。
综上所述,在缺氧发生后,EPCs-EXOs可以改善内皮细胞活性,减轻内皮细胞的缺氧性损伤,具体的调节分子机制尚待进一步研究阐明。
◀

