miR-29c靶向FOS抑制心肌纤维化的分子机制研究
杨 洁 张霄娜 程 涛 赵 沱 朱国兴
心肌纤维化(Myocardial Fibrosis,MF)是以心脏间质出现成纤维细胞过度增殖、胶原异常沉积为特征的心脏病理变化,其与多种心血管疾病及心源性猝死密切相关[1]。临床上MF为慢性心肌梗死患者心功能恶化的重要原因。研究显示,MF的作用机制除了与氧化应激、炎性因子、内皮功能障碍、细胞内钙离子有关外,还受肾素-血管紧张素-醛固酮系统调控[2,3]。微小RNA(microRNA,miRNA)为一类对转录后基因调控的内源性非编码单链微小RNA,其发挥基因调控作用是通过完全或部分与靶基因mRNA结合,阻止靶基因的翻译,从而抑制靶基因蛋白合成[4]。2003年Dostie等[5]在神经元细胞中最早发现miR-29c,2013年Yu等[6]发现miR-29c与血液性疾病有关。目前研究发现,miR-29c存在7 000多个靶基因,参与细胞分化、凋亡、增殖、侵袭、信号转导、调控癌基因及转录等多种生物学功能[7]。miR-29c与肾脏纤维化[8]、乙型肝炎、糖尿病肾病[9]、结肠癌、慢性淋巴细胞白血病[10]的发生发展均密切相关。大量研究证实,miR-29c为抗纤维化因子,但其具体作用机制尚未完全阐明。FOS(Nuclear Phosphoprotein Produced by c-fos Transcription,FOS)为c-fos转录产生的核磷蛋白,其在调控细胞增殖、分化、凋亡中具有重要作用[11]。Pan等[12]在心肌纤维化的研究中报道,miR-101a在纤维化心脏组织中低表达,过表达miR-101a可靶向下调c-fos及其下游因子转化生长因子-β1(Transforming Growth Factor-β1,TGFβ1),miR-101a治疗可减弱大鼠心肌梗死边缘区的间质纤维化。但FOS在心肌纤维化中的作用机制尚未完全清楚。本研究用血管紧张素II(AngII)诱导小鼠原代心肌成纤维细胞,检测miR-29c在其中的表达,观察过表达miR-29c、敲减FOS、过表达FOS对心肌成纤维细胞增殖及纤维化相关蛋白Col I、Col III、α-SMA蛋白表达的影响,并探讨其作用机制,为心肌纤维化的治疗提供新靶点。
1 材料与方法
1.1 动物、主要试剂和仪器
小鼠心肌原代成纤维细胞(编号:M074)购自上海冠导生物;AngII(编号:05-23-0101)购自MERCK;兔抗人FOS多克隆抗体(编号:PAB11866)购自abnova;兔抗人Col I多克隆抗体(编号:NBP1-86396)购自novus;兔抗人β-actin多克隆抗体(编号:SY0633-AYM)、兔抗人Col III多克隆抗体(编号bs-3934R)、兔抗人α-SMA多克隆抗体(编号:YT680)购自北京白奥博;辣根过氧化物酶标记的山羊抗兔IgG抗体(编号:HS-GR-HRP-500)购自石四药-翰林生物;二喹啉甲酸(Bicinchoninic Acid,BCA)蛋白定量试剂盒(编号:M030)购自上海美季生物;脂质体LipofectamineTM2000(编号:WK0647)购自Invitrogen;逆转录试剂盒(编号:RRO38A)购自Takara公司;双荧光素酶报告基因检测试剂盒(编号:11402ES60)购自上海前尘生物;聚偏二氟乙烯(Polyvinylidene Fluoride,PVDF)膜(罗氏roche 3010040001)购于罗氏公司;杜氏改良培养基(Dulbecco's Modified Eagle Medium,DMEM)培养基(编号:11960044)购自GIBCO;胎牛血清(编号:11011-6125)购自杭州四季青;噻唑蓝检测试剂盒(MTT,编号:B7777)购自美国APExBIO;ZF-4型KODAK凝胶成像分析系统购自上海垒固仪器有限公司;BIO-RAD半干转膜仪(型号:170-3940)购于北京赛百奥公司。
1.2 细胞培养及分组
小鼠心肌原代成纤维细胞用含10%胎牛血清的DMEM培养基培养,置于37 ℃、5 % CO2的培养箱中培养24h后更换培养液。传代2-3代后用于后续试验。AngII组:用10-6mol/L的血管紧张素II(AngII)处理小鼠心肌成纤维细胞24h[13]。空白组:常规培养成纤维细胞,不作任何处理。
取适量对数生长期AngII组细胞,调整细胞密度至105个/孔,培养24h,融合度约75% 时,按照LipofectamineTM2000脂质体试剂盒的使用说明书操作将各质粒转染至AngII组细胞,并分别命名为AngII+miR-29c组(转染miR-29c mimics)、AngII+miR-con组(未转染细胞)、AngII+anti-con组(转染anti-con)、AngII+anti-miR-29c组 (转染anti-miR-29c)、AngII+siFOS组(转染siFOS)、AngII+si-con组(转染si-con)、AngII+miR-29c+Ctrl组(miR-29c mimics和pcDNA 3.1共转染)、AngII+miR-29c+FOS组(miR-29c mimics和pcDNA 3.1-FOS共转染),添加的质粒与脂质体的比例为1∶3,转染6h后,更换为新鲜培养基,继续培养48h,再用qRT-PCR法检测转染效率。每组设置3个重复孔。转染成功后,进行实时荧光定量反转录聚合酶链反应(qRT-PCR)、Western blot实验、双荧光素酶报告基因检测实验。序列信息:miR-con,5’-UUC UCC GAA CGU GUC ACG UTT-3’;miR-29c mimics,5’-UAG GAC CAU UUG AAA UCG GUU A-3’;anti-con,5’-AUG AGG ACA ACA ACC UUC UTT-3’;anti-miR-29c,5’-UAA CCG AUU UCA AAU GGU GCU A-3’;si-con,5’-GCG TAG TCT TGG TGT TGA CAT-3’;siFOS,5’-CTT CAT TCC CAC GGT CAC T-3’。
1.3 检测指标和方法
1.3.1qRT-PCR检测miR-29c水平:取适量对数生长期细胞,按照RNA抽提试剂盒说明书操作提取RNA并定量,按逆转录试剂盒按照说明书操作合成cDNA,最后按qRT-PCR试剂盒说明书操作进行miR-29c检测。以U6为内参,用2-△△Ct计算miR-29c的表达。引物序列信息:miR-29c,上游引物:5’-ACA CTC CAG CTG GGT AGC ACC ATT TGA AAT-3’,下游引物:5’-TGG TGT CGT GGA GTC G-3’;U6,上游引物:5’-CTC GCT TCG GCA GCA CA-3’,下游引物:5’-AAC GCT TCA CGA ATT TGC GT-3’。
1.3.2MTT检测细胞活性:取适量对数生长期细胞,加入20μl 5g/L的MTT溶液,培养4h后,弃去上清,每孔加入150μl DMSO,震荡,使结晶充分溶解,在490nm波长下检测细胞吸光度(OD490),细胞活性与吸光度成正比。细胞活性= OD490样品/OD490空白组。
1.3.3Western blot检测蛋白水平:取适量对数生长期细胞,RIPA裂解,提取总蛋白,BCA法进行蛋白定量后沸水浴变性。将准备好的分离胶和浓缩胶小心倾倒,凝固后,进行十二烷基硫酸钠(SDS)蛋白电泳,结束后再进行PVDF转膜,2.5%的脱脂奶粉封闭2h,加入Ⅰ抗(FOS、Col I、Col III、α-SMA、β-actin的兔抗人多克隆抗体,1∶500-1 500稀释),4 ℃孵育过夜。次日,洗膜后加入辣根过氧化物酶标记的Ⅱ抗(辣根过氧化物酶标记的山羊抗兔IgG抗体,1∶1 000稀释),37 ℃孵育2h。结束后加入显影混合液,显影曝光。以目的条带灰度值与β-actin灰度值的比值表示FOS、Col I、Col III、α-SMA的相对表达量。
1.3.4生物信息学预测:通过在线靶基因预测库Target Scan(http://www.targetscan.org/)预测miR-29c和FOS的结合位点。
1.3.5双荧光素酶报告基因检测实验:将由上海吉玛公司合成的FOS-WT序列、FOS-MUT序列进行克隆、胶回收和纯化。再将连序列与psiCHECK-2载体,通过DH5α感受态细胞进行瞬时转化。进行培养后,将其在LB固体培养基上涂板,次日选取优势菌落扩大培养,抽提质粒DNA。荧光素酶报告载体(psiCHECK2-FOS-WT,psiCHECK2-FOS-MUT)分别与miR-29c mimics、miR-NC用脂质体法转染小鼠心肌原代成纤维细胞细胞培养6h后,更换新鲜培养液继续培养,转染48h。按照双荧光素酶报告基因检测试剂盒说明书操作步骤要求操作。结果以海参荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值反映miR-29c和FOS的结合力。
1.4 统计学处理
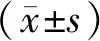
2 结 果
2.1 miR-29c在小鼠原代心肌成纤维细胞中的表达
与空白组相比,AngII组细胞中miR-29c表达显著降低(1.00±0.17 vs 0.48±0.14),差异具有统计学意义(t=4.090,P<0.05)。
2.2 过表达miR-29c抑制心肌成纤维细胞的增殖和纤维化
检测数据以空白组作为参照进行处理,各组细胞活性和纤维化相关蛋白水平差异均有统计学意义(P均<0.01)。与空白组相比,AngII组细胞活性显著升高,Col I、Col III、α-SMA的蛋白表达量均显著升高,差异有统计学意义(t均>20.114,P<0.05);与AngII+miR-con组相比,AngII+miR-29c组细胞的活性显著降低,Col I、Col III、α-SMA的蛋白表达量均显著降低,差异均具有统计学意义(t均>14.647,P<0.05)。见图1、表1。

图1 各组小鼠心肌成纤维细胞纤维化相关蛋白表达(Western blot)

表1 过表达miR-29c抑制心肌成纤维细胞的增殖和纤维化均=3)
注:与空白组比较,1)P<0.05;与AngII+miR-con组比较,2)P<0.05
2.3 miR-29c靶向FOS
通过TargetScan对miR-29c与FOS的结合进行预测,发现miR-29c与FOS存在结合位点,见图2。将检测数据以AngII+miR-con组作为参照进行处理,各组FOS的蛋白水平表达差异具有统计学意义(F=25.120,P<0.05);与AngII+miR-con组相比,AngII+miR-29c组FOS的蛋白表达显著降低(1.00±0.12 vs 0.61±0.11,t=7.187,P<0.05);与AngII+anti-miR-con组相比,AngII+anti-miR-29c组FOS的蛋白表达显著升高(0.98±0.14 vs 1.57±0.17,t=8.037,P<0.05),见图3。双荧光素酶报告基因检测实验检测细胞荧光活性,以AngII+miR-con组作为参照进行处理,结果显示,与AngII+miR-con组相比,AngII+miR-29c组WT型细胞荧光活性显著降低(P<0.01),MUT型细胞荧光活性变化不显著(P>0.05),见表2。

图2 miR-29c靶向FOS

图3 各组小鼠心肌成纤维细胞FOS蛋白表达(Western blot)

表2 miR-29c对成纤维细胞荧光活性的影响均=3)
注:与miR-con组比较,1)P<0.01
2.4 敲减FOS对小鼠心肌成纤维细胞增殖和纤维化的影响
将检测数据以空白组作为参照进行处理,各组FOS蛋白、细胞活性以及纤维化相关蛋白水平差异均具有统计学意义(P<0.05)。与空白组相比,AngII组细胞中FOS蛋白、细胞活性、Col I蛋白、Col III蛋白、α-SMA蛋白均显著升高(t均>20.034,P<0.05);与AngII+si-con组相比,AngII+si-FOS组细胞中FOS蛋白、细胞活性、Col I蛋白、Col III蛋白、α-SMA蛋白均显著降低(t均>15.131,P<0.05)。见图4、表3。
2.5 过表达FOS逆转miR-29c对心肌细胞增殖和纤维化的抑制作用
将检测数据以AngII组作为参照进行处理,各组FOS蛋白、细胞活性以及Col I蛋白、Col III蛋白、α-SMA蛋白水平差异均具有统计学意义(P<0.01)。与AngII+miR-con组相比,AngII+miR-29c组、AngII+miR-29c+Ctrl组、AngII+miR-29c+FOS组细胞的FOS蛋白、细胞活性、Col I蛋白、Col III蛋白、α-SMA蛋白均显著降低(t均>3.454,P<0.05);与AngII+miR-29c+Ctrl组相比,AngII+miR-29c+FOS组细胞的FOS蛋白、细胞活性、Col I蛋白、Col III蛋白、α-SMA蛋白均显著升高(t均>6.708,P<0.05)。见图5、表4。

图4 敲减FOS各组小鼠心肌成纤维细胞FOS、Col I、Col III、α-SMA蛋白表达(Western blot)

表3 敲减FOS对小鼠心肌成纤维细胞增殖和纤维化的影响均=3)
注:与空白组比较,1)P<0.05;与AngII+si-con组比较,2)P<0.05
3 讨 论
心脏应激常引起心肌结构的重组,其发展常导致心力衰竭和死亡。MF是心脏组织重组的重要部分,由心脏成纤维细胞的异常增殖引起,导致心肌细胞内过量细胞外基质产生[14]。非编码RNA(non-coding RNA,ncRNA)是一组不同的内源性RNA分子,包括短ncRNA(19-22个核苷酸)和长ncRNA(>200个核苷酸)。这些ncRNA具有调节心血管细胞的多种重要功能,在MF中的作用尤为重要[15]。Lew等[16]在心脏成纤维细胞的研究中运用脂多糖(LPS)诱导小鼠MF,运用qRT-PCR检测miR-29c的表达,发现小鼠心肌miR-29c低表达。Qi等[17]研究发现,激活腺苷酸活化蛋白激酶(AMPK)可下调下游转录因子HNF-4α表达并降低HNF-4α与TGF-β1启动子的结合,导致TGF-β1下调和miR-29家族上调,且miR-29可靶向负调控CDK2抑制心脏纤维化。Liu等[18]在异丙肾上腺素(ISO)诱导MF的研究中,运用免疫组织化学和分子生物学检测三七总皂甙(PNS)对心肌损伤的治疗,发现miR-29c在ISO诱导的MF中表达显著降低,PNS处理后可上调miR-29c的表达量,并下调miR-29c的靶基因1型胶原α1(Col1a1)、1型胶原α2(Col1a2)、1型胶原α3(Col1a3)、1型胶原5α1(Col15a1)、肌原纤蛋白1(Recombinant Fibrillin 1 ,FBN1)和TGFβ1的表达,提示PNS通过上调miR-29c表达发挥心脏保护作用。本研究用AngII诱导小鼠心肌成纤维细胞,运用qRT-PCR检测了细胞中miR-29c的表达,发现miR-29c在AngII诱导的小鼠心肌成纤维细胞中低表达,这与前人的研究结果相一致;进一步用MTT法、Western blot检测了过表达miR-29c的成纤维细胞增殖和纤维化,发现过表达miR-29c可抑制成纤维细胞增殖,下调纤维化相关基因Col I、Col III、α-SMA的蛋白表达,揭示过表达miR-29c可抑制小鼠心肌成纤维细胞增殖和纤维化。

图5 过表达FOS和转染miR-29c各组成纤维细胞中FOS、Col I、Col III、α-SMA蛋白表达(Western blot)

表4 过表达FOS和转染miR-29c对心肌细胞增殖和纤维化的影响均=3)
注:与AngII+miR-con组比较,1)P<0.05;与AngII+miR-29c+Ctrl组比较,2)P<0.05
FOS属于即刻早期应答基因(IEG),其为c-fos基因转录后的mRNA编码的核磷蛋白之一[19]。c-fos高度保守,可以在很多种因素诱导下快速表达,当c-fos蛋白合成后立即转入细胞核并在20-90min即可检出[20]。FOS除参与多种癌症的发展过程外,还与关节炎、肾脏纤维化、心脏纤维化有关。早在2009年Huang等[21]在研究MF中应用AngII诱导心肌成纤维细胞,通过South-western blot印迹 、电泳迁移率实验(EMSA)检测分析,发现c-Jun和c-Fos是PARP-1的结合域(ADP-核糖基),该结合域可增强核转录因子激活蛋白-1(AP1)与DNA的结合,AngII通过激活多聚ADP核糖聚合酶1(PARP-1)促进c-Jun和c-Fos的结合,进而增强心肌成纤维细胞中AP1的转录。2017年Matsumoto等[22]在研究白藜芦醇对急性三叉神经炎的疼痛中发现,FOS蛋白与Jun形成FOS-Jun复合物,作为信号转导的媒介,调控TNF-α、IL-6、IL-1β的表达,调节炎症反应。张灼等[23]在研究心肌纤维化中运用qRT- PCR和Western blot法分别检测沉默调节蛋白1(SIRT1)和纤维化标志物Col1a1、Col3a1、α-SMA的mRNA和蛋白表达发现,在AngⅡ诱导的小鼠心肌成纤维细胞中,Col1a1、Col3a1、α-SMA的表达显著上调。Tao等[24]发现,FOS在胶质瘤中表达显著升高,敲减FOS可抑制胶质瘤细胞侵袭,并促进凋亡,其机制与miR-181b靶向FOS有关。本研究检测了不同处理组细胞中FOS的蛋白含量发现,FOS的表达受miR-29c负向调控,这与Pan等[12]的研究结果相吻合;进一步研究发现,敲减FOS可抑制小鼠心肌成纤维细胞增殖和纤维化,且过表达FOS可逆转miR-29c对成纤维细胞增殖和纤维化的抑制作用。
综上所述,miR-29c可抑制小鼠心肌成纤维细胞增殖及其纤维化,其机制可能与miR-29c可靶向负调控FOS有关,该结果为心血管疾病的治疗提供了新的理论依据。
◀

