黄连素对大鼠结肠敏感性和动力学异常引起肠易激综合征的影响及其机制探讨
柴 红 吴平亚,2 杨 政 吴承云 谭诗云 罗和生
肠易激综合征(Irritable Bowel Syndrome,IBS)是临床上最常见功能性肠病,全球患病率为2%—15%,甚至达到25%[1]。它的主要病理生理特征为患者肠道对额外刺激产生应激性高敏感性和动力异常紊乱[2]。其实质和节点归结于结肠平滑肌细胞膜上L-型钙通道(L-type Calcium Current,ICa-L)发生紊乱和电重构,胞外Ca2+过多通过ICa-L进入细胞内,使细胞膜电位升高,产生异常去极化及兴奋性,诱发IBS[3]。所以,有关治疗IBS的药物亦可能需要针对其作用结肠平滑肌细胞膜上ICa-L。黄连素(Berberine,BBR)是古老传统中药黄连的主要成分,能够改善高糖诱导血管内皮细胞和微血管内皮细胞损伤[4],调节大脑内某些电压依赖性离子通道,减弱结肠平衡肌的致敏性与应激反应,阻断其兴奋收缩偶联和痉挛,起到治疗IBS作用。推测BBR这种功效与其能直接抑制结肠平滑肌细胞ICa-L有关,但它如何具体作用IBS病理生理特征及其机制的探讨仍然有限[5]。本文以大鼠作为BBR作用对象,利用直结肠扩张实验(Colorectal Distension,CRD)制备IBS模型,观察BBR作用IBS前后大鼠症状和躯体化胃肠道反应特征,以及结肠平滑肌细胞ICa-L的变化,旨在为BBR应用于临床治疗IBS提供更多实验依据和理论基础。
1 材料与方法
1.1 实验动物、试剂和仪器
1.1.1动物:45只SPF级SD雄性大鼠购于武汉大学医学院实验动物中心,鼠龄8周,体质量250±50g,购回后饲养于本院SPF级实验动物中心,维持室温25℃±2℃,相对湿度65%—70%,日光/黑暗周期12h/12h(光照时间7∶00-19∶00),背景噪音为(40±10)dB,自由进食进水,1周后进入实验。
1.1.2试剂和仪器:BBR购自中国食品药品检定研究院(国家药品标准物质,含量为86.7%);使用前临时用去离子超纯水经超声助溶配制成2.5mg/ml混悬溶液,供灌胃使用。HEPES、CollagenaseⅡ、胰蛋白酶抑制剂、CsCl、CsOH、Na2-ATP、EGTA、TEA 为Sigma公司产品。无钙生理盐溶液(PSS)(mmol/L):NaCl 135.0,KCl 5.0,MgCl21.2,glucose 10.0,HEPES 10.0,用Tris-HCl调pH至7.4。获得结肠平滑肌细胞的消化液:Ca2+-free PSS液,0.12% CollagenaseⅡ,0.2%胰蛋白酶抑制剂和0.2% BSA。记录ICa-L电极外液(mmol/L):NaCl 147.0,KCl 5.4,CaCl22.0,glucose 10.0,MgCl21.05,NaH2PO40.42,HEPES 10.0,用NaOH 调pH至7.35。记录ICa-L电极内液(mmol/L):CsCl 135.0,MgCl24.0,HEPES 10.0,Na2-ATP 2.0,EGTA 10.0,TEA 20.0,用CsOH调pH至7.3。8导生理记录仪(PowerLab 8/35,澳大利亚)、倒置显微镜(IX 70-122,日本)、细胞记录槽(Warner1-260ul,美国)、Pulse+Pulsefit软件(version8.31,德国)、膜片钳放大器(EPC-9,德国)。
1.2 动物分组与处理
实验大鼠分为对照组、IBS模型组(IBS组)和IBS模型+BBR干预组(BBR组),每组各15只。利用CRD[6]建立IBS模型大鼠,具体操作如下:将30只造模大鼠在第1天禁食24h,禁水12h;第2天于清醒状态下,在大致相同的时间段将大鼠放入特定自制的固定器(15cm×5cm×5cm透明塑料桶)内,使大鼠只能上下运动,无法前后活动及转身。取一根8F导尿管,一端用0号手术线绑一片从避孕套上剪下的膜,形成密闭可充气的小囊(最大容量1—2ml),另一端接一个三通阀,其另外2个开口分别接5ml注射器和压力换能器,用注射器向导尿管小囊和压力换能器通道中注射生理盐水后抽出,反复多次直至整个通道密闭无空气和生理盐水。给导尿管及其小囊外表以及大鼠肛门周围涂抹有润滑作用的医用液体石蜡,将小囊导管经大鼠肛门缓慢插入结肠中大约2cm,之后用胶布将暴露在外的导管固定在大鼠尾根部,静待20min至大鼠适应,通过注射器向小囊中注射一定量37℃生理盐水扩张球囊,直至大鼠出现腹背部肌肉较强收缩并把腹部抬离地面的腹壁回撤反射(Abdominal Withdrawal Reflex,AWR)[7],1次/5min,30s/次,重复测量3次,连续操作一周。对照组采用同样方法,只是在气囊导管插入肛门后不注入生理盐水,亦即不产生AWR现象。造模成功大鼠会发生排便习惯、性状和数量改变,大鼠明显消瘦、毛发枯黄、食欲减退和体重减轻,精神萎靡消沉、运动和饮水减少,排便次数和颗粒数明显增加、且性状为稀水或糊状。本文30例大鼠全部造模成功,随机分配给IBS组和BBR组各15只。剩下未用于造模的15只大鼠作为对照组。将BBR按100mg/kg最大剂量配置成悬浊液,按3ml/次给BBR组大鼠灌胃,1次/天,7天为1个疗程,连续2个疗程,对照组和IBS组大鼠给予相同容量和疗程的生理盐水灌胃。在2个灌胃疗程完成后,各组大鼠继续喂养2周并观察以下各指标。
1.3 观察指标和方法
1.3.1大鼠体重变化:大鼠体重变化是以造模前一天称量所得体重与从灌胃开始至4周后第2天同一时间段称量大鼠所得体重差值的绝对值表示。
1.3.2大鼠排便变化:观察粪便性状,计算排便数量。收集各组大鼠造模前一天以及从灌胃开始至4周后第2天同一时间段2h内排出粪便的颗粒数,称重(湿重),后用烘箱烘干(75℃,2.5h),再称重(干重),计算粪便含水量(%)=(湿重-干重)/湿重×100%。
1.3.3大鼠IBS发生率:IBS发生率(%)=大鼠总例数-体重、排便特征性发生改变大鼠例数/大鼠总例数×100%。
1.3.4结直肠敏感性指标AWR评分:在完成从灌胃开始到4周之后第2天,再一次行CRD过程,以扩张结直肠内球囊引起大鼠腹部抬起和背部拱起作为标准,AWR评分由容量阈值得出[7],由球囊直径对应的容积值表示:直径2mm对应0ml容量;直径8.5mm对应0.5ml容量;直径10.9mm对应0.8ml容量;直径12.2mm对应1.2ml容量;直径13.5mm对应1.6ml容量。
1.3.5结直肠动力异常指标运动指数(Motility Index,MI)及其变化率:在完成AWR评分后,用注射器抽出导尿管小囊和通道中的生理盐水,使压力显示在0mmHg附近,让大鼠静息60min(消除直结肠记忆对后续实验数据影响),之后将小囊导管经大鼠肛门缓慢插入结肠中大约5—7cm,用注射器向导尿管小囊和通路中缓慢注射37℃生理盐水扩张球囊,并观察压力曲线波形的变化,当曲线波形变化最剧烈时,停止注射,关闭与注射器相连的三通阀门,稳定30min,随后再继续记录30min的结肠运动曲线,计算曲线下面积,即为直结肠MI(计算方法:连续测量5个10min内的曲线下面积,取其均值,单位mmHg.S);MI变化率=(实验后的MI-实验前的MI)/实验前的MI×100%。
1.3.6结肠平滑肌细胞的分离及膜片钳记录:各组大鼠完成上述各项观察指标后,颈椎脱臼处死、开腹,取4—5cm长的近端结肠,于4℃的100% O2饱和Ca2+-free PSS液洗净、平摊、固定,在解剖显微镜下锐性分离粘膜层和粘膜下层以环形肌为主的肌条,漂洗、剪碎、置于含消化液的烧杯中孵育、振荡、吹打,消化15—20min得到单个结肠平滑肌细胞悬液。吸取数滴细胞悬液加入到显微镜载物台上细胞记录槽中(25-30℃),静置5min,用记录ICa-L细胞外液冲灌细胞10min。再通过全细胞膜片钳记录方法对细胞进行钳制,脉冲信号由Pulse+Pulsefit软件控制,经EPC-9放大器放大,由Pulse软件收集并存储于计算机硬盘中。玻璃微电极充灌电极内液后电阻为2.5—3.5MΩ,对结肠平滑肌细胞进行封接,当封接电阻达1GΩ以上后,补偿快电容,施加负压吸破细胞膜,给予慢电容和漏电容补偿,形成全细胞记录模式。将膜电位钳制在-60mV,指令电位由-50mV到+50mV,跃阶10mV,钳制时间300ms,可记录到一缓慢的内向电流,此电流在-40mV开始激活,在+10mV达到最大,之后随钳制电压的增加逐步减小。给予10μmol/L的L型钙通道拮抗剂尼卡地平可以明显抑制该电流,表明此电流为ICa-L。记录ICa-L经Pulse软件采集并存储于计算机,后用Igor Pro分析软件对实验图形进行拟合分析处理。为消除细胞大小对统计影响,电流电位用电流密度(pA/pF)表示。ICa-L的电流-电压曲线(Current-voltage Curve,I-V曲线)是以各自指令电压为横坐标,相对应的电流密度为纵坐标绘制。
1.4 统计学处理
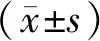
2 结 果
2.1 三组大鼠主要临床特征比较
在完成IBS造模并经过连续2个灌胃疗程,且继续饲养2周后第2天比较各组大鼠主要临床特征发现,三组大鼠主要临床特征差异均有统计学意义(P<0.01)。与对照组比较,IBS组大鼠皮毛枯黄无光泽,精神萎靡不振,厌食,体形消瘦,体重减轻明显,排便颗粒数及其含水量、以及IBS发生率均增加显著(t均>14.71,P<0.01);而BBR组大鼠毛发光亮洁白,食欲良好,身体肥大,排便次数减少,明显好于IBS组大鼠临床症状,与IBS组比较,BBR组大鼠体重增加量、2h内排出粪粒数及其含水减少量、IBS发生率均得以改善和减少(t均>9.62,P<0.01),恢复到对照组水平(t均<1.74,P均>0.05)。见表1。

表1 三组大鼠主要临床特征的比较均=15)
注:与对照组比较,1)P<0.01;与IBS组比较,2)P<0.01
2.2 三组大鼠结肠敏感性和动力异常主要指标比较
三组大鼠结肠敏感性和动力异常主要指标差异均有统计学意义(P<0.01)。与对照组比较,IBS组大鼠腹部抬起和背部拱起所需注水量减少明显,结直肠MI及其变化率增加显著(t均>20.17,P<0.01);经BBR灌胃作用后,BBR组大鼠上述各异常观察值均较IBS组改善(t均>15.05,P<0.01),基本恢复到对照组水平(t均<3.18,P均>0.05)见表2。

表2 三组大鼠结肠敏感性和运动失常主要指标比较均=15)
注:与对照组比较,1)P<0.01;与IBS组比较,2)P<0.01
2.3 三组大鼠结肠平滑肌细胞ICa-L及其I-V曲线比较
与对照组比较,IBS组大鼠结肠平滑肌细胞ICa-L幅度明显增大,而BBR组ICa-L幅度较IBS组显著减小,且随着钳制电压增大,ICa-L减小幅度更明显,接近对照组范围。当钳制电位为+10mV时,三组大鼠结肠平滑肌细胞ICa-L差异有统计学意义(F=73.58,P<0.01),与对照组比较,IBS组大鼠结肠平滑肌细胞ICa-L明显增大[(7.69±0.45)pA/pF vs(15.38±2.19)pA/pF,t=13.08,P<0.01],与IBS组比较,BBR结肠平滑肌细胞ICa-L明显减小 [(15.38±2.19)pA/pF vs(10.91±0.58)pA/pF,t=3.13,P<0.05]。另外,BBR组大鼠结肠平滑肌细胞ICa-L的I-V曲线较IBS组明显上抬,处于IBS组和对照组之间,接近对照组,且各组I-V曲线的形态方向没有发生改变,提示记录结果稳定可靠。见图1、图2。

注:A,对照组;B,IBS组;C,BBR组图1 三组大鼠结肠平滑肌细胞ICa-L

图2 三组结肠平滑肌细胞ICa-L的I-V曲线
3 讨 论
流行病学调查显示我国普通人群IBS总体患病率为6.5%,其中22%曾因IBS症状而就诊[8]。其主要病理生理基础为胃肠道高敏感性和蠕动紊乱,二者或为单一引起,或多重因素合并诱发。鉴于此,本实验IBS模型制备遵循国际公认CRD,即用一种体外强加的不利单因素影响大鼠的胃肠道功能,使大鼠无论从精神上还是胃肠道内环境稳定上得到折磨,出现毛发干枯灰黄,食欲减退消瘦、排便次数增加且性状为稀水或糊状等临床症状,提示制备IBS模型成功,且高达93%的发生率,适合进行下一步的药物干预实验。然而目前治疗IBS多限于西药制剂,看似起效快,但远期疗效差,部分西药可导致心血管毒性,高血压危象,性功能障碍、失眠和药物抵抗等并发症,至今尚存争议[9]。研究发现中草药具有良好的抗IBS作用,与西药相比毒性反应较小。BBR是黄连中最主要的活性成分,对肠道疾病特别是腹痛、腹泻等症状有良好的治疗效果。本实验观察结果表明,经BBR干预后的IBS大鼠,毛发光亮洁白,食欲良好,身体肥大,排便次数减少,体重增加更明显,2h内排出粪便颗粒数及其含水减少量均较显著,引起IBS发生率也较明显下降,提示BBR对IBS症状具有明显改善作用,且本实验是在BBR作用之后,停药2周进行相关指标观察,提示BBR治疗效果的稳定性和持续性,不易复发,显示BBR治疗IBS具有更显著的优势[10]。
IBS的发生来自肠道高敏感性和动力异常反应,对其评估常选用引起各种感觉和运动变化的容量或压力阈值,但对其有效治疗药物选择仍处在开发之中[11]。BBR作为临床上一种物美价廉的传统止泻药物,被用来治疗急慢性胃肠炎等肠道疾病历史悠久,适用范围广,疗效肯定。近年来临床研究表明,BBR能够缓解腹泻、腹痛、腹胀等具有IBS临床特征的疾患。本实验结果表明,接受BBR作用的IBS大鼠的粪便排出量及其含水量均明显减少,引起结直肠敏感性的腹壁回撤反射需要的注水量显著增多,提示结直肠能够经受更大外力刺激,不易发生痉挛而产生紊乱性激烈蠕动。同时反映结直肠运动剧烈与减弱的运动指数及其变化率明显下降,说明BBR对IBS大鼠的结直肠特别敏感性及其运动异常起到明显抑制作用,可改善IBS大鼠排便习惯及其性质,增加直结肠抵抗外部强烈刺激的能力,降低胃肠道压力,减慢直结肠蠕动,缓解IBS大鼠的腹痛和/或腹泻等临床症状。所以,从治疗效果可以看出,BBR对IBS大鼠的胃肠道高敏感性和动力异常形成的紊乱性腹痛、腹泻等肠道不适状态均有明显改善。
IBS发生出自结肠平滑肌收缩反应过度,张力增高,敏感性增强,其形成机制可能是平滑肌细胞ICa-L增加及其动力学发生异常改变,引起离子通道电重构,造成结肠平滑肌细胞内Ca2+超载,诱发结肠性动作电位触发活动,导致结肠平滑肌细胞动作电位节律失常[12]。而BBR具有钙通道拮抗剂作用,可减少基础状态和受刺激后人结肠黏膜的离子转运,抑制平滑肌细胞上ICa-L,阻止小肠上皮细胞异常分泌,防治平滑肌异常过度敏感与异常蠕动,治疗分泌性腹泻,发挥治疗IBS等功效[13]。本文实验结果也表明,经BBR作用后的IBS大鼠的结肠平滑肌细胞ICa-L被显著抑制,电流幅度在各钳制电压下均明显减小,I-V曲线明显上抬向对照组大鼠结肠平滑肌细胞ICa-L的 I-V 曲线靠近。说明BBR作用IBS大鼠结肠平滑肌细胞ICa-L的效果非常显著,从而改善了IBS大鼠结肠平滑肌细胞膜上ICa-L的电重构,防止IBS大鼠结肠平滑肌细胞外过多Ca2+通过ICa-L进入细胞内,引起Ca2+触发Ca2+释放(Ca2+-induced Ca2+release,CICR)的连锁反应,造成结肠平滑肌细胞内Ca2+超载,引起Ca2+震荡,诱发结肠性动作电位节律紊乱,敏感性异常而出现的IBS症状[14]。
综上所述,BBR可改善IBS大鼠临床特征,结肠敏感性和动力异常,其机制可能是BBR可以抑制大鼠结肠平滑肌细胞膜上ICa-L,该结果为BBR更好地应用于临床治疗IBS提供了实验依据和药理基础。
◀

