芦荟大黄素诱导斑马鱼肝毒性及作用机制研究
刘艺 王瑞昕 游龙泰 董晓旭
斑马鱼与人类基因同源性高达85%,拥有广泛的细胞色素P450酶参与代谢反应,包括氧化、羟基化、接合、去甲基化和甲基化[1-3],能体现Ⅰ相、Ⅱ相、肠菌及多途径代谢的综合结果。另具有饲养成本低、体外受精、透明易观察、单次产卵数较高等特点[4-5]。目前斑马鱼已被美国国家卫生研究院列为继人和鼠之后的第三大模式生物,可以快速筛选药物和定量评价待测化合物的肝毒性作用。
大黄为蓼科植物掌叶大黄RheumpalmatumL.、唐古特大黄RheumtanguticumMaxim.ex Balf.或药用大黄RheumoffcihaleBaill.的干燥根和根茎,具有泻热通肠、凉血解毒、逐瘀通经的功效[6-7]。然而, 近年有报道大黄中成分对机体的肝功能有不良影响,长期应用可能引起肝损伤,推测芦荟大黄素可能为肝毒性成分之一[8-10]。另有研究表明芦荟大黄素能明显诱导动物肝细胞发生DNA损伤[11],但芦荟大黄素的体内致肝毒性作用机制尚未明确。因此,本研究中利用斑马鱼独特的生理结构优势,通过观察不同浓度芦荟大黄素处理后斑马鱼生存率,确定10%致死浓度(10% lethal concentration,LC10)与最大非致死浓度(maximum non-lethal concentration,MNLC);进而研究斑马鱼肝脏形态、肝脏不透光度平均值,卵黄囊吸收延迟面积的影响。最后,对斑马鱼CYP450酶,凋亡相关蛋白等进行检测,探讨芦荟大黄素致肝毒性的作用机制。
1 材料与方法
1.1 实验动物
野生型AB品系斑马鱼,以自然成对交配繁殖方式进行。以上斑马鱼均饲养于28 ℃的养鱼用水中(水质:每1 L反渗透水中加入200 mg速溶海盐,电导率为480~510 μS/cm;pH为6.9~7.2;硬度为53.7~71.6 mg/L CaCO3)。饲养管理符合国际实验室动物护理评估和认证协会(AAALAC)认证的要求。
1.2 实验用药、试剂与仪器
芦荟大黄素购自上海诗丹德生物技术有限公司(批号:111573,纯度>98.0%);甲基纤维素购自Sigma(China)公司 (批号:9004-67-5) ;二甲基亚砜购自Sigma(China)公司 (批号:67-68-5)。Caspase3试剂盒(批号:0000273306);Caspase9试剂盒(批号:0000271121);CYP3A4试剂盒(批号:0000269999)均购自Promega公司。
解剖显微镜(SZX7,OLYMPUS,Japan);与显微镜相连的相机(VertA1);精密电子天平(CP214,奥豪斯);6孔板(Fisher Scientific,China);多功能酶标仪(LB940,Berthold Technologies,Germany);96孔酶标板(Corning Incorporated,USA)。
1.3 芦荟大黄素储备液的制备
称取适量芦荟大黄素,用DMSO配制成一定浓度的药物储备液,-20℃保存,实验前用养鱼水稀释,制备成的最终工作液中DMSO浓度不超过1%。
1.4 MNLC和LC10测定
随机选取270尾受精后3天(3 dpf)野生型AB品系斑马鱼于六孔板中,每孔(实验组)均放置30尾斑马鱼,水溶给予药物浓度分别为100、200、300、400、600、800和1000 μM,同时设置正常对照组(养鱼用水处理斑马鱼)和溶剂对照组(1% DMSO)。每天统计各实验组的斑马鱼死亡数量并及时移除,处理48小时后,观察记录每个实验组斑马鱼的死亡情况,计算其死亡率(%),用OriginPro 8.0统计学软件绘制最佳的“死亡率-浓度”效应曲线,计算芦荟大黄素对斑马鱼肝脏毒性的MNLC和LC10。
1.5 斑马鱼肝脏毒性评价
随机选取120尾受精后3天(3 dpf)野生型AB品系斑马鱼于6孔板中,实验组每孔均放30尾斑马鱼,分别水溶给予药物MNLC/3和MNLC浓度,同时设置正常对照组和溶剂对照组。用药物处理斑马鱼48小时后,每个实验(浓度)组随机选取10尾斑马鱼在解剖显微镜下拍照,用NIS-Elements D 3.10高级图像处理软件进行图像分析并采集数据,计算斑马鱼肝脏面积、肝脏不透光度平均值和卵黄囊吸收延迟面积。
1.6 斑马鱼细胞色素P450检测
随机选取120尾受精后3天(3 dpf)野生型AB品系斑马鱼于6孔板中,每孔(实验组)均放30尾斑马鱼,分别水溶给予药物MNLC/3和MNLC浓度,同时设置正常对照组和溶剂对照组。芦荟大黄素处理斑马鱼48小时后,加入CYP试剂盒检测CYP 3A4的活性,应用多功能酶标仪分析统计各实验组斑马鱼相对发光单位(relative luminescence units,RLU)信号强度,进行定量分析。
1.7 斑马鱼凋亡蛋白检测
随机选取120尾受精后3天(3 dpf)野生型AB品系斑马鱼于6孔板中,实验组每孔均放30尾斑马鱼,分别水溶给予供试品MNLC/3和MNLC浓度,同时设置正常对照组和溶剂对照组。药物处理斑马鱼48小时后,用Caspase试剂盒检测与凋亡相关的含半胱氨酸的天冬氨酸蛋白水解酶家族的Caspase3和Caspase9的活性,通过酶标仪检测RLU信号强度,评价药物各浓度对斑马鱼Caspase3和Caspase9活性的影响。
1.8 统计学处理

2 结果
2.1 芦荟大黄素对斑马鱼的MNLC和LC10
芦荟大黄素在300、400、600、800和1000 μM浓度条件下,分别诱发2/30、15/30、27/30、29/30和30/30尾斑马鱼死亡,死亡率分别为6.7%、50%、90%、96.7%和100%。药物MNLC和LC10“死亡率-浓度”数据见表1。用OriginPro 8.0软件拟合浓度-致死曲线(图1),经过曲线拟合,求得:芦荟大黄素对斑马鱼的LC10为312 μM,MNLC为229 μM。在后续肝毒性评价实验中,设置了1/3MNLC与MNLC为各给药组。
2.2 芦荟大黄素对斑马鱼肝脏毒性结果
与斑马鱼正常对照组(18631像素)相比,溶剂对照组的斑马鱼肝脏面积(18627像素)并未见显著差异(P>0.05),表明空白溶剂对斑马鱼肝脏面积无影响。与溶剂对照组相比,各给药组(76.3 μM和229 μM)的斑马鱼肝脏面积分别为18204和18331像素,未见显著差异(P>0.05),表明芦荟大黄素在该浓度内对斑马鱼肝脏面积无明显影响。
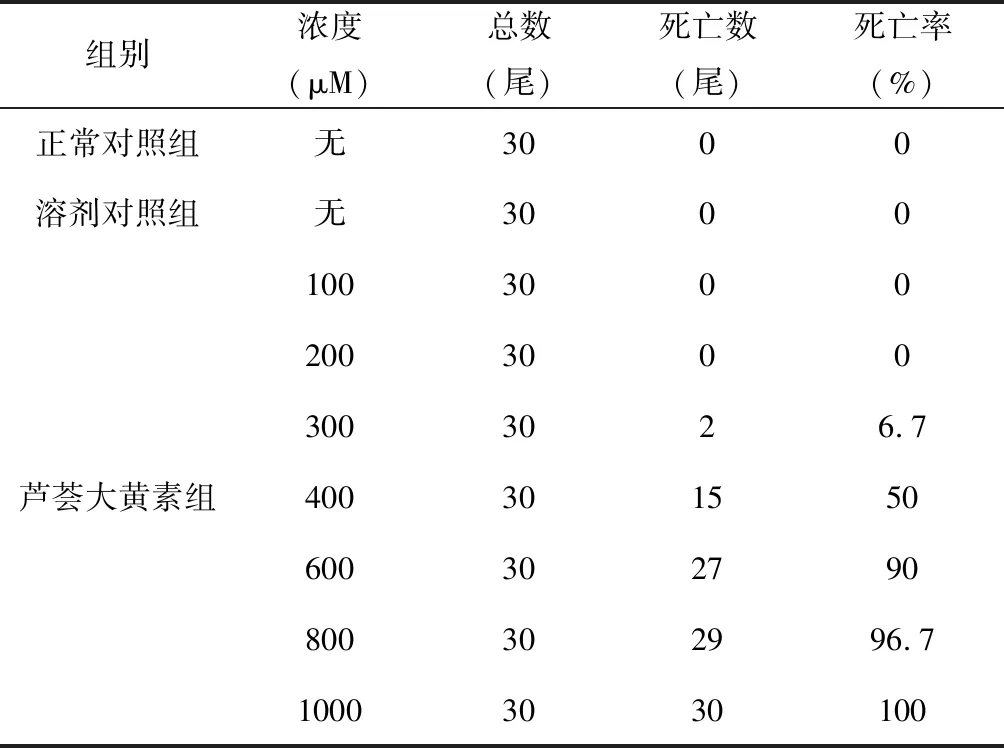
表1 芦荟大黄素对斑马鱼的MNLC和LC10
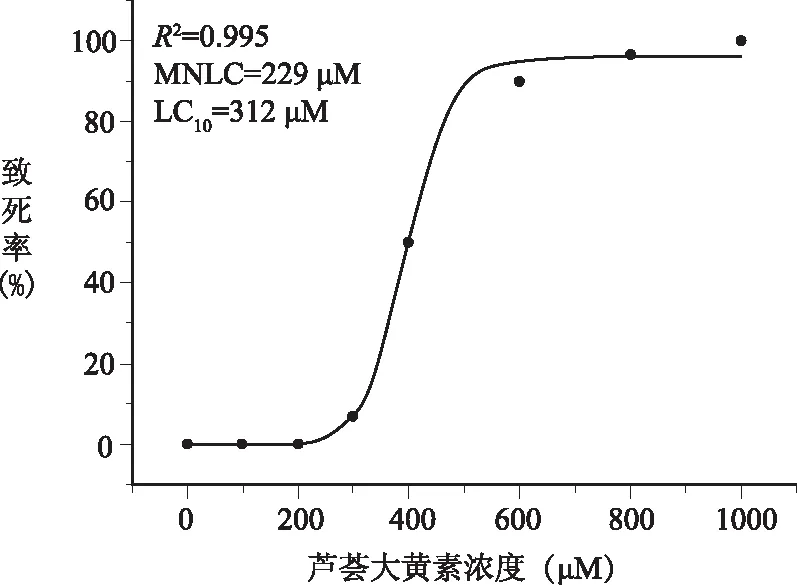
图1 芦荟大黄素对斑马鱼的致死率
与斑马鱼正常对照组相比,溶剂对照组斑马鱼肝脏不透光度平均值未见显著差异,表明空白溶剂对斑马鱼肝脏变性无影响。与溶剂对照组相比,各给药组(76.3 μM和229 μM)的斑马鱼肝脏不透光度平均值有显著性差异(P<0.001),表明芦荟大黄素在该浓度内可诱发斑马鱼肝脏变性。
与斑马鱼正常对照组(2141)相比,溶剂对照组斑马鱼卵黄囊吸收延迟面积(1772像素)未见显著差异,表明空白溶剂对斑马鱼卵黄囊吸收无影响。与溶剂对照组相比,各给药组(76.3 μM和229 μM)的斑马鱼卵黄囊吸收延迟面积分别为14608和41478像素,有显著性差异(P<0.05,P<0.001),表明芦荟大黄素在该浓度内可诱发斑马鱼卵黄囊吸收延迟(表2、图2)。
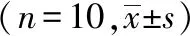
表2 芦荟大黄素对斑马鱼肝脏的影响
注:与溶剂对照组比较,aP< 0.05。
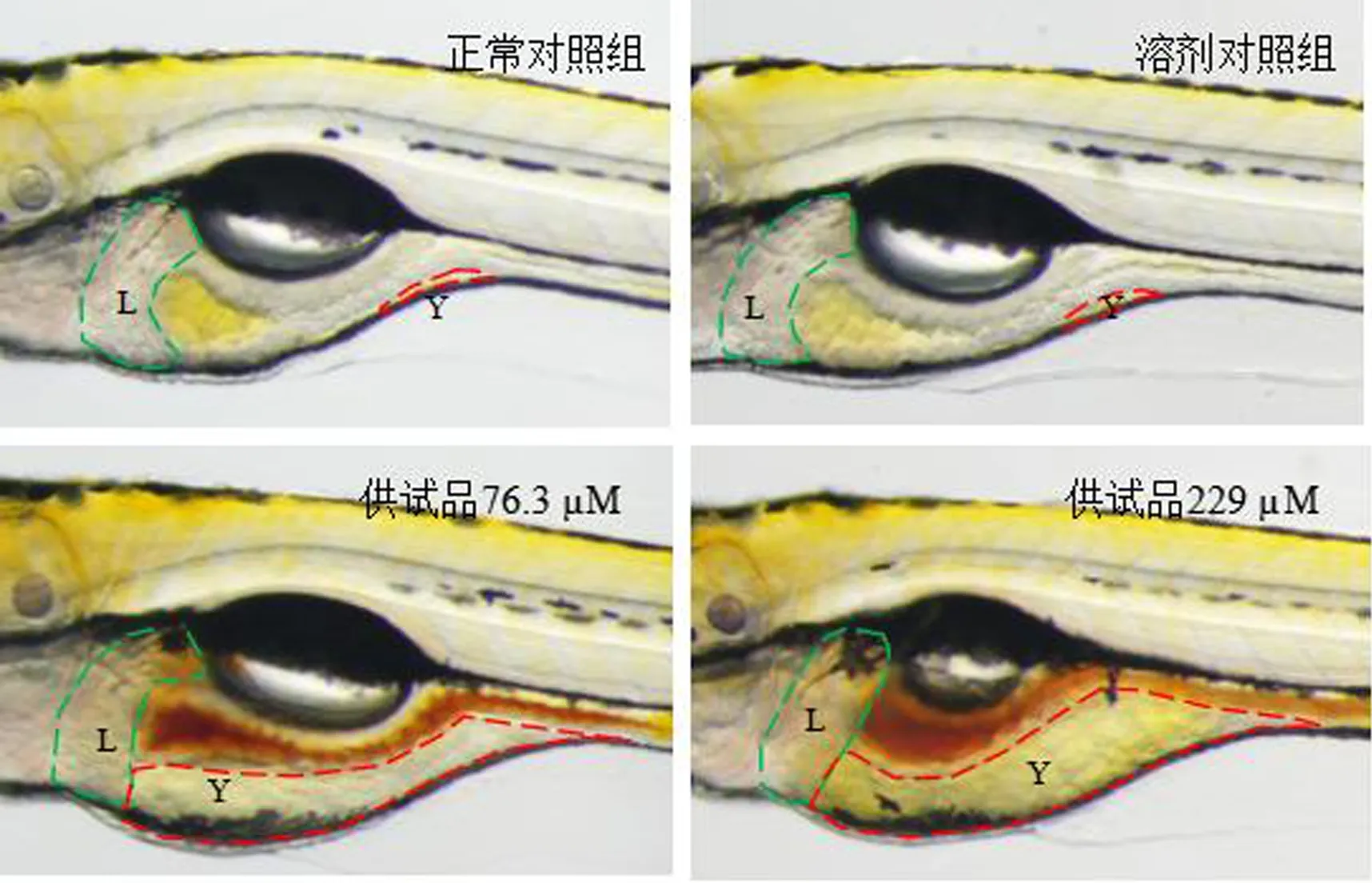
注:L:肝脏;Y:卵黄囊。
图2斑马鱼暴露芦荟大黄素后肝毒性的视觉表型
2.3 芦荟大黄素对CYP450酶的影响
CYP450 3A4约占人体肝脏CYP450的30%~40%,有近50%的药物通过它进行代谢[12]。结果显示:溶剂对照组斑马鱼CYP3A4 RLU的活性(4006)与正常对照组(4251)比较,P>0.05,提示1% DMSO对斑马鱼细胞色素P450(CYP)活性无影响。MNLC/3浓度组斑马鱼CYP 3A4 RLU的活性为3100,MNLC浓度组斑马鱼CYP3A4 RLU的活性为2887,表明芦荟大黄素对斑马鱼CYP 3A4有显著的抑制作用。见表3。
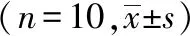
表3 芦荟大黄素对斑马鱼体内 CYP450 3A4活力的影响
注: 与溶剂对照组比较,aP<0.05。
2.4 芦荟大黄素对斑马鱼凋亡蛋白的影响
芦荟大黄素处理斑马鱼后,分别对各实验组的斑马鱼体内的凋亡通路相关蛋白酶Caspase3和Caspase9的活性进行了检测。结果显示:溶剂对照组的斑马鱼Caspase3和Caspase9活性与正常对照组相比,P>0.05,说明空白溶剂对斑马鱼Caspase3和Caspase9无影响。另外,各给药组(76.3 μM和229 μM)斑马鱼Caspase3和Caspase9活性均显著高于溶剂对照组,且呈现明显剂量依赖关系。表明芦荟大黄素能上调Caspase9蛋白,引发级联反应,导致Caspase3酶表达升高,诱导肝细胞凋亡。见表4、表5。
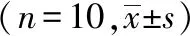
表4 芦荟大黄素对斑马鱼体内 Caspase3蛋白的影响
注: 与溶剂对照组比较,aP<0.05。
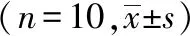
表5 芦荟大黄素对斑马鱼体内 Caspase9蛋白的影响
注: 与溶剂对照组比较,aP<0.05。
3 讨论
斑马鱼因与人基因同源高、样本量大、具有体外受精和胚胎透明、易于养殖和活体观察、方便控制实验条件和检测等独特优点,广泛应用于疾病模型的建立和药物筛选中[13]。关于斑马鱼在肝脏领域的研究报道逐渐增多,已经建立了酒精性脂肪肝、药物性肝损害和肝癌模型[14-17]。张云等[18]研究了不同浓度对乙酰氨基酚对肝脏荧光转基因斑马鱼幼鱼的肝脏毒性,经对乙酰氨基酚处理后肝脏颜色变暗,卵黄囊肿,肝脏组织的 L-FABP 荧光表达下降,肝脏出现萎缩。 He等[19]用斑马鱼评价6种已知对人有肝毒性的药物以及2种无肝毒性药物的肝毒性,评价指标为:肝变性、肝肿大(萎缩)以及卵黄囊吸收延迟(意味着肝功能受到影响)。单盲法评价结果显示,斑马鱼评价结果预测准确率为100%,组织病理学分析证实了斑马鱼表型观察对药物肝毒性预测的可靠性。目前,美国FDA和欧洲EMA已经接受用斑马鱼肝毒性评价数据进行药物临床申报。
本研究通过观察不同浓度芦荟大黄素(100~1000 μM)暴露后斑马鱼的一般情况,如生存率与表型等,发现随着药物浓度的升高和处理时间的延长,斑马鱼生存率显著下降,呈现明显剂量反应关系。肝脏毒性评价指标显示,芦荟大黄素(76.3 μM、229 μM)未明显改变斑马鱼的肝脏面积,但随着芦荟大黄素浓度增大,斑马鱼的肝脏不透光度增加及卵黄囊吸收延迟面积增大。芦荟大黄素对斑马鱼CYP 3A4酶有显著的抑制作用,呈现明显剂量—反应关系。ELISA结果表明,芦荟大黄素(76.3 μM、229 μM)能显著上调Caspase9蛋白水平,引发级联反应,导致Caspase3酶表达升高,诱导斑马鱼肝细胞凋亡。
本实验结果表明,芦荟大黄素能诱导斑马鱼肝毒性发生,作用机制可能与芦荟大黄素激活凋亡相关蛋白,诱导肝细胞凋亡,并且诱导斑马鱼Ⅰ相代谢酶的异常表达相关。

