截断逆挽方含药血清对D-氨基半乳糖诱导的人正常肝细胞LO2细胞增殖影响
吴梦丽 梁嘉俊 魏飞力 杨文龙 杜宇琼 张秋云
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是在慢性肝病的基础上发生急性肝功能衰竭的一组临床综合征,病死率极高[1]。在中国,HBV-ACLF为其最常见类型[2],且目前发病机制尚不明确。现多认为肝细胞大量死亡是ACLF的核心事件,同时伴肝细胞增殖障碍致其再生不足[3]。该病目前没有特异疗法,主要以支持治疗和肝移植为主[4]。但有研究显示ACLF发生时肝细胞可进行增殖并修复肝组织损伤[5],通过调节肝细胞增殖,从而改善肝脏急性损伤是阻止ACLF进一步发展的关键途径之一[6]。而转录因子E2F1是调控细胞增殖的关键转录因子,能促使细胞从G1期向S期转换,加快细胞增殖进程[7]。本课题组前期动物实验发现截断逆挽方能抑制ACLF模型大鼠肝细胞的过度凋亡,促进肝细胞的代偿性增殖,极大地减轻并逆转ACLF模型大鼠肝细胞的损伤[8-10]。本研究在此基础上利用体外细胞实验进一步观察截断逆挽方含药血清调控E2F1介导的细胞增殖,减轻D-氨基半乳糖(D-Galactosamine,D-GlaN)诱导的人正常肝细胞LO2细胞损伤的作用机制。
1 材料与方法
1.1 细胞及动物
LO2细胞,由首都医科大学中医药学院肝病实验室赠送。
雄性Wistar大鼠20只,体重250~280 g,SPF级,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2016-0006,饲养于首都医科大学实验动物科学部SPF级动物室。
1.2 实验药物及试剂
截断逆挽方组成:苦味叶下珠30 g、瓜蒌30 g、金钱草30 g、生黄芪30 g、槲寄生30 g、三七6 g、莪术6 g、丹参20 g、生地黄20 g、黑附片先煎15 g,购自于北京同仁堂中医医院药房,经国医大师金世元生药鉴定。在首都医科大学中医药学院实验中心水煎提取。根据前期实验结果[10],确定中药组每只大鼠按照体重每日给予21.7 g/(kg·d)中药剂量效果最佳,水煎液浓缩成4.34 g/mL,盛装在灭菌玻璃瓶内,4℃冰箱冷藏备用,使用前热水浸泡,摇匀。
DMEM高糖培养基(Hyclone,美国)、PBS(HyClone,美国)、胎牛血清(Excell Bio,澳洲)、Cell Counting Kit-8(cck8)(Dojindo,日本)、D-GlaN(Sigma,美国)。Real-time PCR相关试剂:RNApre Pure培养细胞/细菌总RNA提取试剂盒(TIANGEN)、FastKing RT Kit(TIANGEN)、SuperReal PreMix Plus(TIANGEN)均购自于天根生化科技有限公司。蛋白印迹法一抗:E2F1 Rabbit mAb(CST,美国)、β-Actin Rabbit mAb(CST,美国)、DP1 Rabbit mAb(CST,美国)。
1.3 主要实验仪器
低温离心机(Heraeus,Biofuge 15r)、酶标仪(SpectraMax iD3,美国)、流式细胞仪(BECKMAN COULTER,美国)、RT PCR仪(BIO-RAD,美国)、垂直电泳槽(Bio-Rad,美国)、Fujifilm成像系统(LAS-3000,日本)。
1.4 方法
1.4.1 含药血清的制备 Wistar大鼠随机分成空白对照组和截断逆挽方组,每组10只。灌胃给药,1 mL/100 g体重/次,每日两次灌胃。空白对照组灌服生理盐水,按照1 mL/100 g体重/次,每日2次。各组连续3天。末次灌胃2小时后,麻醉,采集腹主动脉血,4℃静置4小时,以3000 r/min速度4℃离心30分钟,吸取上清液,超净台微孔滤膜过滤除菌,56℃水浴灭活30分钟,室温冷却,标记分装,置于-80℃冰箱保存备用。
1.4.2 LO2细胞的培养 LO2细胞复苏后置于25 cm培养瓶内,每瓶添加5 mL含10%胎牛血清的DMEM培养基,37℃、5%CO2的细胞培养箱中培养,待细胞融合至80%左右,按照1∶3比例传代。
1.4.3 D-GlaN诱导LO2细胞损伤模型 取指数生长期的LO2细胞,以8000个/孔的细胞悬液接种于96孔板中,置于培养箱培养12小时后,弃旧液。每孔加入100 μL不含血清的培养基饥饿12小时,以使细胞周期同步。用含10%FBS的DMEM以100 μL/孔的量加入96孔板培养24小时后弃旧液。用含10%FBS的培养基稀释成不同浓度的D-GlaN工作液(30、60、90、120、150 mmol/L)为实验组,另设不含D-GlaN工作液的为对照组,无细胞的空白组,每组设6个复孔。D-GlaN工作液分别作用于各组细胞8小时后,用PBS洗两次,然后每孔加入10%的CCK8工作液孵育2小时后于酶标仪450 nm处测定各孔的吸光度, 计算细胞存活率, 细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%,以筛选出D-GlaN的最合适造模浓度。实验重复3次。

表1 RT-PCR各基因引物序列
1.4.4 分组及给药 待细胞生长至指数期时,胰酶消化,调整细胞浓度为4×105个/mL接种于培养瓶中,随机分为5组:正常组、模型组、2.5%JDNWF、5%JDNWF、10%JDNWF。在含10%FBS的DMEM培养基培养12小时后,吸弃旧培养基,加入无血清的DMEM培养基继续培养12小时,以同步各组细胞周期,12小时后弃旧液。正常组加入含10%大鼠血清的DMEM培养基,模型组加入含10%大鼠血清的DMEM培养基,2.5%JDNWF加入含有2.5%的截断逆挽方含药血清的DMEM培养基,5%JDNWF加入含有5%的截断逆挽方含药血清的DMEM培养基,不足10%的用空白对照大鼠血清补足。10%JDNWF加入含有10%的截断逆挽方含药血清的DMEM培养基。除正常组外其余各组均加入上述造模浓度的D-GlaN进行干预。
1.5 指标检测
1.5.1 CCK8法检测细胞存活率 各组细胞处理后,吸弃旧培养基,PBS清洗2遍,按照10∶1的比例配制CCK8溶液,每孔110 μL,37℃孵育2小时后测定OD值。
1.5.2 流式细胞仪检测各组细胞周期 各组细胞处理后,弃旧液,胰酶适度消化,培养液吹打,800 r/min,离心15分钟去上清。PBS洗2次,加0.5 mL的PBS吹匀后用力打入5 mL已预冷的70%乙醇中,4℃固定过夜。固定后1000 r/min离心5分钟,弃上清,PBS洗2次,加入1 mL RNAse溶液(20 μg/mL),37℃反应30分钟后室温冷却。加入0.1 mL的PI染液,染色30分钟后上流式细胞仪检测。
1.5.3 Real-Time PCR检测各组E2F1、CDK2、cyclin A、cyclinE、CDC25A基因的表达 各组细胞处理后,根据总RNA提取试剂盒说明书操作步骤进行。细胞总RNA提取后根据逆转录说明书进行配液,将总RNA反转成cDNA。配制Real Time PCR反应液,反应条件为95℃(15分钟),95℃(10秒)、60℃(20秒)、72℃(30秒)40个循环。反应完成后使用,得到样本目的基因和内参CT值,根据2-△△CT法检测目的基因的相对表达水平。引物序列,详见表1。
1.5.4 Western Blot检测各组细胞DP1蛋白表达情况 各组细胞药物干预后,弃旧液,PBS洗2次,加入裂解液,裂解10分钟后刮取细胞,离心取上清液,蛋白定量后加入适量的Loading Buffer,将其置于金属浴中,100℃、10分钟进行蛋白变性。配制10%的分离胶和浓缩胶,每个样本取20 μg蛋白开始上样电泳,电泳条件为90 V、30分钟,120 V、60分钟。电泳结束后进行转膜,转膜条件为300 mA、60分钟。转膜后剪去目的蛋白和内参条带,以5%脱脂牛奶进行封闭1小时,TBST清洗3次,每次10分钟。之后孵育一抗,4℃过夜。复温1小时后,TBST清洗3次,每次10分钟。二抗孵育1小时后TBST清洗3次,每次10分钟。配制ECL发光液随后进行蛋白条带曝光。
1.6 统计学处理

2 结果
2.1 CCK8法检测D-GlaN对LO2细胞活力的影响
CCK8结果显示,D-GlaN能够导致细胞活性下降,并呈浓度依赖性。但当D-GlaN浓度达到60 mmol/L时,细胞活力下降趋势最显著,与对照组比较有显著性差异(P<0.01)。此外有研究表明D-GlaN在该浓度条件下可避免肝细胞坏死并最大限度地引起引起肝细胞损伤[11]。故后续实验采用60 mmol/L的D-GlaN浓度作为造模浓度。结果见表2。

表2 CCK8法检测D-GlaN对LO2细胞活力的影响
注: 与对照组相比,aP<0.01。
2.2 CCK8法检测各组D-GlaN诱导LO2细胞存活率比较
CCK8结果显示,与模型组相比,不同浓度截断逆挽方含药血清组的细胞存活率均有所升高(P<0.05,P<0.01),但含药血清浓度为5%时细胞存活率升高幅度最大。这表明截断逆挽方含药血清能增强LO2细胞活力,改善肝细胞损伤情况,但以5%浓度的含药血清效果最佳。结果见表3。

表3 各组D-GlaN诱导LO2细胞存活率比较
注: 与正常组相比,aP<0.01;与模型组相比,bP<0.05,cP<0.01。
2.3 各组D-GlaN诱导LO2细胞周期比较
流式细胞术结果显示,模型组较正常组G1期比例明显减少(P<0.05),但是S期和G2期无明显变化。截断逆挽方含药血清组较模型组G1期细胞比例明显增加(P<0.05,P<0.01)。2.5%JDNWF组与模型组比较,S期和G2/M期细胞比例无明显变化。5%JDNWF和10%JDNWF组与模型组比较,S期和G2/M期细胞比例均显著增加(P<0.01),但5%JDNWF组S期细胞比例较10%JDNWF组增加更加明显。这提示截断逆挽方含药血清可加快细胞进入G1期的进程,并且浓度越高,细胞向S期转换的进程越快。见图1和表4。


组别nG0/G1(%)S(%)G2/M(%)正常组348.07±1.3143.53±0.748.42±1.51模型组351.70±0.90a39.47±1.768.82±0.862.5%JDNWF346.73±2.40c43.00±3.4610.26±1.555%JDNWF335.23±3.18d53.13±5.18d11.62±2.03d10%JDNWF340.5±0.95d47.83±0.06d11.66±0.98d
注: 与正常组相比,aP<0.05,bP<0.01;与模型组相比,cP<0.05,
dP<0.01。
2.4 各组D-GlaN诱导LO2细胞E2F1、cyclin E、cyclin A、CDK2、CDC25A mRNA表达的影响
PCR结果显示,模型组E2F1、cyclin E、cyclin A、CDK2、CDC25A mRNA与正常组相比表达均下降,差异显著(P<0.01)。截断逆挽方含药血清组E2F1、cyclin E、cyclin A、CDK2、CDC25A mRNA与模型组相比表达均上调,差异显著(P<0.01);但以5%的截断逆挽方含药血清组各基因的mRNA表达上调最明显。结果见表5。

表5 各组D-GlaN诱导LO2细胞E2F1、cyclin E、cyclin A、CDK2、CDC25A mRNA的相对表达量比较
注: 与正常组相比,aP<0.01;与模型组相比,bP<0.05,cP<0.01。
2.5 Western Blot检测截断逆挽方含药血清对D-GlaN诱导LO2细胞DP1蛋白表达情况
Western Blot结果显示,与正常组相比,模型组DP1表达量有所下降(P<0.01);与模型组相比,截断逆挽方含药血清组DP1表达量均有所上升(P<0.05,P<0.01)。实验重复3次,结果见图2和表6。

注:A:正常组;B:模型组;C:2.5%JDNWF;D:5%JDNWF;E:10%JDNWF
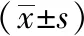
图2 各组D-GlaN诱导LO2细胞DP1蛋白 表达免疫印迹电泳表6 各组D-GlaN诱导LO2细胞DP1蛋白的 相对表达量(IOD值)
注: 与正常组相比,aP<0.01;与模型组相比,bP<0.05,cP<0.01。
3 讨论
现代研究表明慢加急性肝衰竭的病理特点是大量的肝脏细胞坏死、过多凋亡和再生不足[12],该病西医目前尚无有效的治疗手段。截断逆挽方是全国名中医钱英教授根据ACLF“毒瘀和正虚交织”的病机特点拟定的基础方[13],全方由苦味叶下珠、瓜蒌、金钱草、生黄芪等组成,共奏清热解毒、凉血化瘀、调补气血阴阳之效,早期快速截断病势,同时固护人体气血,扭转危局[14]。临床研究发现该方能在一定程度上改善肝功能、降低病死率[15],而且课题组前期进行动物实验研究表明该方能降低ACLF模型大鼠的炎症因子如白细胞介素6、肿瘤坏死因子-α水平,保护肝功能,减轻肝细胞损伤[8-10],但具体机制不清。本实验中,CCK8法检测进一步发现截断逆挽方含药血清能显著增强肝细胞活力,进一步表明该方能保护肝细胞并逆转肝细胞损伤。
此外,在实验中还观察到明显的肝细胞增殖现象。既往的研究显示,肝脏未处于病理状态时,肝细胞处于G0期。当ACLF发生时,各种刺激性因素作用于肝脏,则会进一步出现肝细胞的坏死和过度凋亡,同时会刺激残存的肝细胞重新进入增殖状态来延缓肝脏损伤速度,恢复肝功能。但是,一旦肝细胞坏死超过肝细胞的再生能力时则会引起肝功能急剧恶化导致肝衰竭的发生。因此结合本实验结果,推测逆挽方保护肝细胞的作用可能系其促进肝细胞增殖所致。通过流式细胞术,发现截断逆挽方含药血清组能促进细胞从G1期向S期的转换。肝脏未处于病理状态时,肝细胞处于G0期,而E2F1作为转录激活子,通过转录激活细胞周期蛋白如cyclin E、cyclin A、cyclin D的表达等促进细胞进入S期。但是E2F1只有与DP1结合形成E2F1/DP1二聚体时才能发挥激活下游基因转录的作用,使细胞顺利通过S期[16]。当静止期细胞重新进入增殖期时,E2F1/DP1正反馈调节下游细胞周期的关键基因cyclin E、cyclin A的转录,产生细胞进入S期所需的蛋白质。而这些周期蛋白只有与细胞周期蛋白依赖激酶(cyclin-dependent kinase,CDK)如CDK4/6、CDK2结合形成活性复合物才能发挥其功能,同时这些活性复合物的形成又依赖于双特异性磷酸酶CDC25A对CDK的去磷酸化[17-19]。在G1晚期cyclin E/CDK2表达达到峰值,活性最强,启动DNA的生物合成,促进细胞进入S期。并且有研究表明若E2F1转录因子活性降低可能会导致cyclin E和CDC25A的表达下调而使细胞增殖处于停滞状态[20]。因此E2F1介导的增殖信号通路是启动肝细胞增殖,加快细胞增殖进程的关键通路。逆挽方不仅能在基因水平上调LO2细胞E2F1 mRNA的表达, 而且各组细胞cyclin E、cyclin A、CDK2、CDC25A mRNA的表达也有所增加,另外在蛋白水平上也证实该方能上调DP1的表达。这些实验结果均表明截断逆挽方能通过刺激LO2细胞中E2F1的表达转录激活细胞增殖所需的各种因子,加快肝细胞从G1期向S期的转换进程,促进细胞增殖。由此表明,通过介导E2F1增殖信号通路来促进肝细胞增殖,减轻D-GlaN诱导的LO2细胞损伤可能是截断逆挽方保护肝细胞的关键机制之一。
截断逆挽方是组方药味多、成分复杂的复方,故其含药血清于体外作用于D-GlaN诱导损伤LO2细胞,可作用于E2F1、cyclin E、cyclin A以及CDC25A等各个环节,极大促进肝细胞的增殖,保护肝功能,为临床推广使用该方提供理论依据。

