补肾阳中药治疗促性腺激素缺乏型男性不育的网络分子机制初探
孟雪丹 张文婷 赵崇军 王昭懿 冯丹 赵霞 顾念念 吴怡青 邹迪新 林瑞超
中医认为,肾为先天之本,主生殖,肾阳是肾气的基础,认为是男性生育的“源头”,即肾阳是精子发生的根本,直接决定男性生育力。中医临床辨证治疗男性不育十分重视运用补肾阳中药,认为肾阳之虚得补,从而消除或改善男性不育。
中西医结合临床研究发现,多种补肾阳中药对促性腺激素缺乏型男性不育具有较好的疗效[1]。现代药理研究发现补肾阳中药治疗促性腺激素缺乏型男性不育的药效机理在于补肾阳中药具有促性腺激素样作用。例如,肉苁蓉具有补肾壮阳、强肝肾益精气等作用,其苯乙醇苷类成分可增强下丘脑-垂体-肾上功能,促进体内相关递质和激素的释放[2];淫羊藿中的淫羊藿苷有性激素分泌促进作用并可产生性激素样作用,通过抑制性腺细胞衰老基因的表达,延迟性腺衰老[3];锁阳中含有性激素样成分及中间体,可直接与受体结合作用,亦可作为合成性激素的原料,还可促进体内原有性激素发挥作用[4];杜仲具有促进雄性激素合成或释放的作用,该作用机制与其阴茎神经传导通路的良好保护作用有关[5];补骨脂所含的补骨脂素可能参与诱导大鼠间充质干细胞向雄性生殖细胞方向的分化[6];鹿茸中含有雄性激素、雌激素和孕激素等甾体化合物,鹿茸的激素样作用与其所含甾类衍生物密切相关[7];海马中化学成分种类繁多,包括氨基酸、甾体类、脂肪酸、微量元素和磷脂等,这些有效成分是海马发挥药理作用的基础,海马在补肾壮阳方面具有很高的价值,可通过提高机体的性激素水平,改善和提高性功能[8]。
促性腺激素缺乏型男性不育的发病机制[9]复杂,涉及大脑皮质-下丘脑、嗅脑-下丘脑、下丘脑-垂体-睾丸等结构的综合调控。现有的治疗策略,实质上是一种类似于“补充式”的办法,往往不能从根本上治疗。因此,如何在根本上综合调控促性腺激素,是有待解决的重要科学问题。着眼于整体发挥综合调控作用的中药被认为是治疗的新希望[10]。然而,由于中药具有化学成分复杂,多成分-多靶点的作用特点,目前补肾阳中药促性腺激素样作用的药效物质基础尚不明确,其药理分子网络机制等关系未见国内报道。生物信息学基于分子间相互作用,可以将复杂的成分和目标蛋白或基因进行网络构建,在多组学和系统生物学间加以联系,帮助研究人员更好了解多成分药物的机制,适用于多成分多靶点特征的中药研究。本研究从探讨分子机制角度出发,通过检索相关权威数据库并使用通路分析软件(ingenuity pathway analysis,IPA)构建补肾阳成分中受美国食品药品监督管理局(Food and Drug Administration ,FDA)批准的药物的促性腺激素样作用靶标网络关系,从整体上分析补肾阳中药可能发挥促性腺激素样作用的成分、作用靶点以及信号通路,初步探讨补肾阳中药改善促性腺激素缺乏男性不育的系统药理学机制,为补肾阳中药治疗促性腺激素缺乏型男性不育奠定理论基础和实验依据,具有一定的科学意义。
1 资料和方法
1.1 数据准备
1.1.1 建立常见补阳中药已知化学成分数据库 于中国科学院上海有机化学研究所化学专业数据库( http://www.organchem.csdb.cn)中药与化学成分数据库-中药材检索模块中,分别检索淫羊藿、锁阳、肉苁蓉、杜仲、补骨脂、鹿茸、海马7味中药,整理出每味药中的已知化学成分列表,包含化合物名称、分子式、CAS号等信息。
1.1.2 收集已知治疗促性腺激素缺乏药物的靶点 可治疗促性腺激素缺乏(gonadotropin deficiency)的药物靶点来自人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM,http://www.omim.org/)、DrugBank数据库(http://www.drugbank.ca/)。在DrugBank数据库中搜索时,仅选取受FDA批准的药物所对应的靶点,并于UniProt数据库(http://www.uniprot.org/)中检索各靶点,完善其基因名称、ID等信息。
1.2 分析条件
将补阳中药单体成分分为植物成分和动物成分两组,分别与促性腺激素缺乏的已知药物治疗靶点于IPA中进行“Path Explorer”分析,其中作用方式选择“直接”和“间接”,对靶标的调节选择“上调”和“下调”。整理出作用关系后,使用IPA中的“molecule activity predictor”功能,预测有效成分单体对靶标表达的调整作用。最后使用IPA中的“core analysis”功能,对靶标进行通路富集等相关分析。
2 结果
2.1 数据整理
对收集到的治疗促性腺激素缺乏的药物治疗靶点进行去除重复处理,得到已知治疗靶标可在IPA中被识别的有561个;各常见补阳中药单体成分数量分别为:淫羊藿(57)、杜仲(65)、肉苁蓉(22)、锁阳(12)、补骨脂(25)、鹿茸(47)、海马(14),其中IPA可识别的各常见补阳中药单体数量分别为:淫羊藿(10)、锁阳(6)、肉苁蓉(9)、杜仲(16)、补骨脂(11)、鹿茸(37)、海马(9)。
2.2 基于IPA的补阳中药与疾病靶标的作用关系
通过IPA中“Path explorer”和“molecule activity predictor”功能,将上述靶标和成分分别导入IPA分析模块,匹配出植物药、动物药对已知药物治疗靶点进行直接和间接调节的中药单体成分,植物药中,可作用于靶标分子的单体成分为14个,单体及其在实验选取的补肾阳中药中的分布见表1,共可调节31个靶标;动物药中,可作用于靶标分子的单体成分为16个,单体及其分布见表2,共可调节43个靶标。它们的作用关系如图1、图2所示,其中橙色为上调,蓝色为下调,直线代表直接作用,虚线代表间接作用,笔者在IPA提供的相互作用关系基础上添加细胞结构示意图,并将各个靶标定位在其对应的细胞结构中,使其层次更加明确。各靶标对应的蛋白或分子均按照其在细胞中的分布区域标注于图上。

表1 植物类药所含单体成分中英文名称及其归属

表2 动物类药所含单体成分中英文名称及其归属

注:黄色:单体名称;白色:靶标名称
图1植物药中单体成分-疾病靶标作用关系

注:黄色:单体名称;白色:靶标名称
图2动物药药中单体成分-疾病靶标作用关系
2.3 基于IPA的靶点核心分析
通过IPA中“core analysis”功能,对植物药和动物药可调节的靶标分别进行通路富集及分析,选取-Logp值及ratio值(代表该通路中可与数据匹配上的靶点个数与通路靶点及分子总个数的比值)作为指标,左侧y轴为-Logp值,右侧y轴为ratio值,按照-Logp值从大到小的顺序排序从IPA中导出前十名通路的柱形图,见图3、图4。植物药和动物药2组通路中相关性最高的分别为芳基烃受体信号通路和孕烷X受体/类视黄醇X受体激活途径,相关性降序前十名中共有通路为血小板反应蛋白1(TSP1)抑制血管生成途径和缺氧诱导因子1-α(HIF1α)信号途径。

图3 植物药靶标经IPA富集的通路(1~10)

图4 动物药靶标经IPA富集的通路(1~10)
分别统计植物药和动物药富集到的前十名通路中可匹配到的靶标蛋白的名称和出现频数,将出现次数为2及以上的靶标及可受2种及以上中药单体成分调节的靶标进行整理,如表3、表4所示,表中提供了各靶标蛋白于前十名通路中的出现频数,以及各补阳药材中对应中药单体的存在情况。

表3 植物药单体成分调控的核心靶标及其归属
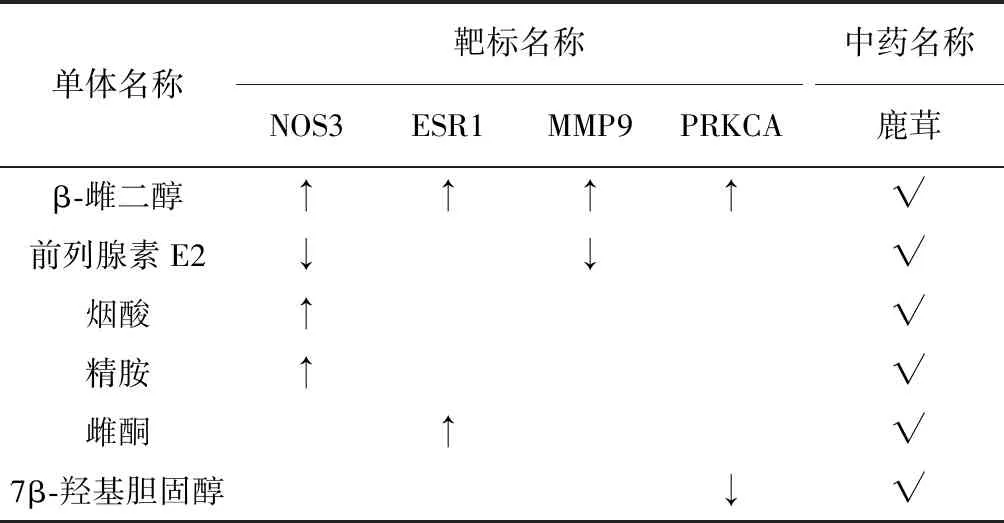
表4 动物药单体成分调控的核心靶标及其归属
3 讨论
中医认为肾为脏腑之本,十二经之根,对各脏腑有推动和温煦作用,与现代医学的男性生育力高度关联。肾阳衰微,命火不足,内生阴寒等原因造成肾阳虚证,是促性腺激素缺乏型男性不育的主要病机[11]。促性腺激素(gonadotropin,Gn)是一类糖蛋白激素,男性促性腺激素包括卵泡刺激素(follicle-stimulating hormone,FSH)、促黄体激素(luteinizing hormone,LH),其合成和分泌涉及大脑皮质-下丘脑、嗅脑-下丘脑、下丘脑-垂体-睾丸等结构的综合调控,任何一个环节出现紊乱,都可能引起促性腺激素失调和性腺机能障碍,导致促性腺激素缺乏型男性不育。由于其发病机制复杂,单纯外源性补充某种男性促性腺激素很少能够获得满意的疗效,因此仍是男科临床上面临的难点[12]。越来越多的临床和实验证据表明,补肾阳药具有促性腺激素样作用,且补肾阳中药对促性腺激素的多成分-多靶点的综合调节作用,使得补肾阳药逐渐引起科研和中西医临床的关注[11]。生命是由各种分子互相作用共同构成的一个复杂网络体系,而疾病的出现往往伴随着多分子水平的变化,涉及到多种具有关联性的病理过程[13]。生物信息学可基于已知的分子、蛋白、化合物等之间的互作机制,对目标成分与分子进行检索和关联性分析,这种整合的分析方法与探索中药机制与药理作用的目标相符。
本研究通过生物信息学方法对补肾阳中药改善促性腺激素缺乏作用的分子机制进行了初步探讨,结果发现补肾阳中药化学库中的30个化学成分可对FDA批准用于治疗促性腺激素缺乏男性不育的药物靶标库的60个核心靶点直接激活或抑制,参与HIF1α信号途径、TSP1抑制血管生成途径、芳基烃受体信号途径,孕烷X受体/类视黄醇X受体激活等18条通路的直接调控。在此基础上,以药物成分在单味中药的分布为分析对象,发现在植物类补肾阳药中分布频率较高的化学成分是槲皮素、山奈酚、熊果酸、亚油酸、咖啡酸、绿原酸和琥珀酸;动物类是β-雌二醇、前列腺素E2、烟酸、精胺、L-精氨酸和胆固醇。以药物靶标为分析对象,发现植物类与动物类补肾阳药在治疗促性腺激素缺乏型男性不育过程中直接作用次数较多的靶标是肿瘤蛋白p53(tumor protein p53,TP53),基质金属蛋白酶9(matrix metallopeptidase 9,MMP9),雌激素受体1(estrogen Receptor 1,ESR1)、核受体亚家族1第一组成员2(nuclear receptor subfamily 1 group I member 2,NR1I2)。以药物通路为分析对象,发现植物类与动物类补肾阳药在治疗促性腺激素缺乏型男性不育过程中均调控的信号通路有4条,分别是HIF1α信号途径、TSP1抑制血管生成途径、芳基烃受体信号途径和孕烷X受体/类视黄醇X受体激活途径。另外,为了保证研究结果的可靠和准确,本研究只关注了与药物成分有直接关系的靶标,即实验数据来源于SCI发表的研究性论文(影响因子大于3分),因此,本部分研究对这些药物成分、靶标及通路予以了更多关注。
肿瘤蛋白p53基因和MMP-9均为垂体腺瘤相关的常见抑癌基因。TP53是一种肿瘤抑制基因,表达的p53蛋白可保持基因组的稳定性,避免突变发生。垂体腺瘤是位于脑垂体的良性肿瘤,发生率较高,以中年人居多,解剖发现率约为20%~30%[14]。但有部分肿瘤有侵袭性生长的特性,可能对垂体组织产生压迫,导致垂体促激素的减少,其主要的临床表现为性腺功能低下。垂体腺瘤中p53的阳性率与肿瘤的恶性程度成正比关系,严重情况如垂体癌中,p53阳性率可达100%[15]。p53分为野生型和突变型,二者作用各不相同:野生型p53可抑制肿瘤发生,平时表达水平较低;突变后的p53则可通过刺激细胞生长的方式促进肿瘤的发生。淫羊藿、锁阳、杜仲、补骨脂中含有的槲皮素、熊果酸、咖啡酸、亚油酸,鹿茸中的前列腺素E2,这些中药单体成分对p53既有上调作用也有下调作用,与文献依据相符[16]。MMP-9属于Ⅳ型胶原酶,是锌依赖性内肽酶家族的一员,可介导细胞外基质的降解和血管生成[17],在垂体腺瘤的侵袭性生长中起重要促进作用[16]。实验结果显示,淫羊藿中的槲皮素,锁阳、杜仲中的熊果酸,鹿茸中的前列腺素E2等成分对MMP-9有抑制作用,与现已知的机制相符。
雌激素受体α(estrogen receptorαlpha,ERα)由雌激素受体1基因(ESR1)编码,主要分布在细胞核内,在不同器官和生理发育过程中发挥作用,如生殖系统、中枢神经系统等,在男性中的生殖器官、下丘脑、垂体等中均有表达[18]。ERα水平的降低造成机体对雌激素不敏感,同时伴有促性腺激素分泌异常,男性患者会伴有精子活力差,且外源性激素治疗对其效果不佳[19]。淫羊藿中的槲皮素、杜仲中的山奈酚,可上调ESR1的表达,猜测可能通过增加ERα的表达,提高机体对雌激素敏感性,进而调整促性腺激素分泌。TP53和ESR1共同参与芳基烃受体信号途径,在没有雌激素或雌激素水平过低的情况下,配体与该受体结合,形成芳基烃受体复合物可与雌激素受体结合,激活对雌激素效应元件有依赖性的一系列基因的转录。
孕烷X受体是由NR1I2编码的转录因子,属于核受体。通过与配体结合参与药物代谢相关酶和转运蛋白的表达。孕烷X受体于肝和小肠中表达活跃,部分中草药活性成分经肠道及其他靶器官摄取后作为配体可激活孕烷X受体,从而影响药物的代谢和作用[20]。鹿茸中的β-雌二醇可上调NR1I2的表达。在孕烷X受体/类视黄醇X受体激活途径中,激活的孕烷X受体与类视黄醇X受体可共同诱导细胞色素P450 3A4酶(Cytochrome P450 3A4,CYP3A4)的表达,CYP3A4负责近过半数常用药物的I期代谢,推测其可通过该途径,在一定程度上提升机体对其他可吸收有效成分的利用。
本研究结合生物信息学方法成功构建了补肾阳中药治疗促性腺激素缺乏型男性不育的“成分-靶标”分子网络,为补肾阳中药抗促性腺激素缺乏型男性不育的治疗奠定理论基础和实验依据,具有一定的科学意义。

