结肠癌T-cadherin表达水平分析与5-Aza-CdR对其表达和结肠癌细胞增殖、侵袭及凋亡的影响
福建医科大学附属第二医院肿瘤外科,福建 泉州,362000
结肠癌是临床常见恶性肿瘤之一,2018年全球约有110万新发病例,死亡人数约为55万多人[1]。而在中国结肠癌也是最常见的胃肠道恶性肿瘤[2]。尽管结肠癌的总体疗效有所改善,但预后仍然不能令人满意。近年来,随着全基因组及全外显子测序技术的发展,新的癌症基因或抑癌基因不断被发现,并由此衍生出新的基因治疗方案,改善了患者的疗效及预后。但由于基因组学的复杂性及多样性,目前仍无法完全揭示肿瘤的发生、发展机制。因此发现新的肿瘤调节因子并揭示其内在的机制,在肿瘤治疗的研究中仍尤为重要。
T钙黏蛋白(T-cadherin),也称钙黏蛋白13(CDH13),是cadherin超家族的一个非典型成员,它通过糖基磷脂酰肌醇锚定在细胞膜上[3]。其常在各种类型的癌症中低表达,包括胃癌[4]、乳腺癌[5]、肺癌[6]、结肠癌[7]、皮肤鳞状细胞癌[8]和其他类型的癌症[9]。大量研究提示,T-cadherin作为一种抑癌蛋白具有潜在的意义,因此揭示其在结肠癌中的作用,有助于发现结肠癌治疗的新靶点。故本研究通过收集临床样本,在mRNA表达和蛋白水平上,分析T-cadherin的表达变化及其与患者临床病理学特征的关系,进而利用药物5-Aza-CdR处理人结肠癌细胞系HT-29,分析其对T-cadherin表达和HT-29细胞生物学行为的影响,初步阐明T-cadherin在结肠癌中的调控机制。
1 材料和方法
1.1 临床样本和细胞系
收集福建医科大学附属第二医院2015—2016年40例手术切除的结肠癌组织及癌旁组织新鲜样本,并经过病理学检查验证。患者包括例31例男性和9例女性,手术前均未接受放疗或者化疗。所有患者均被告知样本的用途并同意。取下的组织用PBS缓冲液冲洗2遍,立刻放置于液氮中保存及运输,用于总RNA提取及蛋白提取。HT-29细胞系购买自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。人结肠癌HT-29细胞培养基为DMEM完全培养基(含10%胎牛血清和1%双抗)(美国Thermo公司),在37 ℃、CO2体积分数为5%的条件下培养。细胞实验分为未处理组和5-Aza-CdR药物处理组。细胞药物处理:采用0.25%的胰酶消化HT-29细胞,结合移液器吸嘴吹打,使细胞充分悬浮,加入含血清培养基终止消化,将细胞分装至6个培养瓶中,加入DMEM完全培养基,置于细胞培养箱中培养24 h,换液,向其中3瓶加入5 μmol/L 5-Aza-CdR(美国Sigma公司),以不加药物者为对照组,每天换液,药物处理3 d后收集细胞。
1.2 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
TRIzol试剂购自宝生物工程(大连)有限公司,参照其说明书,提取组织及细胞的总RNA。通过ND-1000分光光度计(美国Thermo公司)检测RNA的浓度和纯度,确保D260nm/D280nm>2.0,D230nm/D260nm>1.8。采用RevertAid逆转录酶(美国Thermo公司)将RNA逆转录为cDNA。按照2×SGExcel FastSYBR Mixture[生工生物工程(上海)有限公司]说明书,配制RTFQ-PCR反应体系(25μL2×SGExcel FastSYBR Mixture+1 μL 上游引物+1 μL下游引物+1 μL cDNA,加入超纯水补齐至50 μL),上机检测(StepOnePlus™RTFQ-PCR仪,美国ABI公司),反应程序为:预变性95 ℃,20 s;变性95 ℃,3 s;退火/延伸60 ℃,30 s;35个循环。引物由生工生物工程(上海)有限公司合成。T-cadherin上游引物为5'-GATGTTGGCAAGGTAGTCGAT-3',下游引物为5'-GCTCCCTGTGTTCTCATTGAT-3'。以GAPDH作为内参。GAPDH上游引物为5'-ACGGGAAGCTTGTCATCAATGG-3',下游引物为5'-ATGGTGGTGAAGACGCCAGTGG-3'。根据2-ΔΔCT计算T-cadherin的相对表达量。
1.3 蛋白质印迹法(Western blot)检测
离心收集细胞,采用1×RIPA裂解液(美国Sigma公司)裂解细胞,利用BCA蛋白浓度测定试剂盒[生工生物工程(上海)有限公司]对蛋白定量。取50 μg蛋白样品与凝胶缓冲液混合,煮沸10 min,之后进行SDS-PAGE电泳。将蛋白转移至硝酸纤维素膜(美国Millipore公司)上。非特异性抗体采用含有5%脱脂牛奶的1×Tris缓冲液封闭,室温下温育2 h。在4 ℃下,膜与T-cadherin抗体或GAPDH抗体(美国OmnimAbs公司)在含有5%脱脂牛奶的1×TBS缓冲液中温育过夜。采用1×TBS洗涤3次后,膜与辣根过氧化物酶标记的兔IgG抗体(美国OmnimAbs公司)在室温下温育2 h。在Fluor Chem Systems下(美国ProteinSimple公司)观察结果,采用系统自带的软件(Alpha View Software)分析目标蛋白的相对水平。
1.4 细胞计数试剂盒(cell counting kit-8,CCK-8)分析细胞增殖
采用CCK-8试剂盒[东仁化学科技(上海)有限公司]分析细胞的增殖。在96孔板中,在每孔中接种5×103个细胞,总培养液体积为100 μL,每组设置5个复孔。在铺板后的1、2、3和4 d共4个时间点,分别向细胞中加入10%的CCK-8试剂,放置于37 ℃中温育2 h。将96孔板放在ELx808酶标仪(无锡百泰克生物技术有限公司)中进行检测。读取并记录每孔在450 nm的吸光度(D)值。
1.5 Transwell检测细胞侵袭能力
采用Transwell小室(美国Corning公司)分析细胞的侵袭,首先采用Matrigel基质胶(美国BD公司)包被小室。采用OPTI-MEM无血清培养基悬浮细胞并计数,取1×105个细胞加入上室,补齐OPTI-MEM无血清培养基至终体积为200 μL,下室加入700 μL含20%小牛血清的DMEM培养基。培养板放在37 ℃、CO2体积分数为5%的细胞培养箱中培养24 h。次日,取出上室,去除培养基,用PBS洗涤2次,移入含800 μL甲醇的孔中固定30 min。去除固定液,加入0.1%结晶紫染色20 min。PBS冲洗小室后将其放在显微镜下观察,随机取9个视野,拍照。
1.6 细胞凋亡
采用购自江苏凯基生物技术股份有限公司的AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒分析细胞凋亡。胰酶消化悬浮不同处理组的细胞,300×g离心5 min收集细胞。将细胞与PI与AnnexinⅤ试剂在室温下避光温育15 min,上流式细胞仪检测(Guava easyCyteTM,美国Millipore公司)。
1.7 统计学处理
采用GraphPad Prism 5软件进行统计分析。通过t检验分析不同组别之间的差异。所有实验至少重复3遍。结果以表示。用t检验和单因素方差分析评估T-cadherin表达与结肠癌患者临床病理参数之间的关系。P<0.05为差异有统计学意义。
2 结果
2.1 T-cadherin在结肠癌组织中的表达及其与临床病理学特征的关系
采用RTFQ-PCR技术分析T-cadherin在结肠癌组织中的mRNA表达水平。如图1和表1所示,T-cadherin在结肠癌组织中mRNA的表达水平显著低于癌旁组织(t=12.61,P<0.000 1)。Western blot检测结果进一步表明,T-cadherin蛋白在结肠癌组织中的水平也明显下降(t=4.602,P<0.05,图2)。T-cadherin的mRNA表达和结肠癌患者临床病理学特征关系分析显示,其mRNA表达水平与淋巴结转移(F=5.316,P=0.009 3)及分化程度(F=5.807,P=0.006 4)明显相关,而与其余病理变量(包括性别、年龄、肿瘤大小和肿瘤浸润深度)无明显相关(表2)。
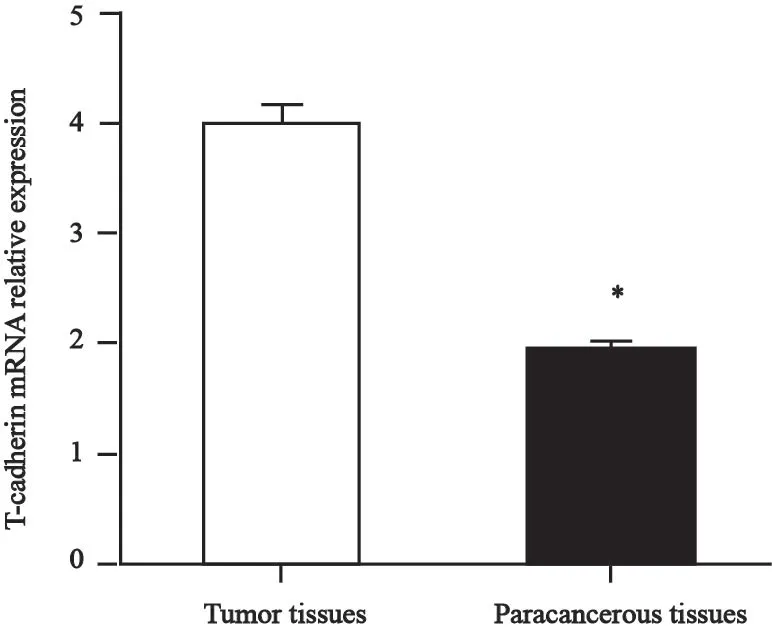
图1 结肠癌组织及癌旁组织中T-cadherin mRNA的表达分析Fig.1 Analysis of T-cadherin mRNA expression in colon cancer tissues and paracancerous tissues

表1 T-cadherin在结肠癌组织和癌旁组织的mRNA表达Tab.1 The mRNA expression of T-cadherin in colon cancer tissues and paracancerous tissues

图2 结肠癌组织及癌旁组织中T-cadherin 蛋白水平的分析Fig.2 Analysis of T-cadherin protein level in colon cancer tissues and paracancerous tissues

表2 T-cadherin mRNA表达与结肠癌患者临床病理特征的关系Tab.2 Relationship between T-cadherin mRNA expression and clinicopathological features of patients with colon cancer
2.2 5-Aza-CdR对T-cadherin表达的影响
采用甲基化抑制剂处理细胞后,分别通过RTFQ-PCR和Western blot检测T-cadherin在细胞中的表达变化。结果发现,抑制甲基化后,T-cadherin在转录水平(图3)和翻译水平上(图4)的表达均发生明显上调。
2.3 T-cadherin与HT-29细胞增殖、侵袭和凋亡之间的关系
CCK-8实验表明,与空白对照组相比,药物处理后,HT-29细胞增殖受到明显的抑制(图5)。Transwell实验结果表明,5-Aza-CdR干预组的细胞侵袭能力明显下降(图6)。流式细胞术分析结果发现,5-Aza-CdR处理可以明显提高肿瘤细胞的凋亡,凋亡率可以达到30%(图7)。

图3 5-Aza-CdR处理后细胞T-cadherin mRNA表达变化Fig.3 Changes of T-cadherin mRNA expression in cells treated with 5-Aza-CdR

图4 5-Aza-CdR处理后,细胞T-cadherin 蛋白表达变化甲基化抑制剂处理后,细胞中T-cadherin 蛋白水平明显上调Fig.4 Change of T-cadherin protein expression in cells treated with 5-Aza-CdR

图5 CCK-8分析5-Aza-CdR对HT-29细胞增殖的影响Fig.5 CCK-8 assay the effect of methylation inhibitor on the proliferation of HT-29 cells

图6 Tranwell分析5-Aza-CdR对HT-29细胞侵袭的影响Fig.6 Tranwell assay showed the effect of 5-Aza-CdR on the invasion of HT-29 cells

图7 流式细胞术分析5-Aza-CdR对HT-29细胞凋亡的影响Fig.7 Flow cytometry was used to analyze the effect of 5-Aza-CdR on the apoptosis of HT-29 cells
3 讨 论
结肠癌是常见恶性肿瘤之一,死亡率居所有癌症第五位[1],揭示其内在的发生、发展机制对于结肠癌患者的治疗意义重大。近年来基因组学的快速发展,已经逐渐成为癌症研究的一个重要领域。因此发现结肠癌新突变基因,将有助于机制的探讨及治疗的改变。
钙黏蛋白是细胞表面跨膜蛋白的一个超家族,传统上分为经典钙黏蛋白和非经典钙黏蛋白[10]。早有研究报道了钙黏蛋白在肿瘤中的作用,如E-cadherin,是肿瘤中潜在的抑制因子[11]。然而,某些钙黏蛋白也被认为是促癌蛋白,如P-cadherin[12]和N-cadherin[13]。T-cadherin是钙黏蛋白超家族的一个非典型成员,是目前已知的唯一一种通过GPI锚定而非跨膜结构域膜锚定的钙黏蛋白[14]。人类T-cadherin的基因在几种类型的癌症中均发生沉默,长期以来被认为具有抗癌作用[15]。已有研究表明,T-cadherin可能抑制肿瘤的发展,包括肿瘤细胞增殖、侵袭和微血管生成,这一过程涉及多个信号转导通路,包括Akt和SET7/9-p53信号通路[16-17]。但T-cadherin在结肠癌发病机制中的作用研究尚少,因此,揭示T-cadherin在结肠癌中的作用具有重要意义。
钙黏蛋白已被鉴定为多种癌症中的肿瘤抑制基因。Wang等[18]研究发现来自前列腺癌转移的细胞系DU145中T-cadherin的外源性表达降低了致瘤性,而来自良性前列腺增生的BPH1中T-cadherin转录的敲低促进了肿瘤发生;Wei等[19]研究发现下调T-cadherin的表达可能有助于胃癌进展;Kong等[5]研究发现T-cadherin低表达的腋窝淋巴结阳性乳腺癌患者的预后较差。在本研究中,我们对40例结肠癌样本进行了分析,发现T-cadherin在结肠癌组织中的表达显著低于癌旁正常组织,其表达水平与淋巴结转移和分化程度明显相关,提示T-cadherin异常表达在结肠癌的发生、发展中可能发挥抑癌作用。
T-cadherin的表达变化也与T-cadherin基因启动子区域的甲基化水平有关。DNA甲基化是真核生物关键的表观遗传修饰之一,参与了microRNAs表达的调控[20]和基因选择性剪接[21]。异常DNA甲基化常使T-cadherin在癌症中呈现低表达,并且促进肿瘤的发生、发展,如肺癌[22]、膀胱癌[23]、鼻窦癌[24]、食管癌[25]。异常DNA甲基化在结直肠癌的发生过程中起着重要的作用[26]。最近一项Meta分析结果表明,T-cadherin基因甲基化在结肠癌的发生、发展中起重要作用[27]。5-Aza-CdR可在体内外重新上调因高甲基化状态而沉默的抑癌基因,导致细胞分化和凋亡,从而抑制肿瘤进展[28]。本研究采用甲基化抑制剂5-Aza-CdR成功上调T-cadherin的表达,通过细胞生物学行为观察发现5-Aza-CdR药物处理与结肠癌细胞的增殖和侵袭的抑制及诱导凋亡密切相关,提示5-Aza-CdR可通过抑制T-cadherin甲基化逆转T-cadherin表达下调,并抑制结肠癌细胞的增殖、侵袭和抗凋亡。相关研究已报道了T-cadherin水平上调对癌细胞行为的影响,如T-cadherin的重新表达减少了人类前列腺癌[18]、黑色素瘤[29]、乳腺癌[30]和肝细胞癌细胞系[31]的恶性特性等。但T-cadherin去甲基化影响结肠癌发展的作用机制仍需进一步研究。
本研究结果证实,T-cadherin在结肠癌组织中呈低表达,甲基化抑制剂处理可上调T-cadherin表达,并且抑制肿瘤细胞增殖和侵袭能力,促进细胞凋亡。本研究结果提示,T-cadherin在结肠癌中发挥抑癌基因作用,并且可能是结肠癌患者使用DNA甲基化抑制剂进行治疗的靶点。

