白蛋白结合型紫杉醇联合吉西他滨动脉灌注治疗进展期胰腺癌的安全性和有效性回顾性研究
复旦大学附属肿瘤医院肿瘤微创治疗中心,复旦大学上海医学院肿瘤学系,上海 200032
胰腺癌发病率在全球和中国都呈逐年上升趋势,目前居中国恶性肿瘤发病率第7位,死亡率第6位,预计2030年将成为第2位致死性恶性肿瘤[1]。胰腺癌恶性程度高,整体5年生存期(overall survival,OS)率不足5%,晚期患者中位OS(median OS,mOS)仅6个月[2]。80%的胰腺癌患者初诊即为晚期,以吉西他滨为基础的单药或联合方案静脉化疗是最为有效的治疗方法,其中包括白蛋白结合型紫杉醇联合吉西他滨(nab-paclitaxel combined with gemcitabine,AG)[3]。经导管动脉灌注化疗/栓塞(transcath eter arterial chemotherapy/chemoembolization,TAC/TACE)通过将化疗药物直接灌注至肿瘤血管发挥治疗作用,能显著提升患者预后,延长生存期,已经被证明是多种原发性肿瘤肝转移的有效治疗方法,对于那些不能手术切除的局部晚期或胰腺癌肝转移患者,TAC/TACE是重要的局部治疗方法[4],常用药物选择包括吉西他滨、氟尿嘧啶、奥沙利铂等[5],但AG方案经动脉灌注治疗胰腺癌的有效性和安全性研究未见报道。本文回顾性分析了AG方案经动脉灌注化疗治疗进展期胰腺癌的临床疗效,填补了该领域的研究空白。
1 资料和方法
1.1 诊断标准
所有患者需经组织病理学(肝脏)和(或)细胞学检查[胰腺和(或)肝脏]确诊为胰腺导管腺癌。有明确的可供评价的胰腺或肝脏占位性病变。临床分期参考胰腺癌美国癌症联合会(American Joint Committee on Cancer,AJCC)(第8版)TNM分期[2]。
1.2 纳入标准
⑴组织病理学(肝脏)和(或)细胞学检查[胰腺和(或)肝脏]确诊为起源于胰腺导管上皮的恶性肿瘤;⑵初诊的不能手术切除局部晚期或发生转移患者;⑶必须有可测量的病灶,符合实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)评价标准;⑷住院期间接受白蛋白结合型紫杉醇联合吉西他滨为基础的区域性动脉灌注化疗和(或)肝动脉化疗栓塞术;⑸ 预计OS为3个月以上。
1.3 排除标准
⑴胰腺导管腺癌以外的其他类型的胰腺原发性恶性肿瘤和转移性胰腺癌,包括壶腹部癌,或胰腺神经内分泌肿瘤、腺泡细胞癌、导管内乳头状肿瘤等其他类型的胰腺肿瘤;⑵过去或同时有原发灶或组织学特征完全不同于胰腺癌的癌症,原位宫颈癌、曾治疗的基底细胞癌、浅表膀胱肿瘤除外;⑶既往接受针对胰腺病灶或转移病灶的全身或局部治疗,包括但不限于手术、化疗和局部治疗;⑷主要研究资料不全者。
1.4 手术操作和给药
患者完善术前检查,排除治疗禁忌,术中取仰卧位,常规腹股沟区消毒铺巾,腹股沟区域局部麻醉,Seldinger法穿刺股动脉,放置动脉鞘,选择性动脉插管[6]:将导管分别选择性置于腹腔动脉、肠系膜上动脉造影,造影持续至静脉期,观察静脉受侵情况,若可见肿瘤供血血管,则超选至供血动脉灌注化疗。若未见肿瘤供血动脉,则根据肿瘤部位、侵犯范围及供血情况确定靶血管,胰头、胰颈部肿瘤经胃十二指肠动脉灌注化疗,胰体尾部肿瘤视肿瘤侵犯范围、血管造影情况,经腹腔动脉、肠系膜上动脉或脾动脉灌注化疗。灌注药物为吉西他滨1 000 mg/m2,使用前用0.9%氯化钠溶解至250 mL置于室温下,1 h内使用,白蛋白结合型紫杉醇125 mg/m2,使用前用0.9%的氯化钠溶解至250 mL置于室温下,1 h内使用,灌注时间≥10 min。伴肝转移者同时经肝固有动脉灌注化疗,若造影下见肝内转移瘤的血供较丰富,供血动脉给予吡柔比星40~60 mg混合碘化油3~10 mL栓塞。
1.5 观察指标和病例随访
观察接受治疗患者mOS,即从影像学确诊之日起至死亡或随访截止日期,失访的患者以末次随访时间为准,观察患者1年OS,评价生存情况。观察患者6 个月无进展生存(progression-free survival,PFS)率和中位PFS(median PFS,mPFS),从接受治疗到放射影像学肿瘤进展或因任何原因导致死亡的时间,评价疾病控制情况。参考美国国立卫生研究院(National Cancer Institute,NCI)发布的常见不良反应术语评定标准(Common Terminology Criteria for Adverse Events,CTCAE)评估不良反应和并发症发生率,评价安全性。所有患者出院后以电话方式每3个月随访1次,末次随访日期为2019年12月1日。
1.6 统计学处理
采用SPSS 18.0软件,Kaplan-Meier法估算总体生存情况,log-rank法进行组间比较;COX回归模型分析预后因素;Kaplan-Meier法估算各治疗组无病生存情况,log-rank法进行组间比较;采用卡方检验比较各治疗组间不良反应差异。P<0.05为差异有统计学意义。
2 结果
2.1 患者临床资料
共收集71例患者信息,排除不符合纳入、排除标准和资料不全患者,共63例患者纳入分析,所有患者均为2016年1月—2019年6月在复旦大学附属肿瘤医院接受治疗的初诊的进展期胰腺癌患者,患者均经病理学检查确诊为胰腺导管腺癌,中位年龄56岁(37~84岁),男女比例7∶3,92.06%的患者KPS评分≥80,分期采用AJCC(第8版)分期标准,其中Ⅲ期15例,Ⅳ期48例;肿瘤位于胰头颈和胰体尾的比例分别为36.51%和63.49%,胰腺癌≤4 cm和>4 cm的比例分别为66.67%和33.33%;80.95%的患者发生肝转移。具体情况见表1。
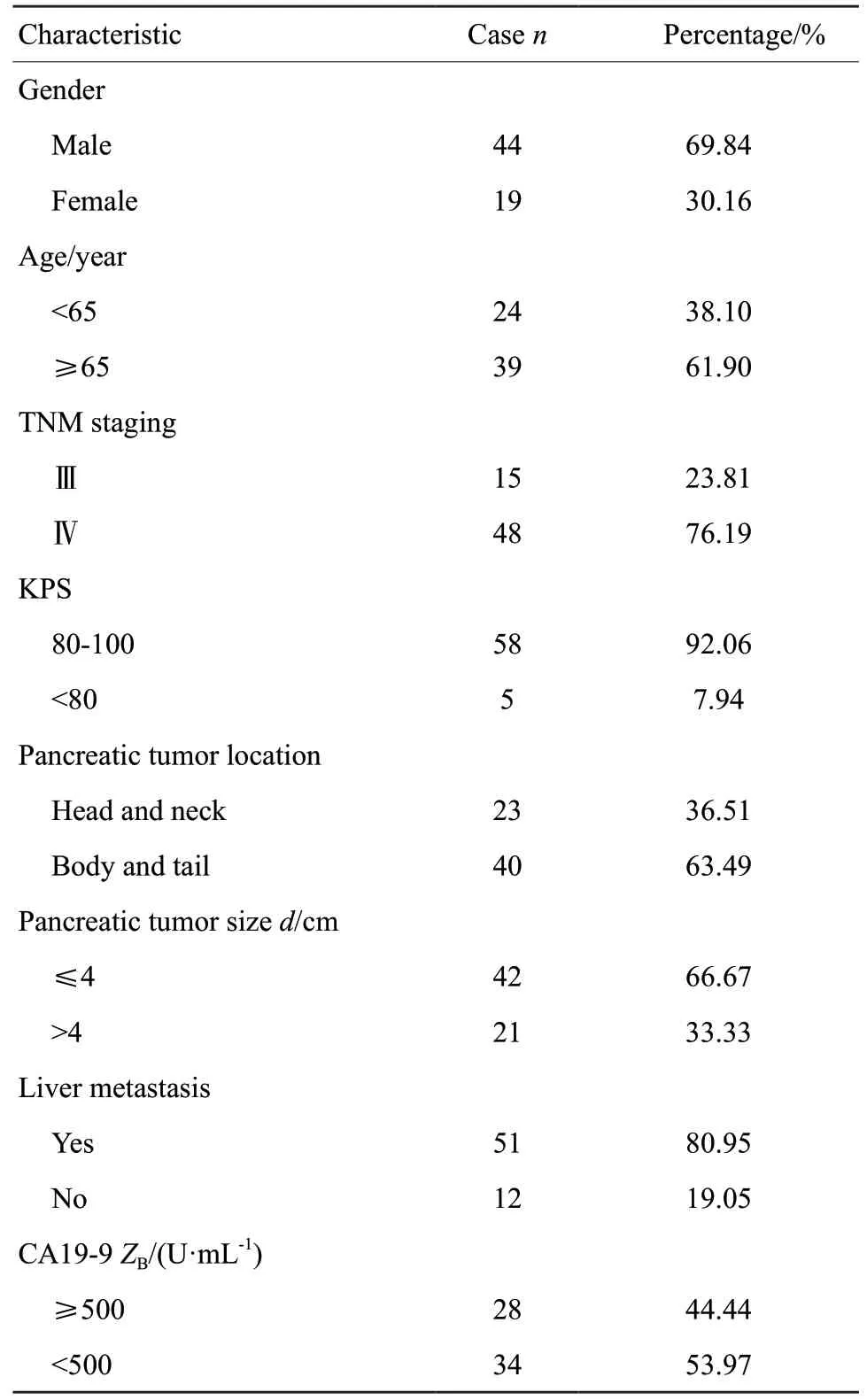
表1 63例进展期胰腺癌患者临床资料Tab.1 Clinical characteristics of 63 patients with advanced pancreatic cancer
2.2 治疗情况
所有患者分别于腹腔干、脾动脉和肠系膜上动脉造影,伴有肝转移患者在肝固有动脉造影,必要时超选至胃十二指肠动脉造影、胰背动脉和胰大动脉造影。63例患者造影可见胰腺血供来源的为42例,占66.67%,其中胰头颈部癌患者供血动脉来源依次为胰十二指肠动脉前上或后上弓、胰十二指肠动脉前下或后下弓和胰背动脉,胰体癌患者主要供血动脉为胰背动脉、肠系膜上动脉和胰大动脉,胰尾部癌患者主要供血动脉为胰尾动脉、胰大动脉和胰背动脉。51例伴有肝转移的患者中,造影可见血供来源的为18例,占35.29%。63例患者中,接受治疗1次4例,2次6例,3次6例,4次及以上47例,治疗次数最多为9次,间隔时间为21~45 d。
2.3 生存评估
全部病例中位随访时间为14个月,其中2例患者失访,随访率为96.83%。63例患者1年OS率为36.51%,mOS为9.2个月(图1)。Kaplan-Meier法分析显示接受4次及以上TAC或TACE治疗的患者OS明显延长,接受1~3次治疗的患者1年OS率为25.00%,mOS为7.2个月,接受4次及以上的患者1年OS率为40.43%,mOS为11.4个月,两者mOS之间的差异有统计学意义(P=0.038,图1)。DSA术中造影胰腺肿瘤动脉是否有动脉供血、肝转移灶是否有动脉供血未显示与患者生存直接相关。COX回归模型统计显示KPS≥80、TNM分期Ⅲ期与较长的生存期相关,接受TAC/TACE治疗提示为较好的预后相关因素,结果证实AG方案经动脉灌注化疗可有效地延长进展期胰腺癌患者的生存时间,使患者生存获益(表2)。

图1 进展期胰腺癌患者生存相关因素分析Fig.1 Analysis of survival-related factors in patients with advanced pancreatic cancer

表2 进展期胰腺癌患者预后相关因素多因素分析Tab.2 Multivariate analysis of prognostic factors in advanced pancreatic cancer patients
2.4 疾病控制评估
所有患者6个月PFS率为44.44%,mPFS为4.7个月。接受1~3次TAC/TACE治疗患者6个月PFS率为31.25%,接受≥4次以上治疗患者为48.94%,二者的mPFS分别为4.3个月和5.8个月,此外,DSA造影胰腺肿瘤有血供患者和无血供患者相比,6个月PFS率分别为50.00%和33.33%。Kaplan-Meier法分析显示接受≥4次以上TAC或TACE治疗、DSA造影显示胰腺动脉供血的患者能够获得更长的病灶控制时间,与1~3次、DSA胰腺肿瘤无血供患者相比,两者mPFS之间的差异有统计学意义(P=0.029,P=0.001;图2)。
2.5 不良反应评估
接受TAC或TACE治疗的63例患者中,Ⅲ度及以上血液学毒性反应发生率为1%~3%,主要为血小板减少和中性粒细胞减少,与AG方案静脉化疗相比发生率明显降低。非血液学不良反应主要为恶心、呕吐和乏力,发生率分别为9.52%、9.52%和6.35%,与AG方案静脉化疗相比发生率也明显降低。与静脉化疗不同的是,接受动脉灌注化疗尤其是接受栓塞的患者治疗后出现栓塞综合征,主要症状为发热、肝区疼痛,大部分患者在治疗后出现并持续24~72 h,轻度患者可自行缓解,部分较重患者对症治疗后可有效控制,本研究中22.22%的患者出现明显的疼痛,均为栓塞患者,17.46%的患者术后出现发热,所有患者对症处理后不良反应均缓解并消失。接受≥4次以上治疗的患者和<4次患者相比,不良反应差异无统计学意义,增加治疗次数并没有增加治疗的不良反应(表3)。

图2 进展期胰腺癌患者PFS相关因素分析Fig.2 Analysis of factors related to progression-free survival (PFS) in patients with advanced pancreatic cancer
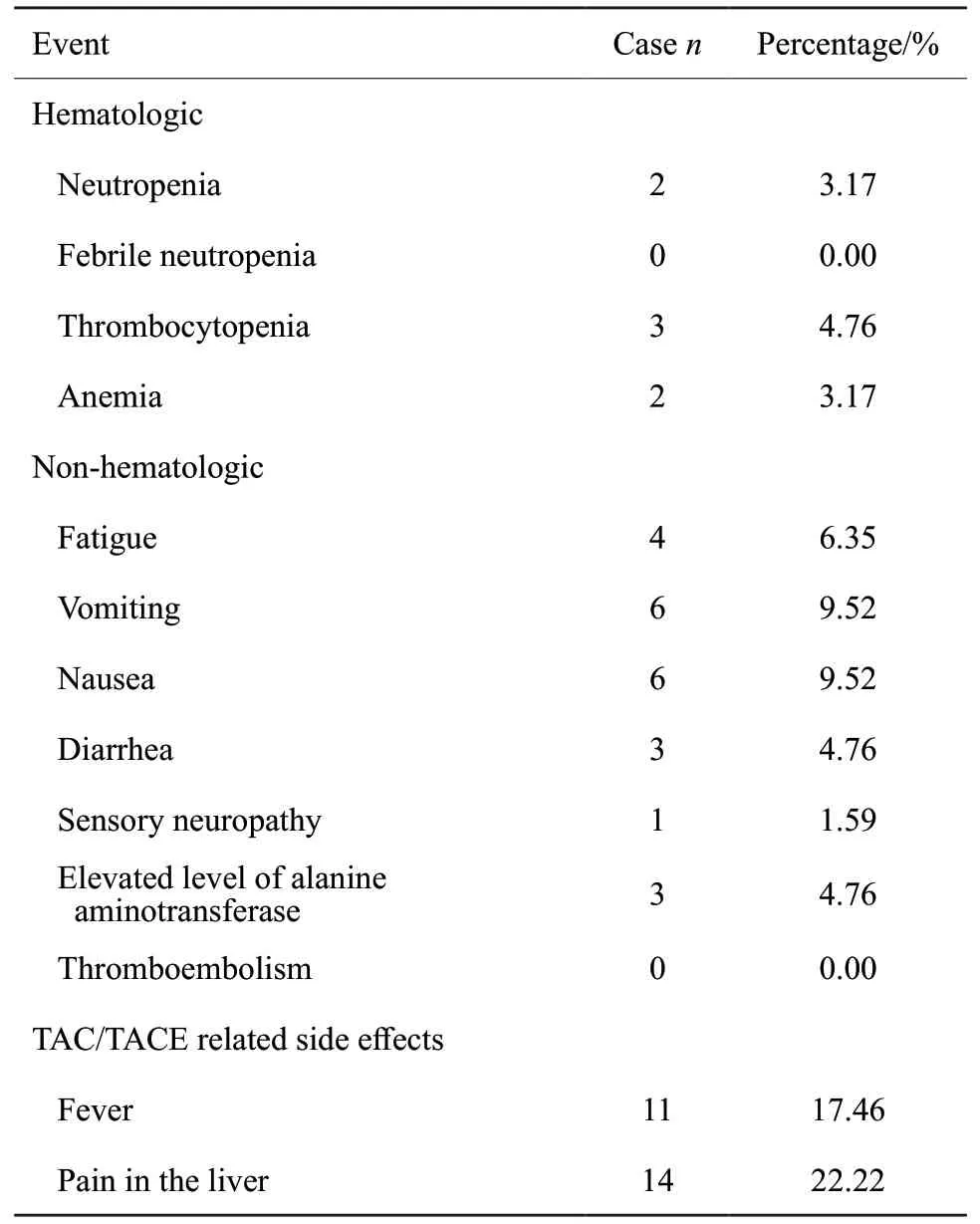
表3 63例胰腺癌患者3~4度不良反应统计Tab.3 Most common grade 3 or 4 adverse events occurring in 63 patients with advanced pancreatic cancer
3 讨 论
胰腺癌发病率逐年上升,继胃癌、肺癌和肝癌后成为第4位导致死亡的恶性肿瘤,目前居中国恶性肿瘤发病率第7位,死亡率第6位,预计2030年将成为第2位致死性恶性肿瘤[7-8]。胰腺癌恶性程度高,整体5年生存率不足8%,晚期患者mOS仅6个月,是目前预后最差的实体肿瘤[9-10]。早期症状不典型,患者就诊时往往处于进展期,手术是根治性治疗胰腺癌的首选方式,仅有约20%的患者可行手术切除,但术后复发率高,5年生存率约为20%,因此,对于不能手术切除或术后复发的患者系统化疗仍是目前最为有效的治疗方法[11]。多项研究结果显示,白蛋白结合型紫杉醇联合吉西他滨在进展期胰腺癌可有效延长晚期胰腺癌患者生存期并控制疾病进展,与FOLFIRINOX方案相比,具有更低的不良反应发生率和更高的耐受性,为高龄患者和体力状况不佳的患者提供了有效的可选方案[12-13],白蛋白结合型紫杉醇联合吉西他滨成为目前进展期胰腺癌治疗中最为有效且不良反应较轻的联合方案。
动脉灌注化疗是指经动脉内将导管或微导管插入到胰腺癌病灶的主要供血动脉,根据临床资料确定相应化疗药物及其方案,将药物在一定时间内经导管灌注到肿瘤组织内的治疗方法[14],具有局部药物浓度高、全身反应小的优势,通过导管经动脉进入肿瘤的供血动脉内再进行化疗药物的灌注,药物分布不受全身无关的血流影响,肿瘤区域是全身药物分布量最多且浓度最高的地方,即使以少于静脉给药量的剂量进行灌注,肿瘤区域的药物浓度仍远高于全身的药物浓度,其随血液循环流至全身其他地方的药物同样对靶器官外可能存在的其他转移性病灶起作用,是一种微创、相对高效,同时也兼顾局部和全身的治疗方式[15]。其发挥作用的机制在于胰腺血供主要由肝总动脉、肠系膜上动脉及脾动脉提供,经由动脉局部灌注,药物能够覆盖整个胰腺组织发挥作用,且浓度较高,同时,部分化疗药物可能经门静脉实现二次灌注,能有效地消灭转移病灶[16]。Vogl等[5]对112例胰腺癌伴肝转移患者的回顾性调查分析结果显示,在TACE术后,78.26%的患者病情稳定,11.59%的患者表现为部分缓解,患者的mOS为19个月,其中病情控制稳定的患者,mOS达26个月。此外,肝转移灶的数目与TACE的疗效无关,提示对于那些胰腺癌伴多发肝转移的病例,TACE是一种值得选择的治疗方法。一项对接受TACE治疗的125例胰腺癌肝转移患者的评价结果显示,在可评估疗效的105例患者中,疾病稳定68例,部分缓解12例,最小缓解17例,疾病进展8例,mOS为6.7个月[17],上述研究证实对于不能手术切除的晚期胰腺癌,经动脉灌注化疗的局部药物浓度显著高于全身静脉化疗,在改善疾病相关症状、延长OS、控制病灶等方面均具有明确的疗效。
关于动脉灌注化疗中灌注化疗药物的选择,目前使用的药物主要包括吉西他滨、氟尿嘧啶、多柔比星、铂类药物等[5],而白蛋白结合型紫杉醇联合吉西他滨作为目前静脉化疗最为有效的方案,动脉灌注化疗是否安全有效未见报道,复旦大学附属肿瘤医院回顾性分析了63例接受白蛋白结合型紫杉醇联合吉西他滨经动脉灌注化疗的进展期胰腺癌患者,通过分析接受治疗后的有效性和安全性初步明确了AG方案在胰腺癌动脉灌注化疗中的价值,63例患者中治疗<4次的患者16例,4次及以上47例,高达74.6%的患者治疗次数大于4次,治疗次数最多为9次,间隔时间为21~45 d,显示出了方案较好的耐受性,同时治疗间隔的延长也减少了患者的痛苦,提高患者的生活质量。分析结果显示,接受治疗的所有患者均表现出较高的安全性,出现Ⅲ度及以上不良反应的患者经对症治疗后均恢复,未出现治疗相关性死亡病例,发生治疗相关的Ⅲ度及以上血液学不良反应包括中性粒细胞减少占3.17%,血小板下降占4.76%,非血液学不良反应包括乏力(6.35%)、恶心呕吐(9.52%)、腹泻(4.76%)和转氨酶升高(4.76%);22.22%和17.46%的患者出现发热、肝区疼痛栓塞综合征,与发表于《新英格兰医学杂志》(The New England Journal of Medicine)上的白蛋白结合型紫杉醇联合吉西他滨静脉注射一线治疗进展期胰腺癌Ⅲ期临床研究结果相比,不良反应发生率明显降低,该研究结果显示,出现Ⅲ度及以上血液学毒性中性粒细胞减少和血小板减少的比例分别为38%和13%,非血液学毒性的乏力和恶心呕吐发生的比例分别高达17%和6%[12],动脉灌注治疗明显降低了血液学毒性和非血液学毒性的发生率。
本研究回顾性分析了63例接受动脉灌注化疗患者。结果显示,63例患者1年OS率为36.51%,mOS为9.2个月,AG方案静脉治疗Ⅲ期临床研究结果显示,1年OS率为35.00%,mOS为8.5个月,入组患者主要为转移性胰腺癌患者,其中85%的患者发生肝转移,8%的患者KPS评分<80。两组患者具有一定可比性,结果显示,AG方案动脉灌注化疗在mOS、1年OS率两个主要评价指标上与静脉治疗效果相当,可以有效地延长胰腺癌患者的OS,动脉灌注化疗突出的优势表现在延长了患者治疗周期同时降低了化疗药物的总剂量,最终减少对患者生活质量的影响,提供了一种可长期接受的治疗方案。同时,该方案可有效控制病灶进展,接受治疗的患者6个月PFS率为44.44%,中位mPFS为4.7个月,AG静脉治疗方案中6个月PFS率为44.00%,mPFS为4.5个月,整体疗效与静脉化疗相当。接受1~3次和4次及以上治疗的患者1年生存率分别为25.00%和40.43%,6个月的PFS分别为31.25%和48.94%,两者之间差异有统计学意义(P=0.038,P=0.029),说明接受4次及以上治疗的患者无论在OS还是PFS方面均明显优于1~3次患者,并且治疗次数的增加并没有增加患者不良反应的发生率,此外,DSA造影显示,胰腺肿瘤有血供患者与无血供患者相比,前者在PFS方面显示出明显优势,而在OS方面差异无统计学意义。因此,白蛋白结合型紫杉醇联合吉西他滨经动脉灌注化疗方案治疗进展期胰腺癌具有较高的安全性,不良反应与静脉给药相比明显减少,可有效地控制病情,使患者生存获益,可以作为不能手术切除胰腺癌患者的有效治疗选择之一。进一步开展动脉灌注化疗与单纯静脉化疗临床疗效对比的前瞻性临床研究具有重要的临床价值。

