二氢杨梅素通过ERK/VEGFA/VEGFR2通路对体内外胃癌血管生成的影响
温培楠,林明恕,金 冕,徐贤绸,陈龙云
1.浙江省平阳人民医院普外科,浙江 温州 325400;
2.湖北中医药大学基础医学院,湖北 武汉 430065
胃癌作为全球范围内主要的公共卫生问题之一,2017年胃癌在中国癌症发病率中排名第二,在癌症相关死亡的原因中位列第四。早期胃癌缺乏典型临床症状,同时胃癌的血供极为丰富,早期就可能发生腹腔转移或远处转移,从而导致胃癌患者的预后较差[1-2]。尽管在早期诊断和治疗方面做出了巨大努力,但应用于临床胃癌的传统化疗药物效果不甚理想,目前抑制肿瘤新生血管形成已成为研发抗癌药物的新方向,已有诸多抗血管生成靶向药物如多靶点酪氨酸激酶抑制剂-索拉非尼和血管内皮生长因子(vascular endothelial growth factor,VEGF)/血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)单抗-阿西替尼等应用于临床胃癌化疗,取得显著疗效,但大多靶向药物均存在一定程度的不良反应,同时很多患者对靶向药物存在不同程度的耐药,提高总体生存率的进展相对缓慢[3-4]。寻找低毒、高效的抗胃癌药物以改善胃癌患者预后具有十分重要的临床意义。
二氢杨梅素(dihydromyricetin,DHM)是从延胡索属的叶中分离的一种氢化黄酮醇类有机物,药理研究表明,DHM具有对抗炎症因子、抑制细菌生长和舒张小动脉等多种功效[5-6]。此外,DHM还可抑制肺癌、肝癌和结肠癌等多种恶性肿瘤生长,并促进细胞凋亡,同时对正常人体细胞几乎没有细胞毒效应[7-8],从而为天然产物应用于临床抗肿瘤药物提供了更多的选择。然而,DHM对恶性肿瘤血管生长的影响尚未可知,本研究将围绕DHM对体外人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)侵袭和小管形成、体内胃癌生长和血管生成、蛋白水平的机制进行系统性研究。
1 材料和方法
1.1 细胞系和主要试剂
HUVEC和人胃癌细胞系MKN28购自美国典型培养物保藏中心(American Type Culture Collection,ATCC);DHM、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)和Drabkin 525试剂盒购自美国Sigma公司;DMEM高糖培养基和胎牛血清购自杭州四季青生物工程材料有限公司;含EDTA胰蛋白酶购自杭州吉诺生物医药技术有限公司;Matrix基质胶和Transwell小室购自美国BD公司;细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自上海碧云天生物技术有限公司;BCA蛋白质浓度测定试剂盒和RIPA裂解物购自北京中山生物工程有限公司;VEGFA、phospho-VEGFR2、Total-VEGFR2、phospho-细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、Total-ERK、phospho-c-Jun氨基端激酶(c-Jun NH2-terminal kinase,JNK)和Total-JNK抗体购自美国Epitomics公司;phospho-p38、Total-p38和β-actin抗体购自美国Santa Cruz公司。
1.2 细胞培养
采用DMEM培养基对细胞进行培育,同时在DMEM培养基中添加10%胎牛血清,细胞放置于细胞培养箱环境中,使用含EDTA胰蛋白酶消化,按照1∶3的比例进行传代。
1.3 配制药液
把100 mg的DHM添加至10 mL的DMSO内,制作得到10 mg/mL的液体成分,随后妥善放置4 ℃环境中,临使用时将母液置于37 ℃水浴箱内溶解后再添加DMEM培养基稀释成所需浓度,0.1%为DMSO在DHM溶液中浓度的上限,0.1%DMSO对细胞活力无显著抑制作用。使DHM浓度梯度为0.5、1.0、2.5、5.0、10.0、25.0、50.0和100.0 mmol/L,现配现用。
1.4 CCK-8法检测细胞活力
HUVEC或MKN28细胞加入96孔板中,每孔中分配2×104个细胞,药物初步处理后放在37 ℃环境中4 h,随后将10 μL的CCK-8试剂添加至每个96孔板中,借助酶标仪对吸光度值进行检测和记录。
1.5 细胞体外侵袭实验
每个Transwell上室铺有一层Matrix基质胶模拟体内环境,收集对数生长期的HUVEC或MKN28细胞悬液,经冰PBS缓冲液洗涤3次,并将细胞悬液的密度调节至2×105/mL,将20 μL细胞悬液加至Transwell上室,再将500 μL的DMEM完全培养基加入Transwell下室,Transwell小室置于37 ℃中温育过夜后加入1~2滴结晶紫试剂,反应15 min后在光学显微镜下观察转移至Transwell小室背侧的细胞,在×200视野下随机计数5个视野下的蓝染细胞,实验重复3次,取平均值。
1.6 小管形成实验
将不含胎牛血清的培养基和Matrigel基质胶放置冰箱冷藏柜内12 h,待其变成胶冻状,以1∶2的比例混合培养基和Matrigel基质胶,将250 μL稀释后的Matrigel基质胶加入24孔板中,再放入37 ℃细胞培养箱中温育1 h,观察到Matrigel基质胶凝结成块。将HUVEC悬液的密度调节至3×106/mL,将0.1 mL细胞液滴加至预先铺好基质胶的24孔细胞培养板中,最后放入37 ℃细胞培养箱中培养1 h,在光学显微镜下对小管形成状况进行观察和拍照。
1.7 蛋白质印迹法(Western blot)检测
HUVEC或MKN28细胞在细胞裂解液的作用下提取蛋白,总蛋白经匀浆、离心和变性等操作后,使用凝胶电泳分离后转移至硝酸纤维素膜上后通过脱脂奶粉进行封闭操作,整体实验环境为4℃,维持12 h,硝酸纤维素膜分别经过一抗和二抗的温育后,利用显影定影试剂盒完成最后的显色和曝光操作。
1.8 基质胶塞实验
3~7周的BALB/c雌小鼠从中国科学院上海生命科学研究院购得,裸小鼠放置在层流净化屏障系统内饲养。将Matrigel基质胶放置4 ℃下12 h,待其变成液态,实验分对照组、VEGFA组和VEGFA+DHM组,每组5只裸鼠,对照组裸鼠经皮下注射Matrigel基质胶0.5 mL,VEGFA组裸鼠经皮下注射添加VEGFA(20 μg/L)的Matrigel基质胶0.5 mL,VEGFA+DHM组裸鼠皮下注射物为混匀VEGFA(20 μg/L)和DHM(5 mmol/L)的Matrigel基质胶0.5 mL,皮下注射部位为裸小鼠的腹中线附近。Matrigel基质胶注射入皮下组织后迅速形成一个胶塞,1周后处死裸鼠取出基质胶塞,严格根据Drabkin 525试剂盒的说明书的步骤和说明进行血红蛋白浓度测定。
1.9 建立裸鼠MKN28移植瘤模型
在DMEM培养基中重悬MKN28细胞,并将细胞悬液的密度调节至3×107/mL。将0.2 mL悬浮肿瘤细胞液皮下注射到裸小鼠的右下肢,接受注射2周后,皮下异种移植物的体积在裸小鼠可长达100 mm3或更大,将10只注射肿瘤细胞成功的荷瘤裸小鼠按随机数表法分为对照组和DHM组,对照组5只裸小鼠经灌胃给予0.1%DMSO(0.2 mL/只),DHM组5只裸小鼠经食管插管给予DHM(30 mg/kg),调整每次给药剂量为0.2 mL,每天1次,共2周。在第4周结束时,终止体内实验,取皮下肿瘤组织称重并进行H-E染色。
1.10 免疫组织化学法检测Ki-67增殖指数及CD34、VEGFA的表达
所有样品用5%甲醛溶液固定过夜,用梯度乙醇脱水法将肿瘤组织进行脱水处理,包埋在石蜡中,并切片。根据SP染色法进行免疫组织化学染色,Ki-67阳性染色少数位于细胞质中,大都在细胞核中,CD34少数表达于细胞质中,绝大部分表达于细胞膜中,VEGFA阳性表达大都在细胞质中,随机选择20个视野并在低倍镜下拍照,使用Image-Pro Plus 6.0图像处理软件分析Ki-67和VEGFA在样本中的积分光密度(IOD)值,在×200光学显微镜下选取10个视野,计数每个视野下CD34阳性细胞,取平均值。
1.11 统计学处理
在该实验中获得的所有测量数据表示为,并且通过ANOVA方差SNK-q方法分析两个样品之间的差异,P<0.05为差异有统计学意义。
2 结果
2.1 DHM对体外MKN28细胞或HUVEC生长的影响
将依次浓度升高的DHM(0.5、1.0、2.5、5.0、10.0、25.0、50.0和100.0 mmol/L)分别作用MKN28细胞或HUVEC,24 h后经CCK-8法测定细胞活力情况,结果表明低浓度DHM(0.5~10.0 mmol/L)对体外MKN28细胞的生长无明显抑制作用,最高浓度(100.0 mmol/L)的DHM作用MKN28细胞后仅使细胞存活率从100.00%(对照组)降低到(59.21±12.34)%。而HUVEC对DHM的敏感性明显高于MKN28细胞,低浓度(0.5~2.5 mmol/L)的DHM对HUVEC活力无明显影响,但较高浓度(5~100 mmol/L)的DHM可有效抑制HUVEC活力,呈浓度依赖关系(图1),2.5 mmol/L的DHM对约90%的HUVEC没有明显的毒性,表明浓度不超过2.5 mmol/L的DHM对细胞生长没有影响,因此本研究选择0.5~2.5 mmol/L的DHM进行后续实验。

图1 不同浓度DHM对体外MKN28细胞或HUVEC活力的影响Fig.1 The viability of MKN28 cells and HUVEC after DHM treatment was detected by performing CCK-8 assay
2.2 DHM对HUVEC侵袭和小管形成的抑制作用
首先,采用细胞体外侵袭实验对DHM处理后的MKN28细胞侵袭行为进行分析。如图2A所示,依次浓度升高的DHM(0.5、1.0、2.5 mmol/L)作用于MKN28细胞后对MKN28细胞侵袭行为无明显影响,与对照组比较,差异均无统计学意义(P>0.05)。而VEGFA(20 mg/L)处理明显增强了MKN28细胞侵袭行为,与DHM(2.5 mmol/L)组比较,差异有统计学意义(P<0.05)。
如图2B所示,相同浓度的DHM对HUVEC侵袭行为的抑制作用明显强于MKN28细胞,(0.5、1.0、2.5 mmol/L)的DHM作用HUVEC后,侵袭细胞数分别为31.6±5.6、27.2±3.9和25.6±4.3,DHM可以明显抑制HUVEC的侵袭行为,与对照组(57.8±8.9)比较,差异均有统计学意义(P<0.01)。
其次,利用小管形成实验检验DHM对体外HUVEC的体外血管生成能力,如图2C所示,HUVEC在体外铺满Matrigel基质胶的培养板中生长12 h后,细胞逐渐向两端延长呈梭形,同时细胞延长端开始在Matrigel基质胶中伸展,相邻细胞开始出现联接并出现管腔样结构,0.5、1.0、2.5 mmol/L的DHM作用于HUVEC后,体外小管形成数分别为24.3±4.8、21.4±3.9、20.6±3.2,均显著低于对照组(52.6±7.2),差异有统计学意义(P<0.001),表明DHM可有效地抑制HUVEC体外小管形成能力。而VEGFA(20 mg/L)处理可一定程度上逆转DHM对HUVEC侵袭和小管形成能力的抑制作用,与DHM(2.5 mmol/L)组相比较,差异均有统计学意义(P<0.001)。综上所述,以上结果表明低浓度DHM无明显细胞毒作用,但可有效地抑制HUVEC体外血管生成能力。
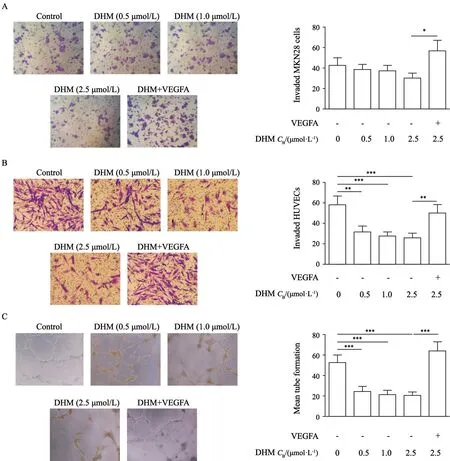
图2 不同浓度DHM对体外MKN28细胞和HUVEC侵袭能力及小管形成作用的影响Fig.2 Effects of DHM on the invasive abilities of MKN28 and HUVEC cells in vitro and tube formation
2.3 DHM对MKN28细胞和HUVEC中ERK/VEGFA/VEGFR2通路相关蛋白水平的影响
为探讨DHM对HUVEC发挥血管生成抑制作用的分子机制,应用Western blot法测定ERK/VEGFA通路蛋白在MKN28细胞中的含量。如图3A所示,用(0.5、1.0、2.5 mmol/L)的DHM作用于MKN28细胞后,可导致VEGFA和phospho-ERK的表达随DHM浓度升高而下降,而DHM对MKN28细胞中phospho-p38和phospho-JNK的表达无明显影响。另外,相同浓度DHM作用HUVEC后可呈浓度依赖性抑制HUVEC中phospho-VEGFR2的表达(图3B)。
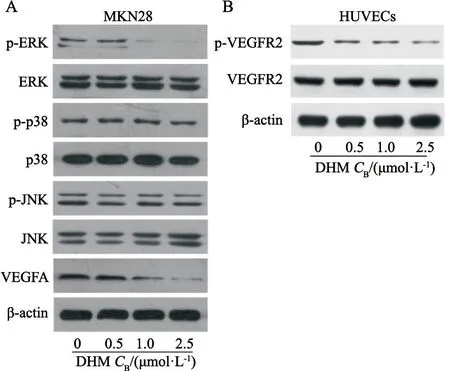
图3 DMY对体外MKN28细胞和HUVEC中ERK/VEGFA/VEGFR2信号通路蛋白水平的影响Fig.3 Effects of DMY on the protein expression levels of ERK/VEGFA/VEGFR2 pathway factors in MKN28 cells and HUVEC detected by Western blot
2.4 DHM对体内血管生成的影响
为进一步明确DHM对血管生长的调控作用,应用基质胶塞实验检测DHM对体内血管生成的作用。实验结果后留取3组胶塞如图4A所示,对照组基质胶塞色灰白,散在血管分布;加入VEGFA(20 μg/L)的基质胶塞在裸鼠皮下组织血管化明显,色泽暗红,在显微镜下可见血管内大量红细胞,表明新生血管在基质胶塞中形成,对照组和VEGFA组血红蛋白浓度分别为(3.62±0.59)g/L和(32.70±6.80)g/L,两组之间的差异有统计学意义(P<0.001);而VEGFA+DHM组基质胶塞在巨观下可见新生血管数量较VEGFA组明显减少,其血红蛋白浓度为(9.10±1.50)g/L,较VEGFA组之间的差异有统计学意义(P<0.001)。
2.5 DHM对MKN28裸鼠移植瘤生长和血管生成的影响
随后通过建立MKN28裸鼠皮下移植瘤研究DHM对体内胃癌生长及血管新生的影响。首先通过在DHM(30 mg/Kg)用药的2周内每日监测裸鼠体质量变化(图4B),对照组裸鼠体质量从给药前的(20.71±0.32)g升至实验结束时的(21.53±0.23)g,而DHM组裸鼠体质量在给药前和实验结束时分别为(20.86±0.36)g和(20.65±0.32)g,两组裸鼠体质量在给药前和实验结束后差异均无统计学意义(P>0.05),从而表明本次实验所选用的DHM剂量(30 mg/Kg)对实验动物无明显不良反应。
在4周处死裸鼠后,将皮下肿瘤仔细剥离并称重,两组裸鼠尸检结果如图4C所示,对照组平均肿瘤质量为(0.45±0.09)g,DHM组平均肿瘤质量为(0.14±0.03)g,两组比较差异有统计学意义(P<0.001)。
H-E染色后在镜下可见对照组肿瘤细胞为低分化胃癌,增殖活跃,肿瘤中血供丰富,DHM组肿瘤细胞增生相对较慢,血供较为贫乏,可见大量组织坏死(图4D);免疫组织化学法测定Ki-67、CD34和VEGFA在裸鼠皮下异种移植物中的阳性染色情况如图4D所示,对照组和DHM组肿瘤组织中Ki-67的IOD值分别为156.63±30.35和138.67±22.54,两组比较差异无统计学意义(P>0.05);对照组和DHM组肿瘤组织中CD34阳性表达分别是32.1±6.43和11.7±3.49,差异有统计学意义(P<0.001);VEGFA在对照组和DHM组肿瘤组织中的IOD值分别为284.91±53.86和104.64±24.32,VEGFA在DHM组中的阳性表达较对照组明显降低,差异有统计学意义(P<0.001)。

图4 DHM对小鼠体内肿瘤生长的影响Fig.4 The effect of DHM on tumor cell growth in vivo
3 讨 论
DHM作为一种近年来药理学研究非常深入的活性氢化黄酮醇类有机物,在多种疾病模型中具有良好效果[5-6]。同时DHM具有优秀的抑癌效应,但既往将DHM用于体外抗癌研究的浓度范围大多为50~100 μmol/L[7-8],在其发挥抗癌效应的同时不可避免地会产生一定的不良反应。为此,本研究首先使用依次增高浓度的DHM分别作用体外胃癌MKN28细胞和HUVEC,发现低浓度(0.5~10.0 μmol/L)的DHM对体外胃癌细胞生长和侵袭行为无明显抑制作用,但HUVEC对DHM的生长抑制效应更加敏感,5.0 μmol/L的DHM即可有效抑制体外HUVEC生长,同时更低浓度范围(0.5~2.5 μmol/L)的DHM对体外HUVEC的侵袭和小管形成具有明显抑制作用。另外在体内实验中,较低剂量(30 mg/Kg)的DHM对实验动物无明显的不良反应,但低剂量的DHM对胃癌皮下移植瘤生长和血管新生具有明显抑制效应。这是首次全面报道DHM在低剂量下对体内外细胞无明显的不良反应,但可通过阻断肿瘤血管生成,从而抑制恶性肿瘤生长,本研究表明DHM可望作为一种低毒高效的血管生成抑制剂用于临床胃癌治疗。
血管内皮细胞在细胞炎性信号、切应力和激素水平等信号的作用下,可分泌多种血管活性物质,从而调节血液稳态、新生血管形成和组织再生。肿瘤组织中的血管内皮细胞在组织形态、增生方式和免疫学特征等方面和正常组织血管内皮细胞存在较大差异,肿瘤组织内血管内皮细胞增生为顺应肿瘤生长的需要,在肿瘤细胞分泌的多种促血管生长因子的作用下,肿瘤血管内皮细胞的活力、侵袭能力及新生血管能力均得到不同程度增强,以适应肿瘤发展和转移的需要。一般而言,肿瘤生长至1 mm3时就需要新生血管生成以维系恶性肿瘤不断增殖所需要的养分。为此,根据肿瘤内皮细胞的特点,靶向肿瘤血管内皮细胞的治疗应运而生,有效抑制包括胃癌在内的恶性肿瘤血管新生,可有效抑制恶性肿瘤的发展和转移,从而改善恶性肿瘤患者预后[9-10]。本研究中,低剂量的DHM不仅对体外血管生成具有显著抑制效应,还可以抑制体内血管生成;虽然DHM对体内胃癌生长具有显著延缓作用,但DHM并不能有效地降低Ki-67增殖指数,而DHM给药后可明显抑制体内胃癌新生血管形成,因此,本研究显示低剂量的DHM不能干扰肿瘤细胞恶性增殖,但能通过抑制新生血管形成从而造成肿瘤处于“饥饿”状态,进而达到延缓肿瘤生长的作用,通过H-E染色观察到DHM组肿瘤组织中出现大片细胞坏死的痕迹可以说明这一点,表明抑制新生血管形成在低剂量DHM发挥抑制体内胃癌生长过程中发挥主导作用。
ERK作为一种脯氨酸导向的丝氨酸/苏氨酸激酶,主要位于细胞质中,在诸如生长因子、激素、细胞因子、高糖和缺氧等刺激后发生磷酸化,磷酸化的ERK可进入细胞核中,进一步活化NF-κB及P70核蛋白体S6激酶,使得相邻脯氨酸的丝氨酸/苏氨酸发生磷酸化。磷酸化ERK在介导信号从细胞膜表面受体转导至细胞核过程中发挥关键调控作用,p-ERK可激活STATs、c-Myc、Jun、EIk-1、ATF2和Max等转录因子,进而对这些转录因子各自靶基因的转录和翻译过程产生影响,最终对内皮细胞的迁移、分化和增殖等多种生理功能发挥调控作用[11-13]。VEGF作为一种在可由正常细胞和肿瘤细胞合成分泌的细胞因子,在正常组织细胞中呈低水平表达,且表达水平较为恒定,但其在许多肿瘤细胞中表达上调,是促进肿瘤细胞新生的最重要调节因子。VEGFA作为VEGF家族中与血管新生关系最密切的一员,有研究表明,VEGFA在恶性肿瘤细胞中的异常表达与肿瘤肝转移存在正相关性,同时与恶性肿瘤患者的预后呈明显负相关。VEGFA在肿瘤细胞中的表达与ERK磷酸化水平关系密切,另外人肝细胞生长因子可通过ERK信号通路上调肿瘤细胞中VEGFA的表达,从而促进肿瘤组织中血管生成[14-15]。在本研究中,DHM可抑制体外胃癌细胞中ERK的磷酸化水平,同时下调VEGFA在体内外胃癌中的表达,同时在体外实验中,DHM对血管内皮细胞功能的影响能被额外添加的VEGFA所逆转,证实DHM主要通过下调VEGFA的表达从而发挥抑制血管新生抑制作用;而在体内实验中,DHM可在VEGFA存在的情况下有效抑制体内血管生长,这可能是因为体内外环境的差异从而导致DHM作用效果的不同;除了ERK,还有诸如JNK和p38等多种信号通路可调控血管生成[16],但在本研究条件下,低浓度DHM不能影响JNK和p38的磷酸化水平。因此,DHM可能通过抑制ERK/VEGFA信号通路抑制肿瘤血管生成,从而干扰肿瘤的恶性增殖。
新生血管生成需要大量血管生成因子参与调控,包括VEGFR,VEGF自肿瘤细胞分泌后与位于内皮细胞表面的VEGFR结合,有助于内皮细胞募集和血管通透,并通过调节血管内皮细胞的降解、分化、增殖和迁移等过程,在调节血管生成过程中发挥非常关键的效应,最终促进新血管的形成[17-18],而VEGFA/VEGFR2是其中最重要的血管生成信号轴。本实验也观察到DHM可有效抑制VEGFR2在HUVEC中的磷酸化水平,结合之前的实验结果,从而表明DHM可能通过调控胃癌细胞中ERK信号通路,影响胃癌细胞VEGFA的表达,同时抑制VEGFR2在血管内皮细胞中的表达从而抑制内皮细胞功能。
综上所述,DHM在发挥抑制肿瘤血管新生过程中伴有ERK/VEGFA/VEGFR2通路的失活,但鉴于体外实验中额外添加的VEGFA可一定程度下逆转DHM对HUVEC的影响,从而表明VEGFA可以通过其他信号通路促进血管内皮细胞的功能,所以还需要进一步研究DHM发挥抗血管新生的作用机制,同时本次体内实验中DHM作用时间较短(2周),可能使实验结果产生偏倚,还需进一步实验明确。但本次研究仍然为开发低毒高效的抗癌药物提供了新的思路,有望将DHM作为临床胃癌化疗的“补充选择”。

