碘-125粒子植入治疗碘难治性分化型甲状腺癌淋巴结转移灶的临床研究
中南大学湘雅医学院附属肿瘤医院/湖南省肿瘤医院核医学科,湖南 长沙 410013
甲状腺癌是最常见的内分泌系统恶性肿瘤。近年来中国甲状腺癌发病率明显上升,成为30岁以下女性人群最主要的癌症类型[1-2]。甲状腺癌构成中以分化型甲状腺癌(differentiated thyroid carcinoma,DTC)为主,有5%~23%的DTC患者在疾病发展及治疗过程中逐步丧失摄碘能力,发展为碘难治性DTC(radioactive iodinerefractory DTC,RAIR-DTC)[3-4]。甲状腺癌多见淋巴结、肺及骨转移,其中以淋巴结转移最为常见[5]。由于头颈部解剖位置特殊、复杂及重要组织较多,手术摘除淋巴结转移灶常导致切口感染、积液、坏死、神经及血管受损等并发症,外科手术治疗受到一定程度的制约。放射性粒子组织间近距离治疗在治疗局部恶性肿瘤方面发展迅速,碘-125(125I)衰变产生的γ射线在瘤体内持续杀伤肿瘤细胞,且对周围正常组织损伤少。125I在碘难治性甲状腺癌的治疗中得到初步应用,有学者在甲状腺癌骨转移治疗方面取得了较好的疗效,该治疗方法局部控制效果好、操作方便、可明显改善患者生活质量[6]。
本研究旨在探究125I植入治疗RAIR-DTC患者颈部淋巴结转移灶的疗效及安全性。
1 资料和方法
1.1 研究对象
中南大学湘雅医学院附属肿瘤医院自2013年—2017年行RAIR-DTC颈部淋巴结转移灶125I粒子植入术治疗患者39例。具体情况见表1。
1.1.1 入选标准
⑴病灶属于RAIR-DTC转移灶,在促甲状腺激素(thyroid-stimulating hormone,TSH)刺激及无外源性碘负荷干扰的低碘状态下出现下列情形之一[4,7]:①转移灶在清甲成功后的首次131I显像中即表现为不摄碘;②原本摄碘的功能性转移灶经131I治疗后逐渐丧失摄碘能力;③部分转移灶摄碘,而部分转移灶不摄碘,且可被18F-FDG PET/CT、CT或MRI等其他影像学检查手段所显示;④ 摄碘转移灶在经过多次131I治疗后虽然保持摄碘能力但仍在1年内出现病情进展。⑵按实体瘤疗效评价标准1.1(response evaluation criteria in solid tumors,RECIST 1.1),至少有1处可测量病灶:淋巴结最大截面短径≥15 mm。⑶经穿刺活组织病理学检查证实为甲状腺癌颈部淋巴结转移。⑷18F-FDG PET/CT、CT或MRI等影像学检查提示无远处转移灶。⑸均不能或不同意再次进行手术切除、放疗、靶向药物治疗。⑹ 签署知情同意书。
1.1.2 排除标准
⑴有凝血障碍患者;⑵心功能不全患者;⑶不能耐受穿刺手术患者;⑷妊娠及哺乳的女性患者;⑸ 颈部穿刺部位有感染。本研究经中南大学湘雅医学院附属肿瘤医院伦理委员会批准。
1.2 仪器设备及方法
1.2.1 设备
采用德国西门子公司生产的64排螺旋CT对患者进行诊断。125I粒子和植入枪购自北京智博医药有限公司,粒子大小4.5 mm×0.8 mm,钛合金包壳,半衰期59.6 d,平均能量27~35 keV,经高温高压蒸汽灭菌后方可使用。粒子治疗计划系统(treatment planning system,TPS)由北航粒子计划系统公司提供。
1.2.2 术前计划
植入术前设计治疗计划。对肿瘤区行CT扫描,层厚0.5 cm,必要时扫描前口服造影剂;扫描后将CT图像导入TPS,在相应层面勾画临床靶体积(clinical target volume,CTV)及危及器官;确定处方剂量,选取合适活度的粒子,自动载入,根据所需要的处方剂量调整粒子位置及数目;计算等剂量曲线;导出术前剂量体积直方图
(dose-volume histogram,DVH);对于靶区与周围组织器官相对固定的肿瘤,术前可应用个性化3D打印模板。计划设计完成后将数据传输至3D打印机,模板打印完毕后即可应用。处方剂量为120~140 Gy,粒子活度范围为0.5~0.6 mCi(1.85×107~2.22×107Bq)。
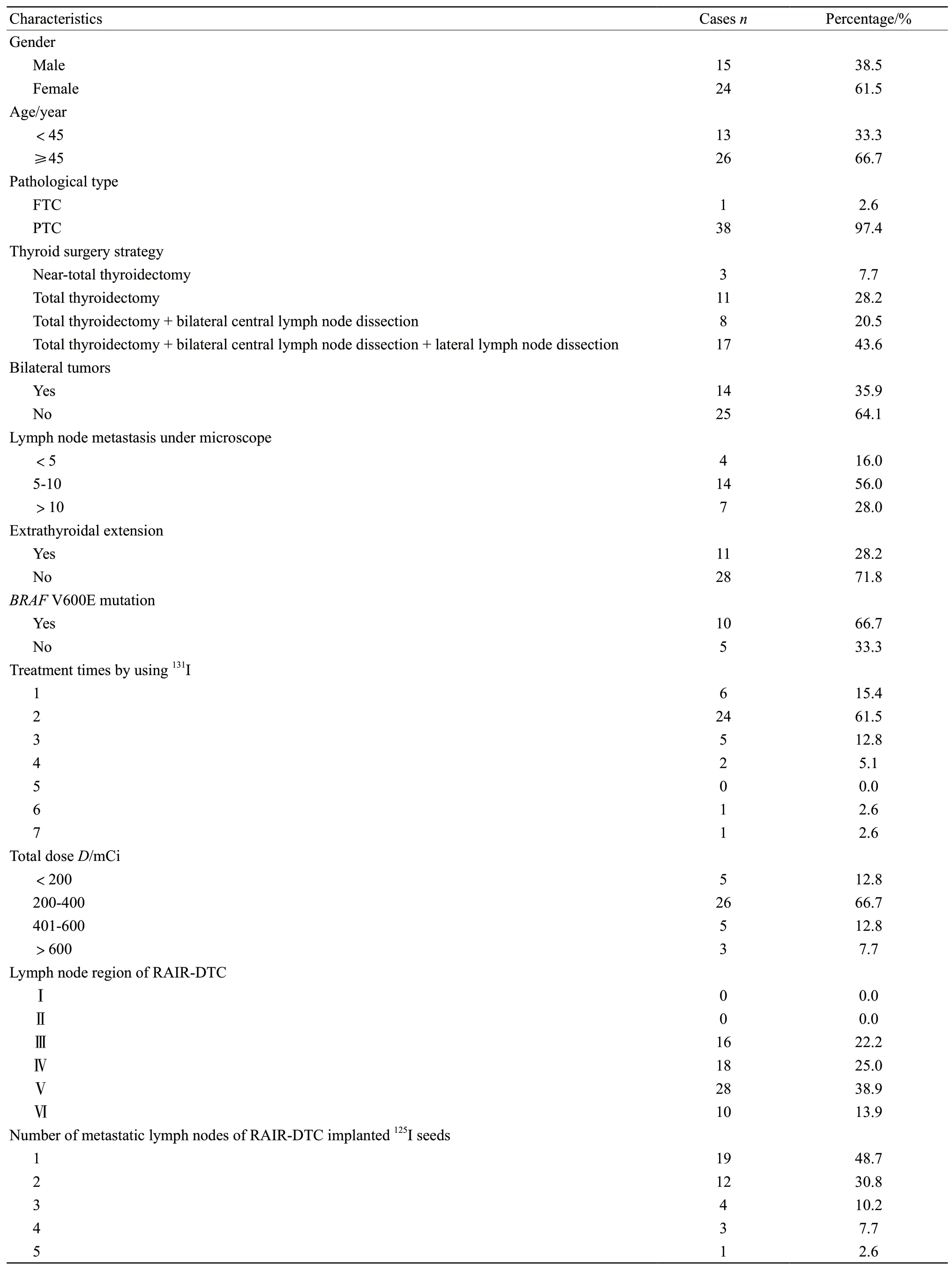
表1 患者临床病理特征Tab.1 Clinical and pathological data
1.2.3 术中实时计划
粒子植入过程中根据实时的针道位置及植入的粒子位置随时计算剂量,实行剂量优化。根据术前预计划,所有脊柱针穿刺到位后CT扫描,层厚0.5 cm;扫描后将CT图像传入TPS,在相应层面勾画CTV及危及器官;识别穿刺针针道,选取粒子的活度,在CT所示针道上载入粒子;计算等剂量曲线,导出DVH图;如靶区内剂量不能满足要求,则在相应层面上用TPS增加针道,载入粒子,根据新增加的针道位置再次穿刺肿瘤;CT扫描植入针位置无误后按术中计划植入粒子。再次扫描CT,将数据传入TPS行剂量验证。如仍有剂量冷点,重复上述步骤的最后两步直至剂量满足要求。
1.2.4 术后验证
术后即刻或术后不同时间根据实际的粒子植入位置设计的剂量验证计划。评价粒子植入质量,如有剂量冷点立即补植。
1.3 疗效观察指标
可测量病灶按RECIST 1.1分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、病情稳定(stable disease,SD)、疾病进展(progressive disease,PD)[8]。每3个月复查颈部增强CT、TSH抑制状态下血清Tg水平至治疗后12个月。淋巴结属可测量病灶时以最大截面短径作为病灶最大径。
1.4 并发症
即刻并发症(粒子植入后≤24 h):穿刺部位疼痛、出血(或血肿)。围手术期并发症(粒子植入后24 h~30 d):粒子移位和游走。迟发并发症(粒子植入后≥30 d):皮肤和黏膜损伤。急性放射反应指放疗开始之日起3个月内发生的放射反应。迟发性放射反应指放疗开始之日起3个月后发生的放射反应。并发症分级参照常见不良事件评价标准5.0(common terminology criteria for adverse events 5.0,CTCAE 5.0)分为5级[9]。
1.5 统计学处理
Tg水平采用中位数描述集中趋势,四分位数间距描述离散趋势;淋巴结最大截面短径采用描述其分布。数据采用SPSS 20.0软件(IBM SPSS Software,IBM Corporation)分析,治疗前后淋巴结短径的大小变化采用重复测量方差分析,治疗前后的Tg水平采用配对样本t检验分析,植入粒子数与淋巴结最大截面短径改变量的关系、植入粒子数与Tg改变量的关系采用Spearman秩相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 疗效
2.1.1 粒子植入治疗后对TSH抑制状态下血清Tg水平的影响
治疗后3个月血清Tg水平较治疗前显著降低(t=2.2,P<0.05);血清Tg水平治疗后6个月较治疗后3个月、治疗后9个月较治疗后6个月、治疗后12个月较治疗后9个月差异无统计学意义(P均>0.05)。因Tg数值相差大,不满足正态分布,故转换为其对数形式。粒子植入治疗前Tg水平最高,其次为粒子植入后3个月,第6、9、12个月水平相当。Tg水平中位数治疗前为6.6 ng/mL、治疗后3个月为5.7 ng/mL、治疗后6个月为4.6 ng/mL、治疗后9个月为3.8 ng/mL、治疗后12个月为4.7 ng/mL;四分位数间距分别为86.4、52.7、43.9、29.1和26.7 ng/mL。差异有统计学意义(P<0.001)。
2.1.2 判断粒子植入治疗后对可测量病灶最大截面短径的影响
如表2所示,治疗前及治疗后3个月、治疗后6个月、治疗后9个月和治疗后12个月的可测量病灶最大截面短径分别为(18.3±1.2)、(15.1±1.1)、(13.8±1.0)、(12.9±1.0)和(12.9±1.0)mm[F=35.464(1.939,71.751),P<0.001],表明粒子植入治疗后每3个月可测量病灶的最大截面短径差异有统计学意义。两两比较发现,治疗后3、6、9和12个月可测量病灶最大截面短径比治疗前分别降低了3.2、4.5、5.4和5.4 mm(P均<0.001);治疗3个月与治疗6、9和12个月比较可测量病灶最大截面短径差异有统计学意义(P均<0.001),短径随时间增加而逐渐缩小。治疗后6个月与9个月及12个月比较、治疗9个月与治疗12个月比较短径变化无统计学意义(P均>0.05)。

表2 TSH抑制治疗下靶病灶最大截面短径(mm)Tab.2 The maximum short diameters of lymph nodes following TSH inhibition
2.1.3 植入粒子数与淋巴结最大截面短径改变量的关系
对植入粒子与可测量病灶短径缩小量的相关性分析结果为第3个月(rs=0.344,P<0.05)、第6个月(rs=0.468,P<0.05)、第9个月(rs=0.498,P<0.05)、第12个月(rs=0.486,P<0.05),表明粒子植入数量与可测量病灶短径缩小量呈弱正相关关系。
2.1.4 植入粒子数与Tg改变量的关系
对植入粒子数与Tg水平减少量进行相关性分析,结果显示,第3、6、9和12个月Tg水平减少量,差异无统计学意义(P均>0.05)。植入数量与Tg水平减少量无明显相关关系。
2.1.5 随访
随访12个月,CR 0例,PR 17例,SD 19例,PD 0例,死亡3例。客观缓解率为43.6%,疾病控制率为92.3%。治疗后1年内无进展生存期均值11.2个月(95%CI:10.4~11.8);截止2018年12月,患者生存情况:39例总生存期的均值为64.7个月(95% CI:54.4~73.0),最长78.0个月,最短为3.0个月。
2.2 安全性
25例患者在植入术后24 h内出现1度疼痛;3例出现穿刺部位血肿,经重新压迫止血后未继续出现。39例患者均未见粒子移位及游走。1例在3个月内植入部位皮肤出现1度溃疡,未行特殊处理,自行好转;另1例于3个月内出现2度皮肤溃疡,经局部消毒、换药处理后溃疡面缓慢愈合。
3 讨 论
大多数DTC患者经过手术、131I治疗和TSH抑制治疗后预后良好,可长期生存。然而部分患者在自然状态下或治疗过程中病灶逐渐失分化,丧失摄碘能力,最终发展为RAIR-DTC,其10年生存率不足10%[4]。目前,针对RAIR-DTC的治疗主要包括远处转移灶的切除、常规化学治疗及外放射治疗,但治疗效果欠佳。目前有多种抗血管生成药物开展针对甲状腺癌的研究,比如一线靶向药索拉非尼Ⅲ期临床试验数据中索拉非尼治疗患者的中位无进展生存期为10.8个月,比安慰剂组的5.8个月明显延长[10]。但大多数患者在靶向药物的使用中出现不良反应,如手足综合征、血压升高等,常导致患者不能继续使用靶向药物[3,10]。放射性粒子组织间植入是近年来迅速发展的一种局部控制恶性肿瘤的治疗方法。粒子内部的125I发生衰变,释放出射线累积到特定的剂量,可杀灭肿瘤细胞。其独特的物理学和放射生物学优势,为恶性肿瘤的治疗增添了一种新颖而有效的手段,目前已在头颈部鳞癌、局部非小细胞肺癌、食管癌和胃癌等方面取得了较好的临床疗效[11-15]。然而放射性125I粒子植入治疗碘难治性甲状腺癌淋巴结转移灶还鲜有报道。
国内指南指出,患者经手术+131I清甲治疗后,血清Tg可作为评估甲状腺癌进展转移的指标,TSH抑制治疗下血清Tg<1 ng/mL为完全缓解,Tg>5 ng/mL考虑为复发或转移[5]。本研究治疗前Tg水平中位数为6.6 ng/mL,符合既往文献报道的结论。Tg水平在治疗后的3~6个月下降趋势最为明显,其次为0~3个月,再者为6~9个月时间段,9~12个月时间段稍有上升趋势。变化趋势考虑其原因与125I的半衰期及受照射组织累积剂量有关。
本研究淋巴结最大截面短径由治疗前的(18.3±1.2)mm,缩小至治疗后12个月的(12.9±1.0)mm,总体上呈现下降趋势。淋巴结最大截面短径变化与Tg水平变化趋势不同步,在治疗后3个月后中淋巴结最大截面短径变化最明显,与血清Tg水平变化表现出一定差异,可能3个月内虽然病灶缩小较快但仍具有一定的活性。
治疗后12个月内无进展生存期均值11.2个月,与索拉非尼Ⅲ期临床试验的中位无进展生存期10.8个月相比差异不大。
本研究中术后12个月内疾病控制率可达92.3%,而并发症以即刻并发症多见,占64.0%(24/39),但一般不影响患者正常生活。穿刺部位出血或血肿形成主要是因为穿刺过程中损伤穿刺路径上的血管,出现的3例均为老年人,可能因老年人颈部组织松软以及压迫止血不到位所致。预防的方法是术前进行强化CT扫描,进针路线的设计要避开较大的血管[16-17]、穿刺过程中B超实时监测,避免盲目进针,术后适当压迫止血。39例患者均未见粒子移位及游走。2例迟发并发症仍能有效控制及恢复,其中1例发生2度皮肤溃疡可能与粒子距离皮肤过近(小于1 cm)有关。说明125I粒子植入治疗RAIR-DTC颈部淋巴结转移灶的效果良好,不良反应轻微、可控。
综上所述,125I粒子植入治疗RAIR-DTC颈部淋巴结转移灶疗效确切、创伤小,为治疗RAIRDTC提供了一种新方法。鉴于目前病例数较少,随访时间也短,尚无法确定无进展生存期、总生存期等;仍需扩大样本量,延长随访时间,来评价125I粒子治疗RAIR-DTC颈部淋巴结转移灶的远期疗效。

