金思维对拟散发性AD小鼠海马PSD95和Shank1表达及学习记忆的影响
黄帅阳 吴艺琼 巩卓彦 王亚晗 玛娜璐璐 刘珍洪 秦高凤 王蓬文
阿尔茨海默病(alzheimer’s disease,AD)是以认知功能障碍和大脑萎缩为主要特征,且以突触和神经元丢失、大量β-淀粉样蛋白(beta-amyloid peptide,Aβ)沉积为主要的神经病理学病变[1]。在AD中、晚期神经病理学和形态学研究中发现大脑皮质和海马许多区域都存在明显的突触缺失,但许多早期患者的突触数量并没有明显减少,这些病人只表现出突触结构改变和功能障碍[2-3]。突触效能的改变可能发生在突触丧失之前,而这种改变主要取决于突触后谷氨酸受体数量的改变,同时伴随着树突棘和突触后密度(post-synaptic density,PSD)区域的扩大或缩小[4]。PSD是指含有N-甲基-D-天冬氨酸受体和亚型谷氨酸受体、PSD蛋白如PSD95和Shank1等的电子致密增厚物[5]。突触上谷氨酸受体的数量是决定突触效能的主要因素之一,它可以估计突触兴奋性突触后电流的大小。此外,PSD蛋白有助于解释突触的功能和区域结构以及它们在突触可塑性中的可能作用[6]。
中医药复方具有多靶点的特点,并在治疗SAD发挥了重要的作用。中医药复方金思维(以下简称“金思维”)是由人参、肉苁蓉、石菖蒲、熟地黄、茯苓等药物煎煮混合而成,具有补肾阳虚、豁痰开窍之效,金思维在临床应用也显示出显著的疗效。临床研究取75例轻度认知损害患者(mild cognitive impairment,MCI)进行1年的随访,发现金思维观察组简易智能精神状态检查量表(mini-mental state examination,MMSE)的分值和词语记忆积分与安慰组都存在明显差异,表明金思维对老年MCI患者的记忆衰退具有良好的改善作用[7]。实验研究也同时发现金思维提取物在APPV717I转基因小鼠大脑淀粉样斑块形成前后均有激活钙调蛋白依赖性激酶的表达和抑制钙调蛋白依赖性蛋白磷酸酶2B表达的作用,可能在一定程度上缓解AD神经元突触功能障碍[8]。然而,金思维在AD早期的具体治疗靶点仍不清楚。这些发现促使我们研究金思维对AD突触的作用机制。本研究采用双侧侧脑室注射STZ为拟SAD小鼠模型,通过观察海马CA1区突触相关蛋白PSD95和Shank1的表达,研究金思维对突触的影响。
1 材料与方法
1.1 实验动物
3月龄SPF级C57/BL6J雄性小鼠72只,体重22~25 g,由北京维通利华实验动物技术有限公司提供[SCXK(京)2012-0001],饲养于北京中医药大学东直门医院屏障环境动物室[SYXK(京)2015-0001],实验期间动物自由饮水、摄食。本实验经由北京中医药大学东直门医院实验动物伦理委员会批准实验进行(伦理号:16-21)。
1.2 试剂及仪器
金思维免煎颗粒剂(本品各中药比例人参为4.4%、苁蓉17.3%、地黄17.3%、远志13%、石菖蒲13%、姜黄13%、茯苓13%、丹参9%)由北京中医药大学东直门医院制备[8]。盐酸多奈哌齐由卫材(中国)药业有限公司生产提供(批号140635);链脲佐菌素(streptozotocin,STZ)(货号S0130)由美国Sigma公司生产;一抗鼠抗小鼠β-actin抗体(货号ab3280,Western blot 1∶1000)、兔抗小鼠PSD95抗体(货号ab18258,Western blot 1∶500;免疫组化1∶1000)、兔抗小鼠Shank1抗体(货号ab154224,Western blot 1∶1000,免疫组化1∶1000)均由Abcam公司提供。SDS-PAGE凝胶配制试剂盒;5×蛋白上样缓冲液(含DTT);ECL超敏发光液;甘氨酸、十二烷基硫酸钠(sod.dodecyl sulfate,SDS)、Tris base、无水甲醇等常规试剂购买自北京环亚泰克生物医学技术有限公司。BCA法蛋白浓度定量试剂盒(货号C-0018),购于北京博奥森生物技术有取公司。兔二步法检测试剂盒(货号PV-9001)、DAB试剂盒由北京中杉金桥生物技术有限公司提供。仪器YLS-3TB跳台记录仪购自济南益延科技发展有限公司;Mini-PROTEAN3电泳仪由美国BIORAD公司购买。
1.3 拟SAD小鼠模型制备和分组
拟SAD造模:随机取C57/BL6J小鼠60只于第1和第3天双侧侧脑室注射STZ(人工脑脊液配制,浓度6 mg/mL,3 mg/kg)。前囟后0.8 mm、矢状缝旁开1.5 mm处用牙科钻颅骨,暴露硬脑膜,微量注射器自表面垂直进针2 mm,缓慢注入5 μL液体(注射时间为5分钟),注射完毕缝合切口[9]。
分组及给药:将60只拟SAD模型小鼠适应性饲养一周后随机分为5组:模型组(0.5%CMC)、多奈哌齐组(0.92 mg·kg-1·d-1)及金思维大、中、小剂量组(20、10、5 mg·kg-1·d-1),每组12只。另取12只C57/BL6J小鼠于第1和第3天双侧侧脑室注射等体积人工脑脊液,作为对照组(0.5%CMC)。所有小鼠连续灌胃3个月(0.1 mL/10 g),1次/日。
1.4 拟SAD小鼠跳台实验检测
末次灌胃结束后进行跳台检测。YLS-3TB跳台记录仪是被黑色塑料板分隔为5个方形空间的密闭长方体,每个方形空间中心是一个绝缘性高站台,其黑箱底部铺以可通电流的铜栅。第1天为训练期,先将小鼠放入跳台箱内适应3分钟,接通底部铜栅交流电训练5分钟。第2天为试验期,将小鼠再次放在平台上,底部铜栅通交流电后,记录5分钟内小鼠第一次从平台跳下所需的时间(即跳台潜伏期),并以时间单位秒(s)记录,以此反映小鼠记忆获得和保持能力。
1.5 拟SAD小鼠海马PSD95和Shank1的Western blot检测
每组各取6只小鼠麻醉后断头处死,然后立即置于冰浴上剥离小鼠大脑海马组织,用生理盐水冲洗净后置于-180℃液氮罐中储存备用,取脑组织进行海马蛋白提取和BCA浓度测定。将海马置于EP管中,加入RIPA组织/细胞裂解液,利用超声粉碎机匀浆之后进行离心,获得上清液。配置BCA工作液,对海马组织进行浓度测定。按照制备SDS-PAGE胶、蛋白质加样、电泳、转膜、封闭、抗原抗体反应、显色、曝光的步骤进行操作。最后通过Image J软件对Western-blot所测蛋白条带进行分析,用内参β-actin的灰度值作为比较,对结果进行分析并计算相对百分数,即(ID/内参ID)×100%。
1.6 拟SAD小鼠海马CA1区PSD95和Shank1免疫组化检测
每组另外取6只小鼠灌注取材作免疫组织化学染色,将固定的脑组织进行冠状面取材、脱水、石蜡包埋、切片[5]。将小鼠海马CA1区制成厚度约为4 μm的连续冠状切片,然后对切片进行脱蜡、水化、抗原修复、兔二步法试剂检测、封闭、抗体反应、DAB显色、脱水透明、封片。最后在20倍物镜下选择3个视野观察海马CA1区阳性细胞数取平均值并与其他组阳性细胞数作比较分析。
1.7 统计学处理

2 结果
2.1 各组小鼠跳台测试结果
在行为学跳台测试中,模型组小鼠潜伏期时间与对照组相比显著降低(P<0.01),模型组小鼠记忆获得能力较差,对第1天的训练不能进行很好的记忆保持。多奈哌齐组和金思维小剂量组与模型组相比潜伏期时间显著增长(P<0.01),金思维大、中剂量组对比模型组潜伏期时间也有不同程度的增长(P<0.05),这表明金思维干预都不同程度的增强了小鼠的记忆获得能力,结果见表1。

表1 各组小鼠跳台潜伏期结果比较
注: 与对照组相比,aP<0.01;与模型组相比,bP<0.05,cP<0.01。
2.2 各组小鼠海马PSD95和Shank1的Western blot检测
与对照组相比,模型组小鼠海马PSD95蛋白(P<0.01)和Shank1(P<0.05)蛋白表达条带明显变细且颜色变浅;多奈哌齐组与模型组相比,PSD95和Shank1蛋白表达条带增宽,颜色加深(P<0.05);PSD95检测中金思维大、中剂量组较于模型组蛋白条带稍增粗,颜色略深;Shank1条带检测中金思维中剂量组(P<0.05)、小剂量组(P<0.01)相较于模型组都有不同程度的增粗和加深。结果见表2、图1。

表2 各组小鼠海马PSD95和Shank1 蛋白表达比较只)
注: 与对照组相比,aP<0.05,bP<0.01;与模型组相比,cP<0.05,dP<0.01。
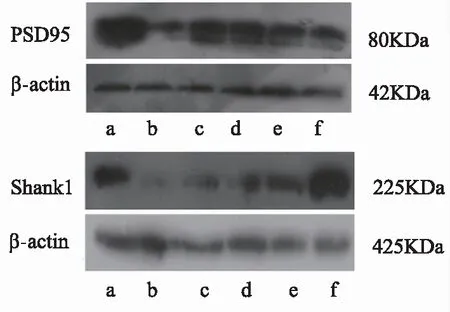
注:a对照组;b模型组;c多奈哌齐组;d金思维大剂量组;e金思维中剂量组;f金思维小剂量组
图1 各组小鼠海马PSD95和Shank1蛋白免疫印迹检测
2.3 各组小鼠海马CA1区PSD95和Shank1免疫组化检测
小鼠海马CA1区PSD95和Shank1阳性细胞棕黄色,细胞形状多为椭圆形或圆形。模型组与对照组相比,海马CA1区PSD95和Shank1的阳性细胞数均显著减少、染色变浅(P<0.01);与模型组相比,多奈哌齐组、金思维大剂量组和中剂量组的PSD95阳性细胞数都略增多(P<0.05);与模型组相比,多奈哌齐组中Shank1阳性细胞数明显增多(P<0.01),金思维中、小剂量组的Shank1阳性细胞数略增多(P<0.05),结果见表3,图2、3。
表3 各组小鼠海马CA1区PSD95和Shank1 阳性细胞数比较只)
注:与对照组相比,aP<0.01;与模型组相比,bP<0.05,cP<0.01。
3 讨论
在AD的研究中,突触被认为是最早的病理部位,突触的变化和丢失是认知损伤重要的病理相关[10]。早期记忆丧失源于神经元死亡前的突触功能衰竭,而突触功能衰竭源于Aβ寡聚体(Aβ-derived diffusible ligands,ADDLs)而非神经元纤维缠结[11]。PSD是兴奋性突触树突状棘内的一个局部密集区域,由突触可塑性相关的受体、激酶、结构蛋白和信号分子组成。PSD95是神经发育过程中参与谷氨酸能传递、突触可塑性和树突状形态形成的重要成分。因此,PSD95在发育过程中的功能障碍可能会改变树突棘上的突触可塑性发生,而这些突触可塑性的发生会导致与神经疾病相关的突触畸形改变[12]。实验数据表明这些ADDLs与神经元表面结合,且90%的结合位点与突触标记物PSD95共定位;同时Aβ42的神经毒性可以诱发PSD95蛋白表达的下调,进而影响突触可塑性,并导致大鼠的学习和记忆能力受损[13]。
Shank蛋白是PSD中谷氨酸受体的组织者,由Shank1、Shank2和Shank3三个基因编码[14],在神经发育和认知中起重要作用。其中Shank1在正常突触结构和信号传导中起着重要作用,包括突触长时程增强(long-term potentiation,LTP)和长时程抑制(long-term depression,LTD)作用,这些过程被认为是学习和记忆形成的基础[15-16]。研究发现Shank1敲除小鼠表现出树突棘密度降低,树突棘表型不成熟,在行为学测试中表现认知障碍[17]。这些研究都表明适当调控Shank1对于正常的突触结构和认知至关重要。在AD中,突触损伤的过程可能始于突触相关蛋白的失调,如PSD95和Shank1[18]。然而,海马体作为大脑重要区域之一,被一致认为参与调节学习和记忆功能,尚不确定Shank1在海马体中的发育表达。本研究的目的是在AD早期检测海马CA1中Shank1的表达,以确定正常海马发育与Shank1表达的关系。

注:a对照组;b模型组;c多奈哌齐组;d金思维大剂量组;e金思维中剂量组;f金思维小剂量组
图2 各组小鼠海马CA1区PSD95表达对比(免疫组化×20,标尺=50μm)

注:a对照组;b模型组;c多奈哌齐组;d金思维大剂量组;e金思维中剂量组;f金思维小剂量组
图3 各组小鼠海马CA1区Shank1表达对比(免疫组化×20,标尺=50μm)
STZ是一种亚硝基脲衍生物,在中枢可以阻断胰岛素受体引起脑源性胰岛素抵抗,从而使胰岛素信号传导障碍和氧化代谢下降[19]。已证实小剂量STZ双侧侧脑室隔日注射可以引起小鼠脑内持久的葡萄糖代谢紊乱和能量生成障碍,进一步引起高尔基体和内质网功能障碍,导致脑内Aβ表达增加,Aβ聚集成ADDLs,并可释放和结合到特殊位点,影响突触的结构和功能蛋白的表达,影响信号转导和突触可塑性,造成记忆丢失,常被作为拟SAD的动物模型应用[20]。
前期课题组研究发现用金思维干预治疗APP/PS1双转基因小鼠,可以明显改善AD小鼠在行为学水迷宫和跳台检测中的表现,电镜下观察AD小鼠海马的病理切片也发现金思维干预治疗组与模型组有显著差异,神经元、突触形态学结构较模型组都有明显改善[21]。在东莨菪碱致记忆障碍小鼠模型中,金思维可以提高模型组小鼠在水迷宫中的定向航行和空间探索能力,可使模型组小鼠脑内乙酰胆碱含量升高、乙酰胆碱酯酶活性下降和乙酰胆碱转移酶活性升高[22]。为了进一步评价金思维的作用和探究金思维对AD小鼠海马突触保护作用机制,课题组使用STZ双侧侧脑室隔日注射拟SAD模型进行了本次实验研究。结果发现模型组小鼠海马PSD95和Shank1表达均降低,药物组金思维的干预都不同程度的增加了PSD95和Shank1蛋白的表达。免疫组化和Western-blot结果显示一致,金思维给药组较于模型组小鼠海马CA1区的PSD95和Shank1的阳性细胞表达数量明显增加且染色深度不同程度的加深。这些结果表明金思维提高了SAD记忆获得能力,且可能是通过调节海马突触相关蛋白PSD95和Shank1来改善突触效能,从而发挥保护AD作用。

