促红细胞生成素在视网膜新生血管形成中的作用
江海波,邓娅青,熊思齐*
(1.中南大学湘雅医院眼科中心,湖南 长沙 410008; 2.眼科学湖南省重点实验室,湖南 长沙 410008)
视网膜新生血管作为糖尿病视网膜病变、视网膜静脉阻塞、早产儿视网膜病变和视网膜血管炎等疾病的共同病理过程,受到众多促血管生成因子的调节。促红细胞生成素(erythropoietin,EPO)的主要生物学功能是刺激幼红细胞前体的分化和增殖,刺激网织红细胞释放进入血液循环,并刺激细胞内蛋白质合成而起到调节红细胞生成的作用。同时,EPO作为血管内皮细胞的分裂原与血管内皮细胞生长因子(Vascular Endothelial Growth Factor,VEGF)具有相当的促血管生成潜力。EFO被证实参与了女性生殖器官血管形成[1]、炎症性血管形成[2]、伤口愈合过程中血管新生[3]及肿瘤新生血管形成[4]。因此,本研究拟以氧诱导的大鼠增殖性视网膜病变(OIR)为模型,揭示EPO的表达与视网膜新生血管形成的对应关系。
1 材料与方法
1.1 实验材料
清洁级C57BL/6J小鼠(中国科学院上海实验动物中心);Trizol裂解液及微量总RNA提取试剂盒(美国Invitrogen公司);反转录及cDNA合成试剂盒(美国Fermentas Life Science公司);山羊抗鼠EPO多克隆抗体(美国Santa Cruz公司);羊抗鼠β-actin单克隆抗体(美国Sigma公司);BCA Protein Assay Reagen Kit(美国Pierce公司);ECL试剂盒(美国Pierce公司)
1.2 实验方法
1.2.1 小鼠视网膜新生血管动物模型的建立 采用Smith等的方法建立氧诱导增殖性视网膜病变模型[5]。将鼠龄为出生后7天(P7)的C57BL/6J小鼠连同母鼠及测氧仪一起放入密闭的氧舱中,保持氧舱中的压力为常压(每天2~3次),控制氧浓度为75%±2%,温度23±2 ℃,每隔2天替换母鼠。室内采用日光灯照明,光照周期为12 h/12 h。5天(P12)后将小鼠放回到正常环境中继续饲养。
1.2.2 OIR模型鼠的鉴定 过量麻醉处死出生后第17天的正常组小鼠(5只)及模型鼠(5只),摘除眼球并4%多聚甲醛固定过夜。显微镜下沿角膜缘剪除角膜,去除晶状体和虹膜组织后,取出视网膜组织,采用内皮细胞特异性标记物isolectin4(IB4)-Alexa594抗体4度孵育过夜,PBS洗涤后,视网膜铺片,荧光显微镜下拍照观察视网膜组织的血管结构。
1.2.3 RT-PCR测定EPO mRNA的表达 采用Trizol一步法提取出氧舱后(P12)0天、出氧舱后半天(P12.5)、1天(P13)、一天半(P13.5)、2天(P14)、5天(P17)、1周(P19)及2周(P26)等8个时间点模型小鼠的视网膜总蛋白(每个时间点4只小鼠),提取总RNA并逆转录成cDNA,PCR仪扩增目的基因。EPO引物序列:上游-5′TGGAGGTGGAAGAACAGG3′;下游5′GCAGTGAAGTGAGGCTA CG 3′,PCR产物大小为165 bp。β-actin引物序列:5′CTGGGACGACATGGAGAAGA 3′;下游5′AAGGAAGGCTGGAAAAGAGC 3′ PCR产物大小为564 bp。PCR反应条件:94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共进行30个循环,72 ℃再延伸10 min。所有标本检测均重复3次。PCR扩增产物用1.5%琼脂糖凝胶电泳,电压为100 V,通电时间为20~30 min。采用Eagle eyeⅡ图像分析仪对电泳条带进行灰度值分析。结果以EPO与内参照β-actin mRNA扩增产物的灰度相对比值表示。
1.2.4 Western blot测定EPO蛋白质的表达 提取P12、P12.5、P13、P13.5、P14、P17、P19及P26模型鼠视网膜组织(每个时间点4只小鼠),视网膜组织研磨后加入蛋白抽提液裂解,离心提取蛋白后测定蛋白质浓度。取蛋白样品于SDS-PAGE凝胶中电泳,待目的蛋白接近凝胶底部时停止电泳,120V恒压电转移至PVDF滤膜上,5%脱脂奶粉室温封闭1 h,加入一抗羊抗鼠EPO抗体和羊抗鼠β-actin抗体,4 ℃过夜。再加入二抗(生物素化的兔抗羊IgG),室温孵育2 h,加入辣根过氧化物酶标记的兔抗羊IgG室温孵育30 min后,ECL化学发光法检测,以β-actin作为内对照。
1.3 统计学分析
采用SPSS 11.0软件包对数据进行统计分析。多组间比较采用ANOVA方差分析,两组间的比较采用LSD-t检验,以P<0.05认为差异具有统计学意义。
2 结 果
2.1 荧光造影视网膜铺片观察视网膜血管形态
正常P17小鼠视网膜铺片可见整个视网膜血管分布呈均匀的网状结构,视盘中央发出的血管规则地呈放射状向周边部走行,视网膜血管间的毛细血管交织成网状(图1A)。模型组小鼠视盘周围毛细血管闭塞,可见大片无灌注区。视网膜大血管不规则扩张,走行纡曲。中周部正常毛细血管网消失,血管密度增高且分布紊乱,可见新生血管丛和荧光渗漏(图1B)。
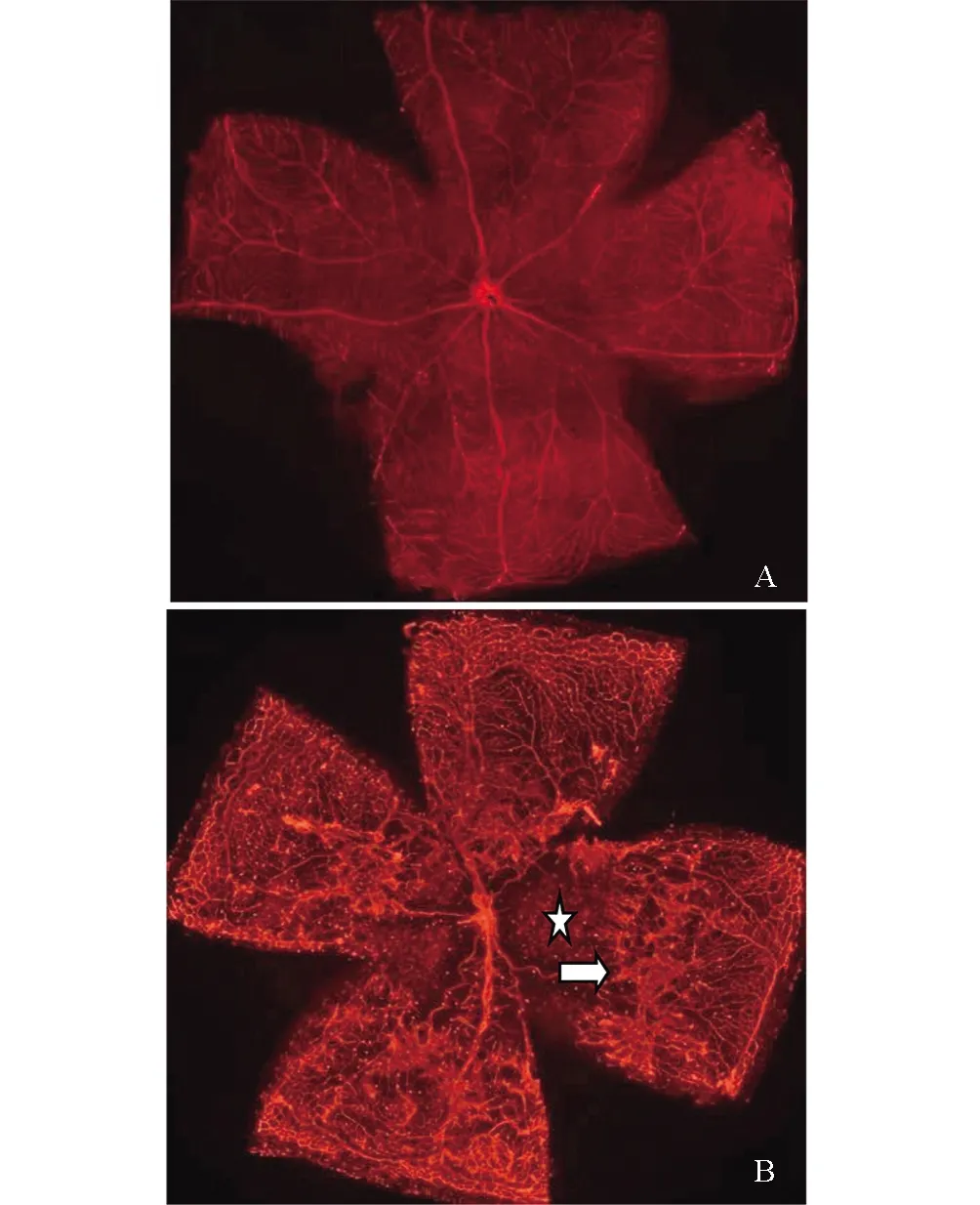
图1 OIR模型鼠视网膜铺片A:正常鼠视网膜血管分布呈均匀的网状结构;B:模型鼠视网膜中央区可见大片无灌注区(☆所示),大血管迂曲扩张,视网膜中周边部有大量新生血管(箭头所示)
2.2 视网膜组织中EPO mRNA表达的动态变化
为了探讨OIR模型鼠视网膜新生血管发生过程中,EPO mRNA表达变化的动态趋势。我们选取出氧舱后0天(P12)、半天(P12.5)、1天(P13)、一天半(P13.5)、2天(P14)、5天(P17,此时视网膜新生血管形成数目最多)、1周(P19)及2周(P26,此时视网膜新生血管已完全消退)等8个时间点的视网膜组织,采用RT-PCR技术来检测OIR模型鼠视网膜组织中EPO mRNA的表达水平。视网膜组织中EPO mRNA表达水平如图2A所示:EPO mRNA扩增产物大小为165bp,β-actin扩增产物大小564bp。图2B为图3A相对应的电泳条带中EPO与内参照β-actin mRNA扩增产物的灰度相对比值。结果表明:出氧舱后半天(P12.5)视网膜组织中EPO mRNA表达开始升高。随着视网膜组织中缺血、缺氧的加重,出氧舱后2天(P14)视网膜组织中EPO mRNA表达到达高峰,与P12天模型鼠视网膜组织中EPO mRNA表达水平比较有统计学差异(P<0.05)。出氧舱后5天的模型鼠,此时视网膜新生血管形成数目最多,视网膜组织EPO mRNA表达仍维持在较高水平,但较P14天时EPO mRNA表达水平已有所下降。出氧舱后2周的模型鼠视网膜新生血管已完全消退,此时网膜组织EPO mRNA表达明显下调,与P12天EPO mRNA表达水平比较无统计学差异(P>0.05)。
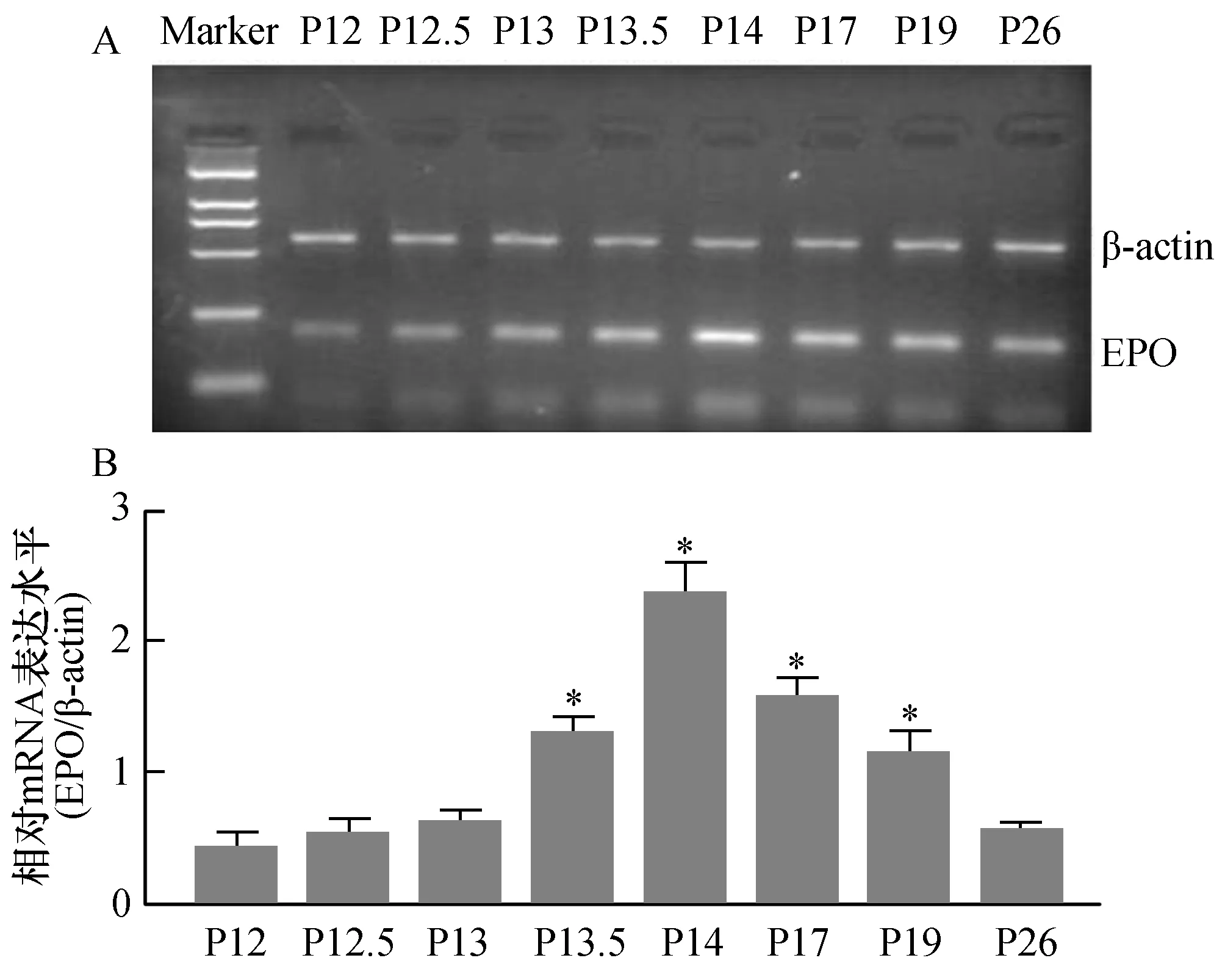
图2 OIR模型鼠视网膜新生血管形成中EPO mRNA的表达A:RT-PCR法检测不同时间点OIR模型鼠视网膜组织中EPO mRNA表达电泳图;B:各泳道EPO与内参照β-actin mRNA扩增产物的灰度相对比值,与P12模型鼠视网膜组织中EPO mRNA表达水平比较,*P<0.05
2.3 OIR模型鼠视网膜组织中EPO蛋白质表达的动态变化
为探讨OIR模型鼠视网膜新生血管形成中EPO蛋白质表达变化的动态趋势,我们取P12、P12.5、P13、P13.5、P14、P17、P19及P26天的OIR模型鼠视网膜组织,运用Western blot技术来检测模型鼠视网膜组织中EPO蛋白质的表达水平(如图3)。图3B为图3A相对应的电泳条带中EPO与内参照β-actin蛋白条带的灰度相对比值。与视网膜组织中EPO mRNA表达变化趋势相一致,随着模型鼠视网膜组织中缺血、缺氧状态的出现,视网膜组织中EPO蛋白表达于出氧舱后半天(P12.5)开始升高,于出氧舱后2天(P14)视网膜组织中EPO蛋白表达到达高峰,与P12天模型鼠视网膜组织中EPO蛋白表达水平比较有统计学差异(P<0.05)。然后缓慢开始下降,出氧舱后2周时视网膜组织中EPO蛋白表达水平已明显下调,与P12天模型鼠视网膜组织中EPO蛋白表达水平比较无统计学差异(P>0.05)。
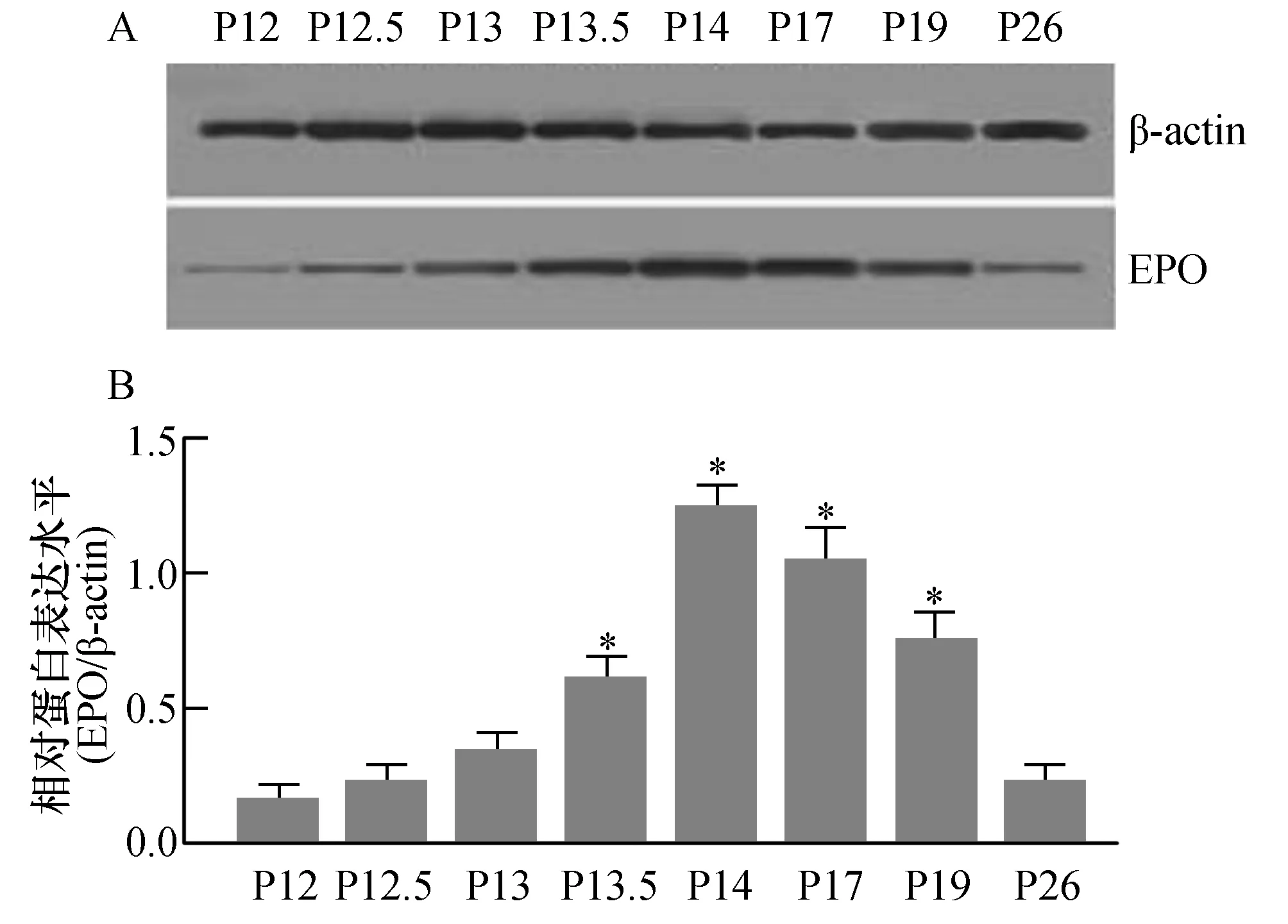
图3 OIR模型鼠视网膜新生血管形成中EPO蛋白质的表达A:Western blot技术检测不同时间点OIR模型鼠视网膜组织中EPO蛋白表达电泳图;B:各泳道EPO与内参照β-actin蛋白条带的灰度相对比值,与P12模型鼠视网膜组织中EPO蛋白质表达水平比较,*P<0.05
3 讨 论
VEGF被认为是视网膜新生血管关键性的因子,抗VEGF药物在临床上展现出对于视网膜血管新生性疾病的良好疗效[6]。近年来,有文献报道,EPO在体外促进血管内皮细胞增生、迁移和成管作用与VEGF相当[7]。另外,EPO可以上调细胞基质金属蛋白酶2(matrixm-etalloproteinases2,MMP2)表达,破坏毛细血管基底膜,协助血管内皮细胞迁移,促进新生血管的形成[8]。在体实验显示,EPO可诱导鸡卵囊胚形成新生血管,其作用与VEGF相当[8]。这说明,EPO还参与体内生理及病理性新生血管血管形成过程。在创伤修复过程中,给予重组的EPO可通过增加创面微血管生成密度,改善创面血流灌注缩短愈合时间。EPO还参与肿瘤新生血管的形成。中枢神经系统肿瘤、乳腺癌、胃癌的肿瘤细胞和毛细血管内皮细胞都发现了EPOR的表达,且EPO的表达水平与肿瘤血管形成和病情进展密切相关,给予EPO拮抗剂可以通过减少肿瘤血管形成而抑制肿瘤生长[9]。由此可见,EPO是一种重要的促血管生成因子,在视网膜新生血管形成中起重要的调控作用。
视网膜新生血管关系最为密切的病理改变是缺血、缺氧[10-11]。缺氧的视网膜组织内HIF-1α蛋白降解受到抑制,HIF-1α蛋白在细胞内沉积与HIF-1β蛋白二聚化形成HIF-1复合物[12]。HIF-1复合物作为转录因子能与启动子上游含有低氧反应元件(Hypoxia response element,HRE)的靶基因相结合,与协同转录激活因子CBP/p300共同促进下游靶基因的转录。HIF-1的靶基因中包括血管内皮细胞生长因子及受体、诱导性一氧化氮合酶、内皮素-1、表皮生长因子[13]、血小板源性生长因子-B[14]等促进血管生成的因子,它们在血管生成过程的不同环节发挥着作用。而促红细胞生成素基因中含有低氧反应元件HRE[15]。本研究表明,氧诱导的增殖性视网膜病变模型小鼠出现视网膜新生血管形成,视网膜组织出现缺血缺氧状态,并于缺氧后12小时EPO表达逐渐增高,缺氧后48小时到达高峰并维持在较高的水平。视网膜组织合成并分泌的EPO蛋白质能通过在视网膜内扩散最终与视网膜血管内皮细胞上的EPO受体结合,通过细胞内信号传导途径引起血管内皮细胞增生、迁移、视网膜毛细血管出芽,参与诱导视网膜新生血管的形成。同时我们还发现,随着视网膜组织内新生血管的出现及缺血、缺氧状态的改善,视网膜组织中EPO表达逐步下调,在视网膜新生血管消退期,视网膜组织中EPO的表达水平逐步恢复到基线水平。由此可见,EPO表达水平的改变与视网膜新生血管的形成具有时间上的对应关系。这种现象的最好解释是缺血缺氧的视网膜组织通过HIF-1从转录水平上调EPO的表达,EPO通过促新生血管形成作用与VEGF等因子协同诱导视网膜新生血管的形成。
综上所述,EPO参与了氧诱导的增殖性视网膜病变模型鼠视网膜新生血管的形成,针对EPO的治疗可能为临床视网膜新生血管性疾病开辟新的治疗途径。

