免疫介导再生障碍性贫血小鼠模型制备条件的实验比较研究
张梓倩,李姝仪,袁继巧,杨 慧,范燕楠,白金叶,马 培,林明宝,侯 琦
(中国医学科学院北京协和医学院药物研究所,北京 100050)
再生障碍性贫血(aplastic anemia,AA)是由物理、生物、化学或其它未明原因所致的一种严重血液系统疾病,以骨髓造血功能衰竭致全血细胞减少为特征,临床主要表现为贫血、出血和感染,严重时可危及生命,目前尚无理想治愈方法[1-2]。因此,采用动物模型研究AA的病理病机、筛选更为有效的药物,对临床治疗至关重要。常用的AA动物模型包括钴-60照射联合免疫细胞静脉注射的免疫损伤模型和5-氟尿嘧啶联合白消安、苯联合环磷酰胺等化学诱导剂诱导的化学损伤模型[3-6]。其中,免疫损伤模型因更接近于临床病人的发病机制而被广泛应用。
然而,追溯免疫介导AA模型建立的早期中外文献,使用的均是♀小鼠[5,7],而后也有许多研究使用了♂小鼠[8-10],但两者在造模中的区别却鲜有报道,给研究者在动物性别选择时造成了困惑。此外不同实验报道的钴-60照射剂量在1.0~6.0 Gy之间不等[8-12]、检测时间点在造模第7~28 d不等[8-12],有限淋巴节细胞的获得也加大了实验难度,且动物实验存在批间波动性,如何确定适宜的指标检测时间、保证实验数据质量也是研究者关注的问题。
针对以上问题,本文在以往研究基础之上,对免疫介导小鼠AA模型制备过程中的♀♂差异、照射剂量、细胞注射类型、主要检测指标随造模时间的动态变化等造模条件进行了比较研究,以期为AA治疗药物的筛选评价与机制研究提供更为有效、稳定可控的模型制备方法。
1 材料
1.1 实验动物DBA/2小鼠,♂,SPF级,(20±2)g;BALB/c小鼠,♀♂兼用,SPF级,(20±2)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京) 2016-0006。
1.2 试剂EDTA-2K(分析纯,国药集团化学试剂有限公司,批号20160229),Thiazole Orange(Sigma-Aldrich,货号390062,批号MKCB0268V),RPMI 1640培养基(HyClone,货号SH30809.01,批号AE24464298),环孢素软胶囊(中美华东制药有限公司)。
1.3 仪器五分类血细胞分析仪(BC-5000vet,深圳迈瑞生物医疗电子股份有限公司);流式细胞仪(2060R,ACEA Biosciences)。
2 方法
2.1 不同照射剂量对模型的影响无菌取DBA/2小鼠胸腺、脾脏,分别加1640培养基进行研磨过滤,制备单细胞悬液,脾细胞用红细胞裂解液裂解红细胞,配成胸腺-脾细胞2 ∶1的混合淋巴细胞悬液。BALB/c♂小鼠随机平均分为正常组和模型组。模型组小鼠分别经5.6、5.7、5.8、6.0 Gy照射剂量的钴-60 γ射线全身照射,4 h内由尾静脉输入DBA/2小鼠混合淋巴细胞悬液每只0.2 mL,细胞量为1×106个。正常组注射等体积溶媒。造模d 15目内眦静脉丛取血50 μL,EDTA-2K抗凝,血细胞分析仪进行外周血全血细胞计数,Thiazole Orange 染色30 min,流式细胞仪检测阳性染色细胞比例。
2.2 性别差异、细胞注射类型、指标检测时间对模型的影响实验造模方法同“2.1”,淋巴结细胞取自腋窝、腹股沟、肠系膜等处,制备单细胞悬液。照射剂量为5.8 Gy。实验动物分为正常组、胸腺-脾细胞2 ∶1混合注射模型组(模型1)、淋巴结-胸腺细胞2 ∶1混合注射模型组(模型2),每组♀♂各半,连续4周目内眦静脉丛取血,检测外周血全血细胞计数和网织红细胞比例,方法同“2.1”,同时记录并统计生存率。
2.3 环孢素对模型的验证造模方法同“2.1”,照射剂量为5.8 Gy。实验设正常组、模型组和环孢素给药组。环孢素自造模d 1开始灌胃给药,10 mg·kg-1,连续给药14 d。造模d 15,小鼠目内眦静脉丛取血后处死,检测外周血全血细胞计数和网织红细胞比例,取小鼠一侧股骨进行HE染色,检测组织病理学与有核细胞计数。
3 结果
3.1 不同照射剂量对模型的影响如Tab 1所示,胸腺-脾混合细胞注射的♂小鼠接受5.6~6.0 Gy剂量的钴-60照射,均可在造模第二周检测到白细胞、红细胞和血小板的明显下降,但5.6、5.7 Gy照射组的小鼠网织红已恢复至高于正常组,5.8、6.0 Gy照射组网织红仍明显低于正常组。各照射剂量组(5.6、5.7、5.8、6.0 Gy)小鼠生存率依次为94.1、83.3、87.5、66.7%。
Tab 1 Effects of different irradiation doses on peripheral blood of AA mice n=6~15)
3.2 性别差异、细胞注射类型、指标检测时间对模型的影响与正常组相比 (Tab 2),5.8 Gy钴-60照射后,各模型组小鼠外周血红细胞数、血红蛋白含量和红细胞压积自造模第一周起逐步下降,在第二、三周下降作用明显,其中模型2组红细胞值低于模型1组;♀小鼠红细胞值低于♂小鼠,且在模型2组中差异有统计学意义。除模型2组♀小鼠外,各组红细胞值于第四周开始恢复。
Tab 2 Effects of different modeling factors on peripheral blood erythrocytes of AA mice n=5~10)
与正常组相比 (Tab 3),钴-60照射后,各模型组小鼠外周血白细胞总数在造模4周内下降作用明显。其中模型2组白细胞值低于模型1组;♀小鼠白细胞值低于♂小鼠,在造模第四周时,模型2组♀小鼠恢复较慢,雌雄差异有统计学意义。在时间动态上,白细胞总数及五分类(淋巴细胞、单核细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)自造模第一周开始下降,第二周降至最低,第三周开始回升。
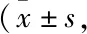
Tab 3 Effects of different modeling factors on peripheral blood leukocytes of AA mice n=5~10)
与正常组相比 (Tab 4),在造模4周内,各模型组小鼠外周血血小板数、血小板压积均明显下降。其中模型2组♀小鼠各项指标下降最为严重,与♂相比在造模第2~4周内差异明显。在时间动态上,血小板数、血小板压积自造模第一周开始下降,第二周降至最低,第三周开始回升。
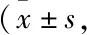
Tab 4 Effects of different modeling factors on peripheral blood platelet of AA mice n=5~10)
与正常组相比 (Tab 5),各模型组小鼠外周血网织红细胞比例与计数在造模第一周均明显下降,模型1组小鼠网织红比例与计数在第三周恢复至高于正常组;模型2组♂小鼠网织红比例在第三周恢复至接近正常组,但细胞计数仍明显低于正常组,♀小鼠网织红比例与计数在第三周均明显低于正常组,第四周时细胞计数仍未恢复至正常水平,表明该组的损伤程度最为严重,且模型2组具有雌雄差异。
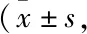
Tab 5 Effects of different modeling factors on peripheral blood reticulocytes of AA mice n=5~10)
实验结果表明,模型1组小鼠生存率较高,♂小鼠为87.5%,♀小鼠为90.9%;模型2组小鼠生存率较低,♂小鼠为60.0%,♀小鼠为50.0%。
3.3 环孢素对模型的验证根据以上结果,最佳造模条件为5.80 Gy钴-60 γ射线照射联合胸腺-脾细胞2 ∶1静脉注射,造模第二周进行指标检测。我们采用AA临床用药环孢素对模型有效性进行了验证[13],结果如Tab 6,7和Fig 1所示,环孢素对模型小鼠外周血白细胞、血小板、网织红细胞的降低有明显恢复作用,并可减轻骨髓造血细胞减少、脂肪细胞增加等病理形态改变,增加骨髓有核细胞数量,明显升高有核细胞/红细胞比例。结果表明,该造模条件可造成小鼠全血细胞减少和骨髓造血功能下降,临床用药环孢素对贫血症状与骨髓造血均有一定程度改善作用,表明该模型可用于抗AA药物的筛选与评价。
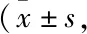
Tab 6 Effects of cyclosporine on peripheral blood of AA mice n=10~12)
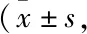
Tab 7 Effects of cyclosporine on bone marrow cells of AA mice n=6)

Fig 1 Effects of cyclosporine on bone marrow morphology of AA mice (HE staining,×200)
4 讨论
动物模型造模难点在于动物损伤严重程度的控制:损伤过轻,模型恢复过快,模型与正常组的各项考察指标不易产生显著性差异;损伤过重,动物濒于死亡,则药效不能有效呈现。指标测定时间的选择对实验的成败也至关重要,由于不同指标的改变与恢复时序不同,选择不同的测定时间点也会影响实验数据的质量。因此考察并了解实验过程中不同条件因素对模型制备的影响、掌握不同检测指标在疾病进程中的动态变化规律,有利于实验人员在药效评价与机制研究中对实验过程进行有效控制,提高实验效率以及实验数据质量。
因此,本研究针对免疫介导AA模型制备条件的潜在影响因素进行了实验比较研究。实验结果显示,♀♂小鼠均可在免疫细胞静脉注射后诱发全血细胞减少与网织红细胞下降,但♀小鼠的贫血症状比♂小鼠严重,且在淋巴结-胸腺细胞注射模型(模型2)中差异显著,表明♂小鼠对免疫介导的损伤更为耐受,可能与♂小鼠体内雄激素的保护作用有关[14]。在进行新药研发时,由于需同时使用两种性别的动物对药物疗效进行全面考察,获取雌雄差异的数据,因此在进行实验时应注意雌雄动物模型在损伤程度上的差异性对药效的影响。
免疫细胞注射类型的对比实验结果显示,两种细胞混合方式均可导致全血细胞减少与网织红细胞水平下降,进一步实验表明,胸腺-脾脏混合细胞模型小鼠的血象、骨髓象均可发生明显改变,与临床AA的主要症状一致,临床用药环孢素在一定程度上可改善以上病理状态,表明该模型也可用于抗AA药物的筛选与评价。两种模型的区别在于,在造模严重程度方面,淋巴结-胸腺混合细胞对小鼠的损伤程度强于胸腺-脾脏混合细胞,在♀小鼠的降红方面更具优势;在实验操作方面,由于淋巴节细胞数量小、摘取过程繁琐,采用胸腺-脾脏混合细胞进行替代更为便捷、易操作,有利于多组别大样本量药效学实验的高效进行;在♀♂差异方面,淋巴结-胸腺混合细胞模型的♀♂差异较大,胸腺-脾脏混合细胞模型的差异不明显,对于在药效上具有♀♂差异的药物,应用胸腺-脾脏混合细胞模型则药效雌雄差异更易体现。
不同检测指标随造模时间的动态变化趋势存在差异。网织红细胞是分化未成熟的红细胞,可反映骨髓红系造血功能[15],网织红细胞比例与计数在造模后快速下降,并快速恢复,是本次实验中最为敏感的指标,由于模型较轻时恢复较快,应注意把握测定时间。血小板与白细胞总数在造模后迅速下降,但恢复期晚于网织红,且恢复速度缓慢,直至第四周仍显著低于正常组。红细胞在造模后下降程度最小且下降速度最缓慢,也是最晚恢复的指标,但早于血小板和白细胞恢复至正常水平。
综上所述,性别、免疫细胞类别、照射剂量均是影响造模程度的重要因素,本研究结果提示:免疫介导AA的最佳造模条件为♂小鼠5.80 Gy钴-60 γ射线照射联合胸腺-脾细胞2:1静脉注射,造模后第二周进行指标检测。但是,不同实验室可根据本实验室的具体情况与实验目的选择适当的模型条件,通过选择雌雄、免疫细胞类别与注射量、照射剂量等因素有效调节模型的损伤程度。综合各指标的变换趋势,造模后二至三周应为指标测定的较适宜时间。药效呈现的最佳时间是在模型发展期、最严重期、还是恢复期,可能尚需结合不同药物的自身特性进行具体研究,从而有效控制药效实验过程,为高效、低毒、经济的AA治疗药物的研发提供保证。