骨髓间充质干细胞旁分泌对成骨细胞生物学活性的影响
王广阔,张秀智,王韦丹,曹放,赵德伟*
(1.大连大学附属中山医院骨科医学研究中心,辽宁 大连 116001;2.大连大学附属中山医院生殖医学中心,辽宁 大连 116001;3.大连理工大学生物医学工程,辽宁 大连 116024)
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)具有归巢能力,可被趋化迁移至损伤部位,分化为损伤部位组织成分,促进组织修复与重建[1-3]。因此,BMSCs是再生医学中最重要的种子细胞来源。BMSCs具有成骨分化能力[4],BMSCs移植可被用于骨坏死、骨缺损等骨组织修复的治疗中[5-6]。学者发现,BMSCs可旁分泌多种细胞因子,其中包括胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、转化生长因子-β1(Transforming growth factor-β1,TG-β1)、肝细胞生长因子(hepatocyte growth factor,HGF)等[7]。这些因子能加快组织细胞的迁移分化,促进组织血管的早期修复重建[8]。在骨组织损伤中,IGF-1、TGF-β1、VEGF等因子被发现具有影响成骨细胞活性的作用[9-10]。BMSCs可能通过旁分泌这些细胞因子参与了调节骨重建和血管生成过程来促进骨损伤的愈合,但目前BMSCs旁分泌在骨组织修复中的作用与机制尚未报道。因此,本研究采用transwell对BMSCs与MG63进行非接触性共培养,排除BMSCs成骨分化作用的影响,单纯地观察BMSCs旁分泌对成骨细胞生物学特性的影响,进而为BMSCs移植在骨缺损及骨坏死中的应用提供新的理论依据。
1 资料与方法
1.1 实验材料 培养基DMEM/F12(HyClone)、胎牛血清(Gibco)、胰酶、磷酸盐缓冲盐溶液(phosphate buffered saline,PBS)(HyClone)、青链霉素混合液(索莱宝)、茜素红粉末(Sigma)、碱性磷酸酶试剂盒(碧云天)、Transwell小室(Corning)、引物(Takara)。
1.2 原代细胞的提取与培养 采用梯度离心法获取BMSCs,取2 mL分离液置于15 mL离心管内,将1 mL抗凝血液样本与生理盐水1∶1比例混合,沿管壁缓慢打入离心管。此时血液样本在分离液上层。配平后以400 g~800 g离心20~30 min。此时离心管由上至下分四层:(1)血浆层含血小板层;(2)乳白色淋巴细胞层;(3)透明分离液层;(4)红细胞层。收集细胞于离心管中,加入DMEM/F12(HyClone)培养基至5 mL,配平后500 g离心20 min。弃上清,在DMEM/F12(HyClone)培养基、37℃、5%CO2的条件下培养。类成骨细胞我们选用MG63,在DMEM/F12(HyClone)培养基、37℃、5% CO2的条件下培养。
1.3 实验分组 基于Transwell(Corning 3414):6孔板,直径24 mm,孔隙3.0 μm。实验分两组,共培养组:上室为BMSCs,下室为MG63细胞。对照组:上、下室均为MG63细胞。每组实验重复3次,各组细胞按1∶1比例培养,培养条件:DMEM/F12(HyClone)培养基、37℃、5%CO2培养箱。迁移实验重新分组,基于Transwell(Corning 3422):24孔板,直径6.5 mm,孔隙8.0 μm。共培养组:上室为MG63,下室为BMSCs细胞。对照组:上、下室均为MG63细胞。
1.4 迁移实验 基于Transwell(Corning 3422):24孔板,直径6.5 mm,孔隙8.0 μm。共培养组:上室为MG63,下室为BMSCs细胞。对照组:上、下室均为MG63细胞。细胞培养3 d后,取出漏膜并用棉球将膜上细胞擦去,多聚甲醛固定6 min,0.1%结晶紫染色10 min,用水清洗漏膜3遍。显微镜下观察膜下细胞,100倍镜下随机取3个视野细胞做计数,对三组均值行统计学分析。
1.5 划痕实验 MG63等量分别接种于6孔板,培养至细胞铺满瓶底,弃上清液后PBS清洗1次,使用10 μL移液管尖端用力在板底面均匀划出直线,PBS清洗3次。对照组、共培养组上层接种细胞与下层近1∶1比例培养,用无血清培养基孵育24 h,使用倒置显微镜观测划痕区域中的运动细胞并计数,做统计学分析。
1.6 细胞周期检测 使用PI/RNase染色缓冲液来检测细胞周期。对照组、共培养组细胞培养2 d后,弃滤膜和上清液,消化离心,计数后用PBS再洗涤一遍,-20℃条件下,70%乙醇固定1 h。再用PBS洗涤2次,按说明书加入PI/RNase染色缓冲液(BD Biosciences,US)。37℃孵育15 min,用流式细胞仪分析。
1.7 茜素红染色 配制:0.1%茜素红染液(ddH2O配制),PH调制4.4。对照组、共培养组细胞培养14 d后,弃滤膜和上清液,板底面细胞PBS清洗2次,甲醇固定6 min,ddH2O清洗2遍,0.1%茜素红染液染色2 h,ddH2O再清洗2遍。加入2 mL PBS镜下观察。40倍镜下随机取3个视野,用image pro plus软件分析染色阳性面积占比后做统计学分析。
1.8 碱性磷酸酶染色 对照组、共培养组细胞培养14 d后,弃滤膜和上清液,板底面细胞PBS清洗2次,4%多聚甲醛固定10 min,ddH2O清洗2遍,按照碱性磷酸酶试剂盒(碧云天)说明书配置BCIP/NBT染色液,加入500μL BCIP/NBT染色液,室温避光孵育1 h,去除BCIP/NBT染色液,ddH2O清洗2遍。40倍镜下随机取3个视野,用image pro plus软件分析染色阳性面积占比后做统计学分析。
1.9 RT-qPCR检测 基质金属蛋白酶(matrix metalloproteinase,MMP)-2、MMP-9、OCN、OPN、Osterix、Runt相关转录因子2(Runt related transcription factor 2,RUNX2)基因的引物序列。对照组、共培养组在共培养环境下培养14d,丢弃transwell滤膜,弃上清液,并向两组细胞中加入Trizol试剂提总RNA,使用Hifair Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR(11141ES60)逆转录成cDNA,然后使用Hieff qPCR SYBR Green Master Mix (11201ES08)扩增目的基因。引物(MMP-2、MMP-9、OCN、OPN、Osterix、RUNX2和β-肌动蛋白基因)由Sangon Biotech(BBI,中国上海)制造(见表1)。使用β-肌动蛋白基因(β-Actin)作为内参。以β-Actin为标准,使用2-ΔΔCT方法计算mRNA表达水平,行统计学分析。所有样品重复3次。

表1 各基因引物序列
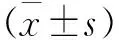
2 结 果
2.1 原代细胞的形态学观察与鉴定 经过梯度离心法获得原代BMSCs细胞,培养48 h后换液,3~4 d后可观察到少量散在分布的细胞,呈梭型贴壁生长;5~6 d后贴壁细胞呈集落样生长展开;8~9 d后可观察到培养瓶底部散在分布的大小不一的细胞集落,传代后细胞增殖活性加强,均匀分布在培养瓶底部,呈长梭型。传至第3代,采用流式细胞仪检测BMSCs表面标志物的表达,结果显示:CD34、CD45的阴性表达率分别为0.4%和0.5%,CD44、CD90的阳性表达率分别为99.9%和99.5%(见图1)。

图1 流式细胞仪检测BMSCs表面标志物的表达结果
2.2 迁移实验检测结果 采用Transwell(Corning 3422),成骨细胞可通过滤膜迁移。共培养环境下培养3 d后,固定染色并在显微镜下观察拍照。MG63/MG63为对照组,MG63/BMSCs为共培养组,通过观察从上室迁移到下室的成骨细胞数量来评估成骨细胞的迁移能力。结果显示:共培养环境下,共培养组膜下迁移细胞数量显著多于对照组,差异有统计学意义(P<0.05),说明BMSCs旁分泌促进了成骨细胞MG63的迁移(见图2~3)。

图2 迁移实验染色结果(结晶紫染色,×100) 图3 迁移实验统计学分析结果
2.3 划痕实验检测结果 对照组、共培养组孵育24 h显微镜下观察拍照。MG63/MG63为对照组,BMSCs/MG63为共培养组,通过观察24 h内运动到划痕区域的成骨细胞数量来评估成骨细胞的运动能力。结果显示:共培养环境下,共培养组成骨细胞的增殖运动能力明显高于对照组,差异有统计学意义(P<0.05),说明BMSCs旁分泌促进了成骨细胞MG63的增殖运动能力(见图4~5)。

图4 划痕实验结果(×100) 图5 划痕实验统计学分析结果
2.4 细胞周期检测结果 使用流式细胞仪分析对照组、共培养组成骨细胞的周期变化。MG63/MG63为对照组,BMSCs/MG63为共培养组,通过观察G0/G1期、S期、G2/M期的变化来评估成骨细胞的增殖能力。结果显示:共培养环境下,共培养组成骨细胞在G0/G1期的细胞比例明显低于对照组,差异有统计学意义(P<0.05)。共培养组成骨细胞在S期与G2/M期的细胞比例明显高于对照组,差异有统计学意义(P<0.05)。说明共培养环境下,共培养组成骨细胞的增殖能力较对照组有明显提高(见图6)。

图6 细胞周期检测结果
2.5 茜素红染色检测结果 在共培养环境下,将共培养组、对照组成骨细胞培养14 d后处理,并使用茜素红S染色后在显微镜下观察拍照。MG63/MG63为对照组,BMSCs/MG63为共培养组,通过观察成骨细胞细胞外基质的钙化面积来评估成骨细胞的矿化能力。结果显示:共培养环境下,共培养组成骨细胞细胞外基质的钙化面积较对照组明显增加,差异有统计学意义(P<0.05)。说明共培养环境下,BMSCs旁分泌促进了成骨细胞MG63的矿化能力(见图7~8)。

图7 茜素红染色结果(茜素红染色,×40) 图8 茜素红染色统计学分析结果
2.6 碱性磷酸酶染色检测结果 在共培养环境下,将共培养组、对照组成骨细胞培养14d后处理,并使用碱性磷酸酶试剂盒染色后在显微镜下观察拍照。MG63/MG63为对照组,BMSCs/MG63为共培养组,通过观察成骨细胞染色阳性面积来评估成骨细胞的碱性磷酸酶活性。结果显示:共培养组成骨细胞碱性磷酸酶活性较对照组明显增加,差异有统计学意义(P<0.05)。说明共培养环境下,BMSCs旁分泌提高了成骨细胞的碱性磷酸酶活性(见图9~10)。

图9 碱性磷酸酶染色结果(碱性磷酸酶染色,×40) 图10 碱性磷酸酶染色统计学分析结果
2.7 RT-qPCR检测结果 MG63/MG63为对照组,BMSCs/MG63为共培养组,通过观察成骨相关基因OCN、OPN、Osterix、RUNX2与迁移相关基因MMP-2、MMP-9的表达水平来评估BMSCs旁分泌对成骨细胞成骨活性的影响。结果显示,共培养组的MMP-2、MMP-9、OPN、Osterix、RUNX2基因表达量显著高于对照组(P<0.05),但共培养组的OCN基因表达量与对照组比较差异无统计学意义(P>0.05)。结果说明共培养环境下,BMSCs旁分泌上调了成骨细胞的MMP-2、MMP-9、OPN、Osterix、RUNX2等基因的表达(见图11)。

图11 RT-qPCR实验结果
3 讨 论
BMSCs具有成骨与成血管等多向分化潜能,因此BMSCs移植被应用于骨坏死与骨缺损的治疗中,并显示了良好的效果[5-6]。另一方面,BMSCs除具有多向分化潜能外,还具有旁分泌调节功能,BMSCs可旁分泌IGF-1、VEGF、TGF-β1、HGF等多种细胞因子[7],BMSCs旁分泌作用可能在骨修复与骨再生治疗中起到积极的作用。因此,本研究采用transwell法对BMSCs与类成骨细胞MG63行非接触性共培养,通过排除BMSCs成骨分化的影响,单纯观察BMSCs旁分泌对成骨细胞生物学活性的影响,从而完善BMSCs移植在骨坏死与骨缺损治疗中的应用理论基础。
为了验证BMSCs旁分泌的成骨诱导性,本实验采用了茜素红染色[11]、碱性磷酸酶染色[12]等实验技术。因为这些实验周期较长,传统使用条件培养基方法无法真实模拟旁分泌功能,所以实验采用了transwell非接触共培养方法模拟了BMSCs长期的旁分泌的过程[13]。Osterix、RUNX2、OPN是关键成骨分化标记物的基因[14],研究中我们发现BMSCs通过旁分泌上调了成骨细胞的成骨相关基因Osterix、RUNX2、OPN的表达,从而显著增强成骨细胞的成骨活性,而BMSCs旁分泌对OCN基因的表达无影响。细胞周期、碱性磷酸酶染色、茜素红染色实验结果也显示,BMSCs旁分泌提高了成骨细胞的增殖能力、早期成骨与成骨矿化能力。此外,成骨细胞趋化迁移到损伤部位,在损伤部位增殖、矿化是骨组织修复和再生的前提条件,MMP-2、MMP-9在成骨细胞的趋化和迁移中具有重要作用[15]。实验结果表明,BMSCs通过旁分泌上调了成骨细胞的迁移相关基因MMP-2、MMP-9的表达,从而显著提高成骨细胞的迁移运动能力。通过迁移实验、划痕实验表明,BMSCs旁分泌对成骨细胞具有趋化作用,并且BMSCs旁分泌能显著提高成骨细胞趋化迁移运动能力。
BMSCs成骨分化是骨组织修复与重建的途径之一,但BMSCs的成骨分化需要特定的微环境与较长的分化时间[16]。而BMSCs旁分泌可能在骨组织损伤的早期修复中具有更为重要的作用。BMSCs旁分泌调节过程起始快,促进各组织之间联合修复,是修复过程的早期动员和重要开始。因此,调控BMSCs旁分泌可以促进骨组织损伤早期修复,缩短修复与重建时间,将为临床早期治疗骨组织损伤提供新的思路。
综上所述,BMSCs旁分泌促进了成骨细胞的运动迁移、增殖分裂、钙化成骨能力。研究结果表明BMSCs除具有成骨分化能力外,还具有增强周围成骨细胞骨修复活性的旁分泌功能,为BMSCs移植在骨缺损及骨坏死中应用提供新的理论依据。

