持续牵张应力诱导肌腱干细胞向成骨细胞分化的作用机制研究
沈家亮,王琳,尚文强
(华北医疗健康集团峰峰总医院骨科,河北 邯郸 056201)
肌腱损伤是临床上常见的一种损伤,表现为肌腱的退行性改变,包括脂质沉积、蛋白糖积累和钙化等[1]。肌腱的组织结构复杂,其主要作用是将肌肉收缩转化为关节运动,将力量从肌肉传递到骨骼[2]。尽管经过多年的广泛研究,损伤后肌腱结构和功能的恢复仍然是骨科手术和运动医学中最大的挑战之一。大量研究已经在鼠类、兔及人类中发现一个新的肌腱细胞群,称为肌腱干细胞(tendon stem cells,TSCs)。TSCs作为一种成熟的干细胞,能够自我更新,并且在不同条件下可分化为肌腱细胞和非肌腱细胞(骨细胞、软骨细胞、脂肪细胞)[3]。同其他肌腱细胞一样,TSCs也能对施加在肌腱上的各种机械载荷做出反应。并且有研究证实,持续温和牵张应力刺激对体内肌腱修复可以起到显著地促进作用[4]。因此,施加牵张力刺激对于TSCs的作用及其在肌腱损伤治疗中的应用受到广泛关注,且随着相关研究的不断深入及干细胞治疗的兴起,均为肌腱病发病机制和治疗的研究提供了新思路和新方向。肌腱干细胞治疗肌腱损伤的机制:因为干细胞具有潜在的分化能力,而TSCs定向分化为成骨细胞能够对肌腱损伤的治疗起到较大地促进作用。因此,本研究通过对TSCs施加不同强度、持续与间断的牵张刺激来观察其对TSCs肌腱分化影响,为TSCs在肌腱损伤治疗中的应用提供基础数据及理论支撑。
1 资料与方法
1.1 大鼠肌腱干细胞的分离与培养 本研究取清洁级雄性8周龄SD大鼠10只,体重在150~200 g(购于北京维通利华实验动物技术有限公司)。在光照/黑暗为各12 h的恒温环境及自由进食饮水下适应性饲养1周,腹腔麻醉后进行原代肌腱干细胞的分离及培养[5]。所有细胞传代至3代后开展后续实验。
1.2 仪器与试剂 CO2培养箱(Sigma,美国),流式细胞仪(Muse,德国),7500Fast聚合酶链式反应(polymerase chain reaction,PCR)仪(Thermo,美国),Flexcell FX5000 Tension system(Flexcell,美国),倒置荧光显微镜(Nikon,日本),酶标仪(Molecular Device,美国),低速离心机(Thermo,美国),稳压电源(伯乐,美国),DMEM-F12(Dulbecco's modified eagle media-nutrient mixture F-12)培养液(Hyclone,中国),胎牛血清(Gicbo,澳洲),青霉素和链霉素双抗混合液(碧云天,中国),胰蛋白酶(Taraka,中国),细胞计数试剂(cell counting kit-8,CCK-8)(同仁,日本),cDNA逆转录试剂盒、SYBR Premix Ex TaqTM Ⅱ试剂盒(TaKaRa,中国),Trizol(BBI,中国),SOX2一抗、OCT4一抗(CST,德国),Runt相关转录因子2(Runt related transcription factor 2,RUNX2)一抗(Santa,美国),增强化学发光(enhanced chemiluminescence,ECL)显色液(诺唯赞,中国),二喹啉甲酸(bicinchoninic acid,BCA)检测试剂盒(碧云天,中国)。
1.3 方法
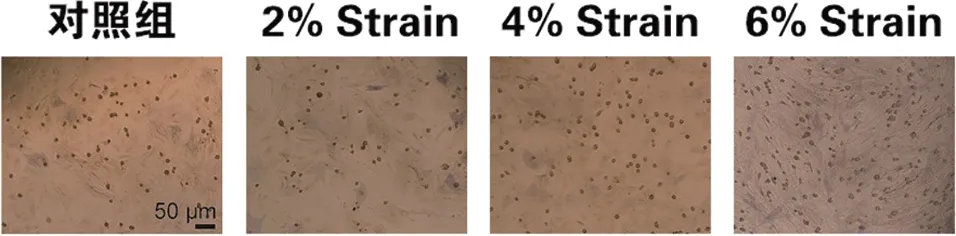
1.3.1 TSCs培养与处理 切除跟腱组织时避免残留周围软组织和腱鞘组织。将取下的肌腱组织称重,并剪碎成小块。每100 mg组织加入1 mL Ⅰ型胶原酶和中性蛋白酶后置于37℃培养箱中消化1 h,将消化液与组织碎块充分混匀。消化结束时加入1 mL磷酸盐缓冲液(phosphate buffered solution,PBS)吹打混匀。之后将混悬液在1 500 g/10 min条件下离心,倒掉上清液,使用含20%胎牛血清的细胞培养基进行吹打混匀,然后将细胞培养基混合液移入培养瓶中,加细胞培养基至10 mL,放入含5% CO2的37℃培养箱中培养。传至3代后应用Flexcell FX5000 Tension system进行牵张力处理,参考仪器说明书,将培养的细胞置入处理培养孔内,通过调节设置施加不同牵张力。根据不同牵张力设置四组[0(对照组)、2% Strain、4% Strain、6% Strain)]处理48h进行相关指标检测。
1.3.2 TSCs鉴定 本研究通过对表面标记物进行流式细胞仪分析方法进行干细胞鉴定,收集约1×107个3代细胞,1 500 r/min离心5 min后弃上清;Buffer液进行重悬,最后取100 mL细胞悬液加入1.5m LEP管内,按量加入CD90、CD44、CD34、CD106一抗后避光孵育30min,相同的离心条件离心后[5-6],加入300 mL Buffer进行细胞重悬,进样检测。
1.3.3 TSCs细胞活力检测 以2×107个/mL接种到Flexcell FX5000 Tension system专用6孔板后处理48h后,以CCK-8法检测细胞活力。每孔中加入相应体积的溶液,混匀后在37℃、5% CO2培养箱内继续培养3h,之后于酶标仪450nm波长处测吸光度(optical density,OD)值。计算细胞相对活力=(实验组OD值/对照组OD值)×100%,并进行3次独立重复实验。
1.3.4 mRNA表达情况检测 运用Trziol对各处理组进行总RNA提取后,根据逆转录试剂盒反应说明进行cDNA合成。用SYBR®Premix Ex TaqTM Ⅱ试剂盒于Applied Biosystems 7500 Fast PCR仪上进行逆转录聚合酶链式反应(reverse transcriotion-polymerase chain reaction,RT-PCR)检测。检测干细胞多能性基因SOX2、OCT4的相对表达量及成骨基因RUNX2、DLX5及COL1a的相对表达量。引物均由上海生工生物进行合成,β-action为内参基因,引物序列见表1。

表1 荧光定量PCR引物序列
1.3.5 免疫印迹(Western-blot,WB)法对相关蛋白表达进行检测 按照蛋白提取试剂盒说明书提取蛋白,用BCA法测定蛋白浓度,用WB法测定β-actin(内参)、OCT4、SOX2、RUNX2蛋白表达情况。

b ALP染色细胞活性
1.4 碱性磷酸酶(alkaline phosphatase,ALP)染色 本研究在牵张力处理后,采用ALP试剂盒(索莱宝,中国)进行各组细胞染色。所有染色步骤均按照试剂盒操作进行,采用ALP活性进行数据统计分析。
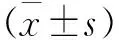

a 干细胞克隆样生长 b 鹅卵石样排列
2 结 果
2.1 TSCs镜下大体形态及细胞鉴定 原代提取大鼠TSCs进行培养第5天时,有部分细胞已经开始贴壁,形态较为清晰,但没有聚集生长成为克隆样,细胞生长较为缓慢。但继续培养至10 d时,细胞生长速度加快,细胞成鹅卵石样的排列在瓶底,并且在培养瓶中可见克隆集落形成(见图1)。
流式细胞术对TSCs细胞表面抗原鉴定的结果进一步显示大鼠跟腱来源的TSCs具有明确的干细胞特性。超过(97.32±4.58)%和(90.13±5.27)%的细胞干细胞表面标记物CD90、CD44呈阳性表达,而CD34(0.37±0.09)%、CD106(0.58±0.14)%的表达很低,呈阴性(见图2)。

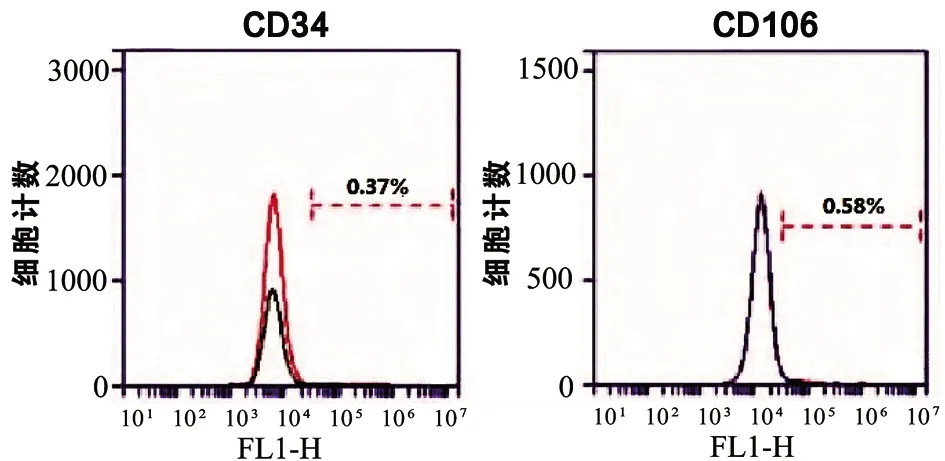
图2 TSCs细胞表面标记物流式细胞检测情况
2.2 不同牵张力处理TSCs后细胞相对活力情况 通过CCK-8法检测后,各牵张力处理组均出现细胞相对活力呈上升的趋势,但仅在牵张力为6% Strain时的细胞活力与对照组比较有统计学差异(P<0.05),而其余各组的升高并没有统计学意义(P>0.05,见图3)。

注:*与对照组比较,P<0.05
2.3 不同牵张力处理TSCs后对干性维持基因及蛋白的影响 与对照组相比,2% Strian牵张力组的TSCs细胞SOX2基因表达开始出现下降,但结果没有统计学差异(P>0.05),当牵张力达到4% Strain后,SOX2基因表达出现明显下降(P<0.05,见图4)。对于OCT4基因,在6% Strain牵张力处理后其表达出现明显下降(P<0.05,见图4)。
与对照组相比,6% Strain组OCT4、SOX2蛋白表达量均明显低于对照组(P<0.05),在4% Strain组时两者的相对表达量有所降低,但无统计学意义(P>0.05),其他牵张力处理组变化也不明显(见图5)。
2.4 不同牵张力处理TSCs后对成骨基因及蛋白的影响 与对照组相比,RUNX2基因在各组均有不同程度升高的现象,但仅2% Strain组和6% Strain组升高具有统计学意义(P<0.05)。DLX5基因各组均有升高,但差异无统计学意义(P>0.05)。而在COL1a仅在6% Strain组升高具有统计学意义(P<0.05,见图6)。

注:*与对照组SOX2比较,P<0.05;**与对照组OCT4比较,P<0.05

注:*与对照组SOX2比较,P<0.05;**与对照组OCT4比较,P<0.05

注:*与对照组RUNX2比较,P<0.05;**与对照组COL1a比较,P<0.05
本研究对处理48h后的TSCs的RUNX2生成量进行验证,与对照组比较,在2% Strain和4% Strain组其生成量均有升高,但结果无统计学意义(P>0.05),仅在6% Strain组显著升高,差异具有统计学意义(P<0.05,见图7)。

注:*与对照组比较,P<0.05
a ALP染色结果(ALP染色,×200)
2.5 不同牵张力处理TSCs后对成骨染色的影响 为进一步探讨牵张力对TSCs成骨的影响,我们通过ALP染色进行鉴定。与对照组比较,ALP染色活性在牵张力为4%和6%时出现显著升高,差异具有统计学意义(P<0.05,见图8)。
3 讨 论
肌腱损伤是临床上常见的一种损伤,修复后常常发生肌腱黏连或关节僵硬导致严重的功能障碍,尤其对于肌腱缺损的患者采用自体或异体肌腱移植后黏连更加明显,因此对肌腱损伤及肌腱缺损的治疗,多年来一直是骨科的一大难题[7]。由于肌腱将肌肉力量传递到骨骼以使身体运动而起着至关重要的作用,因此它们经常承受机械载荷。由于肌腱是生物组织,其通过改变其新陈代谢来响应机械负荷,并且随着时间的流逝,这种机械生物学反应会导致其结构和机械特性发生变化[8-12]。因此,了解TSCs如何对机械负荷做出反应非常有意义。
有研究显示,适度的牵张力刺激有助于TSCs的分化,并可增强TSCs向成骨细胞分化[13]。而Wang等[4]的研究也证明持续温和牵张应力刺激可显著促进体内肌腱的修复。成骨细胞是骨形成的主要功能细胞,负责骨基质的合成、分泌和矿化。人类及动物体骨组织不断地进行着重建,骨重建过程包括骨的分解吸收与新骨的形成[14]。因此,了解TSCs如何对机械负荷做出反应非常有意义。深入探讨适度的牵张力作用TSCs对肌腱损伤的治疗及恢复至关重要。
本研究成功从大鼠跟腱组织中提取及分离出TSCs,流式细胞术结果显示所提TSCs质量及纯度相对较高,符合开展深入研究的前提条件。通过CCK-8对不同牵张力作用于TSCs后对细胞相对活力的影响结果分析,各处理组均有增高的趋势,但仅当牵张力为6% Strain时增高具有统计学意义(P<0.05)。这一部分结果显示,适度温和的牵张力作用有助于TSCs的生长,因此有益于肌腱损伤的治疗。
在对干性维持基因的研究中发现,SOX2基因在4% Strain时出现下降,且SOX2蛋白在6% Strain处理组下降具有统计学意义(P<0.05)。而OCT4基因仅在6% Strain处理组下降具有统计学意义(P<0.05),但蛋白并没有出现显著变化。这结果同前期部分研究相一致[15]。SOX2和OCT4的表达水平能够对TSCs多能性的维持产生直接影响[16]。OCT4和SOX2既能维持细胞的自我更新,同时又能抑制分化基因的表达,维持TSCs的多能性,如果其表达量降低,TSCs则会趋于分化生长[17]。因此,本研究可以看出适度的牵张力可以加速诱导TSCs的分化进程,而其加速分化能够有效缩短肌腱损伤患者的康复时间[3]。
本研究在验证温和的牵张力能够诱导TSCs分化后进一步对其向成骨细胞分化进行探讨。选择三种重要的成骨基因RUNX2、DLX5及COL1a进行检测[18]。结果显示,RUNX2基因在各组均有不同程度升高的现象,但仅2% Strain组和6% Strain组升高有统计学意义(P<0.05)。而在COL1a仅在6% Strain组升高有统计学意义(P<0.05)。因此,本研究进一步对RUNX2蛋白进行检测发现在6% Strain组显著升高,差异有统计学意义(P<0.05)。这一结果同我国学者刘祥舟等[19]的研究相同,其通过8% Strain处理后发现成骨基因的RUNX2基因及蛋白表达水平均出现显著增高。此外有国外学者也对该强度能够增加RUNX2表达量进行了报道[20]。本研究在低于前人研究的基础上进一步对其进行佐证。在成骨细胞中,RUNX2能促进早期分化,能促进软骨细胞成熟和血管侵入软骨,并且抑制脂肪细胞的形成,其下游的IHH基因是重要的软骨形成调节因子[21]。此外,我们通过ALP染色进一步验证了其对成骨分化的诱导作用。因此,RUNX2在肌腱损伤康复中扮演着重要角色。
综上所述,本研究结果发现,适度温和的牵张力有助于TSCs的细胞增殖,并且通过寻找适度的牵张力大小可以加速诱导TSCs的分化并具有加速其向成骨细胞分化的能力。因此,未来的肌腱损伤治疗中,我们可以选择适度温和的牵张作用治疗肌腱损伤患者,有助于肌腱病的治疗及康复。

