单增李斯特菌谷氧还蛋白Grx负调控渗透转运系统OpuC转录
李 康,徐加利,孙 静,宋厚辉,程昌勇
(1.浙江农林大学 动物科技学院/动物医学院 浙江省畜禽绿色生态健康养殖应用技术研究重点实验室 动物健康互联网检测技术浙江省工程实验室,浙江 杭州 311300)
单核细胞增多性李斯特菌(Listeriamonocytogenes,LM)是一种革兰阳性菌,同时也是一种食源性病原菌[1],广泛分布在环境中,易污染经加工的即食、冷藏肉类和乳制品等高风险食品[2]。LM易感染免疫低下的人群,可导致孕妇出现流产,新生儿出现脑膜炎,老年人出现致命菌血症[1,3]。
LM在入侵宿主的过程中为了免受宿主免疫系统的清除,会使用多种具有抗氧化应激功能的蛋白(一些小相对分子质量的化合物和酶)[4]。目前已报道LM中含有2套巯基依赖性氧化还原系统,一个是硫氧还蛋白(thioredoxin,Trx)系统[5],另一个是谷氧还蛋白(glutaredoxin,Grx)系统[6]。Grx系统由NADPH、谷胱甘肽还原酶(GR)、谷胱甘肽(GSH)和谷氧还蛋白(Grx)组成[7]。GSH是一种低相对分子质量的硫醇,并且在细菌许多的生物活动进程中有重要作用[7]。Grx可以利用GSH通过其自身两种截然不同但在功能上互相联系的反应机制(即谷胱甘肽化和去谷胱甘肽化机制)还原目标蛋白的二硫键,以此来调节和维持细胞内的氧化还原稳态[8]。Grx具有硫氧还蛋白超家族特有的活性位点氨基酸基序Cys-XX-Cys,可以特异性的催化蛋白质硫醇与GSSG/GSH之间可逆的硫醇-二硫键交换反应,可以保护蛋白质硫醇免受不可逆的氧化作用,并且是细胞信号传导和维持胞内氧化还原稳态的至关重要的氧化还原酶[9]。此外,LM毒力调控因子PrfA可以通过与GSH结合被激活[10-12]。本实验室前期研究发现grx缺失株在氧化剂肼(diamide)应激条件下的抗氧化胁迫能力显著增强,在小鼠肝和脾组织中的定植能力也增强[6]。在4 mmol/L diamide应激条件下的转录组测序结果中,筛选出了与氧化应激相关的渗透转运系统相关基因opuCA、opuCB、opuCC、opuCD。
LM中存在3个渗透转运蛋白(Gbu、OpuC、BetL),受到外界刺激后能大量表达并摄取环境中的相容性溶质(甘氨酸、甜菜碱和肉碱),参与细菌抗渗透压胁迫[13-14]。OpuC渗透转运系统分别由opuCA/B/C/D基因编码的ATP结合蛋白OpuCA、跨膜蛋白OpuCB、胞外底物结合蛋白OpuCC和跨膜蛋白OpuCD组成,主要负责转运相容性溶质肉碱[15]。
本研究将通过荧光定量PCR和绿色荧光蛋白报告系统来探究Grx与渗透转运系统OpuC之间的调控关系,为后续进一步探索Grx是否参与调控渗透转运系统提高LM的抗氧化应激能力奠定基础。
1 材料与方法
1.1 质粒、菌株及培养条件LM野生株EGD-e、大肠杆菌DH5α、温度敏感型穿梭质粒pKSV7、整合型质粒pAM401和荧光蛋白质粒pFL251,均来自本实验室冷冻库;LM培养于BHI(Brain Heart Infusion)培养基,大肠杆菌DH5α培养于LB(Luria-Bertani)培养基。
1.2 主要试剂BHI(Brain Heart Infusion)培养基购自OXOID公司;限制性核酸内切酶购自NEB公司;PCR Master Mix-Blue、ReverTra Ace qPCR RT Kit和 Ligation high Ver.2.0购自TOYOBO公司;GoldView染料购自北京艾德莱生物科技有限公司;质粒快速提取试剂盒购自上海惠凌生物技术有限公司;GEL/PCR Purification Kit购自FAVORGEN公司;TRIzol Reagent试剂购自Thermo Fisher公司;柱式细菌总RNA提取试剂盒购自上海生工生物工程公司。
1.3 引物本试验所用引物均由杭州有康生物科技有限公司合成,详见表1。
1.4grx缺失株重组质粒的构建和筛选以LM标准菌株EGD-e基因组(GenBank序列号为NC_003210.1)为模板,下载谷氧还蛋白基因grx(lmo2344)前后共5个基因序列,并通过生物信息学网站www.biocyc.org查询基因grx前后基因的启动子区域并选取上下游同源臂,使用Snapgene软件在开放阅读框两侧分别设计引物Δgrx-up-EcoRⅠ-fwd/Δgrx-up-rev和Δgrx-down-fwd/Δgrx-down-PstⅠ-rev扩增上下游同源臂。将上下游片段通过Overlap PCR方法连接获得目的片段,双酶切目的片段和载体质粒pKSV7,随后使用DNA连接酶将酶切回收后的质粒和片段进行连接,将连接产物热转至大肠杆菌DH5α感受态中,随后挑选单菌落进行PCR验证,将疑似正确的阳性转化子送往杭州有康生物科技有限公司进行测序验证。测序成功的菌株进行重组质粒抽提,并将grx缺失株命名为pSL1618,构建路径如图1所示。

表1 本试验所用引物信息

图1 grx缺失株重组质粒pSL1618构建路径
1.5grx缺失株的构建和筛选制备LM EGD-e感受态细胞,并将已构建好的grx缺失株重组质粒pSL1618取1.5 μg电转至LM EGD-e感受态。将菌液涂布至含有10 mg/L氯霉素的BHI固体平板上,挑选单菌落进行PCR鉴定。PCR验证结果正确,随后接种阳性单克隆至BHI液体培养基,42℃振荡培养箱连续传代至PCR鉴定同源臂双交换整合至EGD-e基因组,完成同源重组后挑选阳性单克隆在不含抗生素的BHI液体培养基中30℃振荡摇床内连续传代至质粒消除,并使用引物Δgrx-a-front/Δgrx-down-PstⅠ-rev进行PCR鉴定。
1.6 荧光定量PCR检测OpuC渗透转运系统基因转录表达水平采用实时荧光定量PCR对opuC在野生株EGD-e和Δgrx中的转录水平进行检测,验证转录组数据的可靠性。从NCBI基因数据库中下载基因opuCA/B/C/D和内参基因16S rRNA (lmor01)的序列,根据荧光定量PCR引物设计规则使用Primer3Plus网站设计基因opuCA/B/C/D定量引物(表1)。根据柱式细菌总RNA抽提试剂盒说明书对野生株EGD-e和Δgrx进行总RNA提取,随后使用ReverTra Ace qPCR RT Kit将抽提的RNA进行反转录和荧光定量试验[6],收集试验数据并使用GraphPad Prism软件进行结果分析。
1.7 绿色荧光蛋白(GFP)报告基因重组质粒的构建和筛选通过生物信息学网站www.biocyc.org查询得知基因opuCA/B/C/D共用1个启动子,以EGD-e为模板,选取约300 bp作为基因opuCA/B/C/D启动子。通过Snapgene软件设计引物PopuC+GFP-a-BamHⅠ-fwd/PopuC+GFP-b-rev扩增基因启动子,以pFL251为模板用引物PopuC+GFP-c-fwd/PopuC+GFP-d-SalⅠ-rev扩增gfp3序列。将启动子和gfp3序列通过Overlap PCR方法连接,双酶切目的片段和载体质粒pAM401,随后使用DNA连接酶将酶切回收后的质粒和片段进行连接。将连接产物热转至大肠杆菌DH5α感受态中,随后挑选单菌落进行PCR验证。将疑似正确的阳性转化子送往杭州有康生物科技有限公司进行测序验证。测序成功的菌株进行重组质粒抽提,并将opuC荧光报告基因的重组质粒命名为pSL2511,构建路径如图2所示。
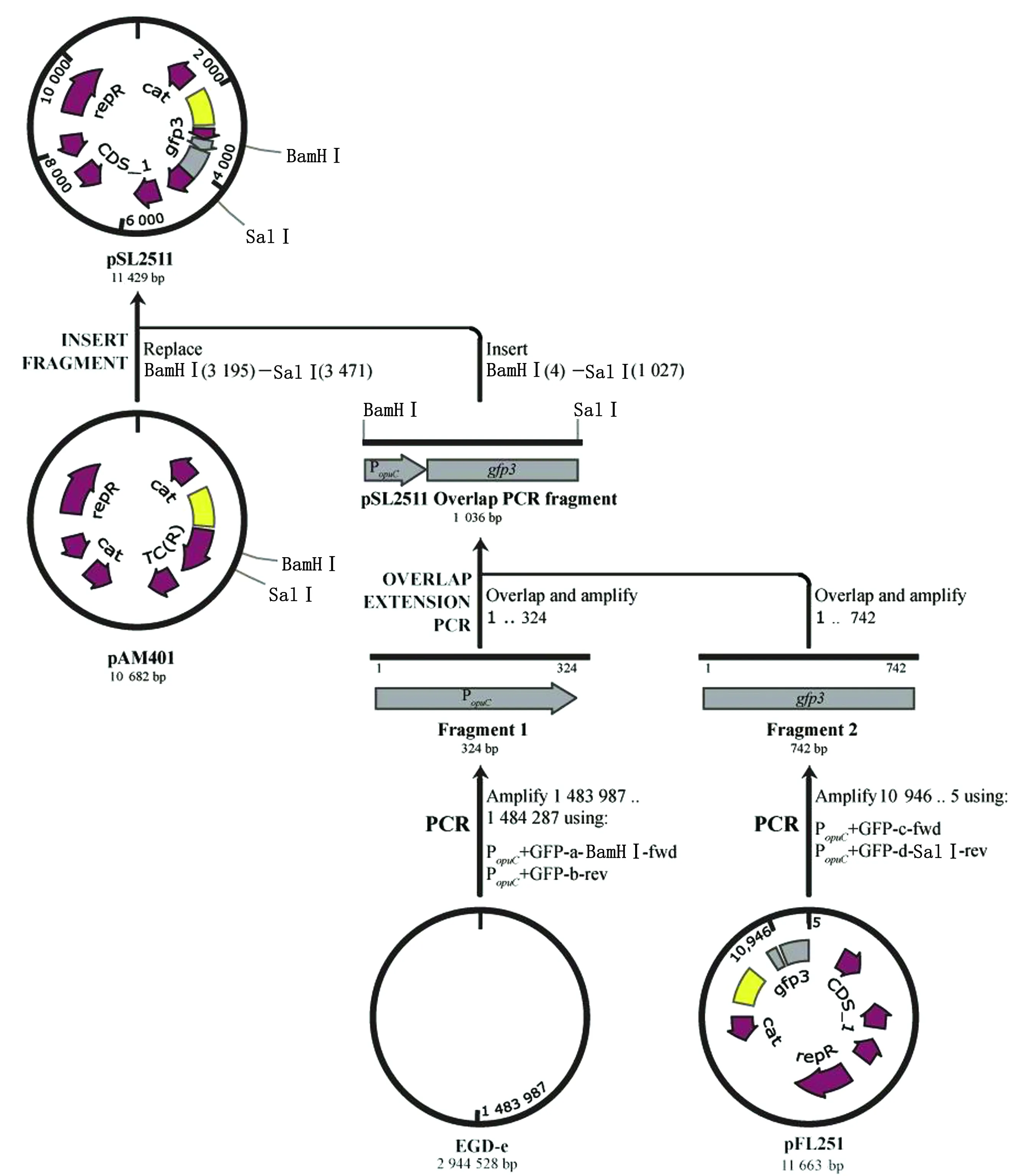
图2 opuC荧光报告基因重组质粒pSL2511的构建路径
1.8 GFP报告系统检测OpuC渗透转运系统基因转录表达水平将pSL2511重组质粒分别电转化到野生株EGD-e和Δgrx,获得携带gfp3报告基因菌株。通过检测绿色荧光的释放量来评价opuC基因转录水平,荧光强度越大转录水平越高,反之则转录表达水平越低。挑选含有gfp3荧光报告基因的EGD-e和Δgrx单克隆菌落至5 mL BHI液体培养基中过夜培养。收集菌体,使用10 mmol/L PBS调整菌液D600值至0.6左右。取10 μLD600值0.6的菌液滴于无菌载玻片正中央,将无菌盖玻片从一侧缓慢放下,封片固定待观察。另取200 μLD600值0.6 的菌液至96孔板中,使用多功能酶标仪测量菌液的荧光释放强度(Em/Ex=535/485 nm),收集数据用Graphpad Prism软件进行结果分析,选取菌株相应标本片,使用荧光显微镜进行观察并拍照。
2 结果
2.1 成功构建grx缺失株PCR试验结果如图3A所示,上、下游同源臂片段分别526,494 bp,与预期结果一致;通过Overlap PCR扩增出约为995 bp (图3B)的目的片段,与预期结果一致。经酶连产物热转后,进行菌落PCR及测序验证,测序结果显示插入片段为Overlap PCR扩增得到的目的片段,表明grx缺失株重组质粒pSL1618构建成功。将重组质粒pSL1618电转至LM EGD-e感受态中,42℃连续连续传13代后,通过引物Δgrx-a-front/Δgrx-down-PstⅠ-rev进行PCR扩增得到约1 120 bp片段(图3C),说明发生同源重组。30℃连续传代后,用引物Δgrx-a-front/Δgrx-down-PstⅠ-rev扩增菌落条带为1 120 bp,而以野生株EGD-e为模板扩增出约1 348 bp片段;随后利用pKSV7质粒通用引物M13-fwd/M13-rev进行验证,菌落无条带则说明pKSV7质粒已丢掉。将此菌株送往杭州有康生物科技有限公司测序验证,测序结果正确,表明grx缺失株构建成功,命名为Δgrx。
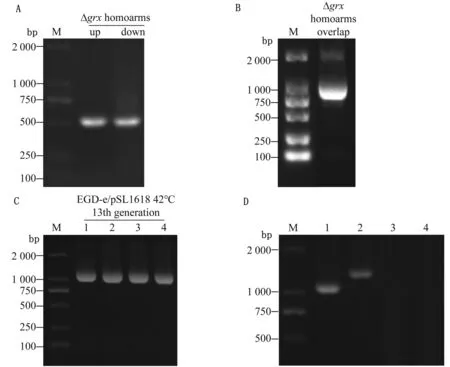
A.上下游同源臂片段PCR扩增产物;B.Overlap PCR扩增产物;C.PCR验证Δgrx源臂重组情况(1~4.EGD-e/pSL1618);D.PCR验证grx基因缺失情况( 1.Δgrx;2.EGD-e;3.ddH2O;4.Δgrx利用引物M13-fwd/M13-rev进行PCR产物扩增)。M.DL2000 DNA Marker
2.2 Grx负调控渗透转运蛋白基因opuC的表达水平通过分析qRT-PCR数据,发现Δgrx在4 mmol/L diamide应激条件下,渗透转运系统相关基因opuCA/B/C/D转录表达水平相较于野生株EGD-e,分别上升60.58,50.69,72.26,71.26倍(图4),与前期转录组数据结果趋势一致。
试验结果发现opuCA/B/C/D基因的启动子与gfp3融合的重组质粒在Δgrx中释放的荧光量相较于野生株EGD-e显著增强(图5A);Δgrx中报告基因的荧光释放强度是野生株EGD-e的4.23倍(图5B)。以上结果表明:grx缺失导致LMopuCA/B/C/D基因转录水平上调,grx与opuC基因启动子之间存在负调控关系。
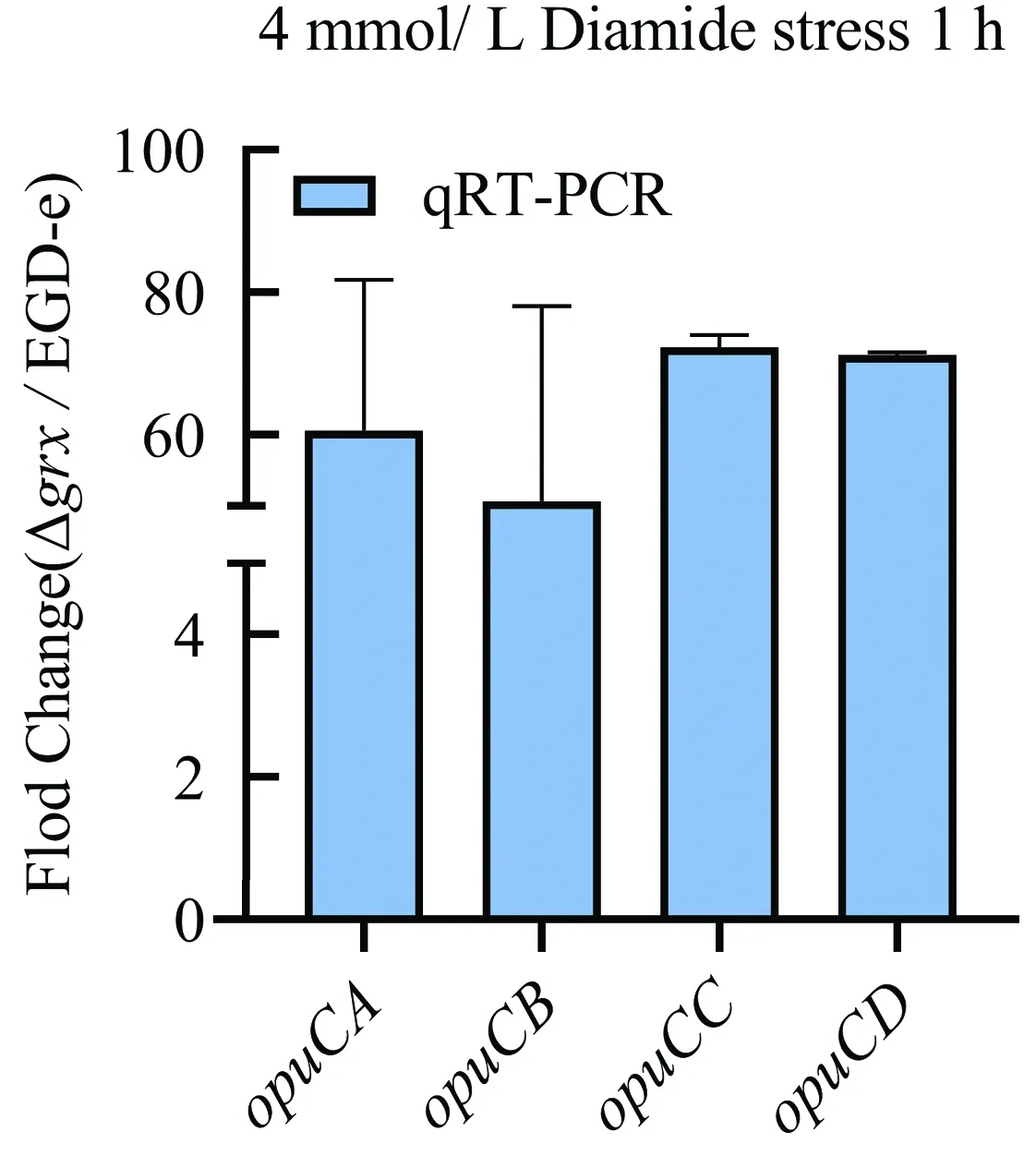
图4 实时荧光定量PCR检测opuC/A/B/C/D基因的转录表达水平
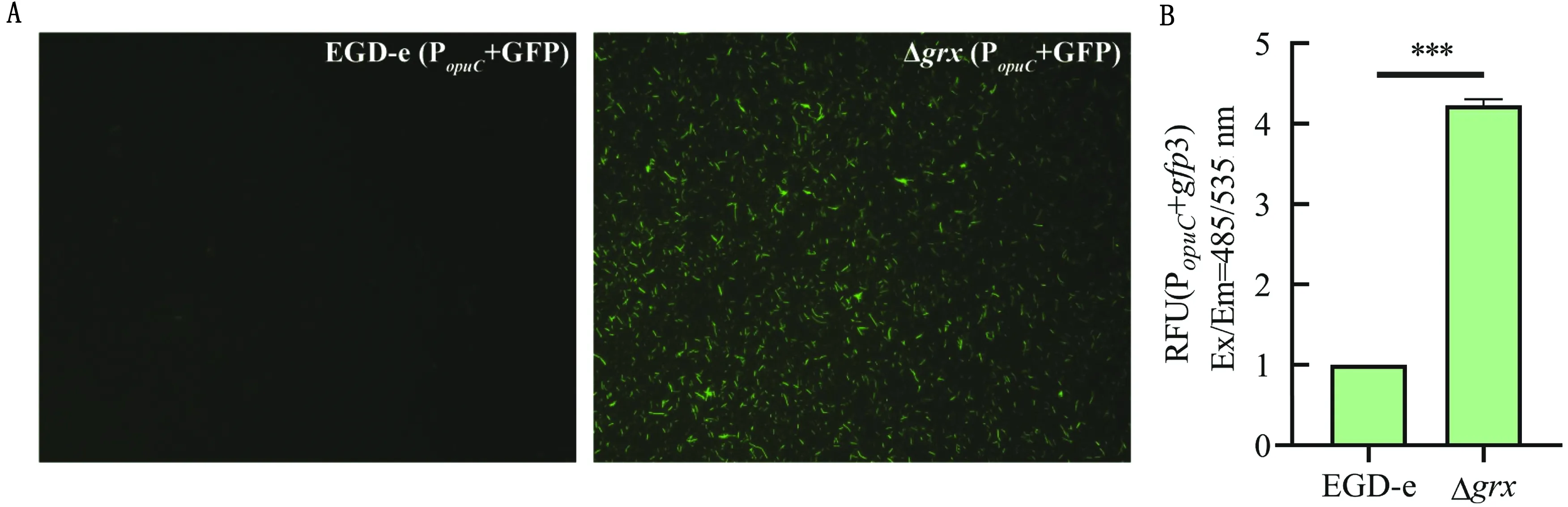
A.荧光显微镜下观察;B.多功能酶标仪检测结果(***.P=0.000 2)
3 讨论
肉碱作为有机相容性溶质,对于李斯特菌的渗透压保护至关重要。将LM渗透转运系统相关基因opuCA/B/C/D敲除后,突变株摄取肉碱、甘氨酸和甜菜碱的能力均下降,但是摄取相容性溶质的能力并没有完全丧失[13],而opuC突变株感染小鼠后,在小鼠肝和脾中的定殖能力相较于野生株分别减弱了20和3倍[13,16]。而敲除grx后,grx突变株相较于野生株的抗氧化能力和在小鼠脾和肝组织的定殖能力都显著增强[6]。本研究中荧光定量结果验证了转录组数据结果中筛选出的与氧化应激相关的渗透转运系统相关基因opuCA、opuCB、opuCC和opuCD,得出渗透转运系统相关基因opuCA/B/C/D转录表达水平相较于野生株EGD-e明显上调。此检测结果与前期转录组测序结果相一致,说明在氧化应激条件下,LM能够通过渗透转运系统OpuC的表达来摄取体外培养基中的相容性溶质,抵抗渗透压胁迫和氧化应激,使自身生存能力增强。
在金黄色葡萄球菌中,YhcR蛋白能够与opuC基因启动子序列结合,调控opuC参与ABC转运蛋白的合成[17]。在LM中敲除sigB基因后,sigB缺失株在添加有1 mmol/L肉碱和甜菜碱的基础培养基中,较野生株生长速率分别降低了2.5倍和20%;并且在高盐浓度环境下检测到opuCA基因的转录水平较野生株显著降低,表明opuC基因启动子是依赖转录调控因子sigB调控的[18]。有研究表明SigB在LM感染宿主期间可以调控opuC抵抗渗透压胁迫[19]。grx突变株在氧化剂肼的胁迫下,sigB转录表达水平较野生株下调3.55倍[6]。通过绿色荧光蛋白报告系统进一步证实转录组数据的可靠性,初步证明LM Grx与opuC启动子之间存在负调控关系。但是Grx与渗透转运系统相关基因opuCA/B/C/D之间的调控关系是直接负调控还是间接负调控?目前还没有得出结论,该过程涉及的相关分子机制还有待进一步的深入研究。

