绵羊源溶血性曼氏杆菌的分离、鉴定及其生物学特性分析
郜 敏,杨有文,杨发龙
(西南民族大学 生命科学与技术学院,四川 成都 610041)
溶血性曼氏杆菌(Mannheimiahaemolytica,MH)属于巴氏杆菌科曼氏杆菌属,为一种革兰阴性球杆菌。该病原是一种条件致病菌,常存在于反刍动物的上呼吸道中,当宿主因运输、环境变化等造成应激以及支原体或病毒感染而导致抵抗力下降时,即可侵袭宿主肺部引起严重的呼吸道疾病[1]。MH被认为是引起牛呼吸道疾病综合征(bovine respiratory disease complex,BRDC)的主要病原[2]。但近年来国内外的研究已表明,MH同时也是引起绵羊、山羊肺炎及其他野生小反刍动物肺炎的重要病原[3-4]。此外,该病原可导致羔羊的败血症和绵羊乳房炎等疾病。目前,由MH引起的疾病在全球范围内广泛流行,给养殖业造成巨大的经济损失[5-6]。
近年来,我国养羊业发展迅速,并迅速从传统放养向规模化圈养发展,但由于饲养环境变化以及管理不当等原因,呼吸道疾病频发,给养羊业发展带来威胁。其中,由MH引起的绵羊及山羊肺炎的病例屡见报道[7-8],但目前对于临床分离菌株的血清型及其他生物学特征研究甚少。
2018年以来,四川省凉山州某绵羊场持续发生以咳嗽、呼吸急促、流涕为特征的呼吸道传染病。为调查病原,本实验室通过特异性PCR对多种病原的感染情况进行分子检测,发现患病动物中MH感染极为普遍,是引起该羊场发生呼吸道疾病的主要病原。由于目前对绵羊源MH的生物等特征了解较少,本研究从该羊场分离MH,并对其血清学、药物敏感性及毒力因子等分子生物学特征进行研究。
1 材料与方法
1.1 主要试剂全血琼脂平板、胰蛋白胨大豆琼脂(TSA)和胰蛋白胨大豆肉汤(TSB)均购自青岛海博生物技术有限公司;马血清购自郑州佰安生物工程有限公司;PCR-Mix和DNA Marker 等均购自宝生物工程(大连)有限公司;胶回收试剂盒购自OMEGA公司;药敏片购自杭州微生物试剂有限公司;药敏试验质控菌株(大肠杆菌 ATCC25922)由西南民族大学动物医学院四川省高校重点实验室提供。
1.2 MH的分离从40只表现有咳嗽、流涕、呼吸困难等明显呼吸道症状的患羊鼻腔深部采集棉拭子,接种于全血琼脂平板。
将40个全血琼脂平板放置37℃恒温箱中培养18 h,挑取疑似单菌落划线接种于含5%马血清的TSA培养基中进行纯化。挑取纯化后的单菌落进行革兰染色镜检。挑取纯化的单菌落接种于2 mL含5%马血清的TSB培养液中进行增菌,37℃恒温振荡培养18 h。纯化后的增菌液用于基因组DNA提取以及PCR检测。
1.3 分离菌株基因组DNA提取及特异性PCR鉴定对疑似菌株进行纯培养后,用酚-氯仿方法提取基因组DNA,并以其为模板,采用文献[9]建立的MH特异性 PCR 方法进行扩增。引物序列为LKT-F(5′-GCAGGAGGTGATTATTAAAGTGG-3′)和LK-T-R(5′-CAGCAGTTATTGTCATACCTGAAC-3′),扩增长度约为207 bp。
1.4 分离菌株的生化鉴定将纯培养物按照常规方法接种于葡萄糖、麦芽糖、甘露醇等生化鉴定管中,置于37℃恒温培养箱中培养,观察其生化特性。
1.5 分离株的血清型鉴定采用KLIMA等[10]建立的MH A1、A2和A6血清型特异PCR方法,对MH血清型进行鉴定,引物序列如表1。

表1 MH血清分型引物序列
1.6 分离菌株毒力基因检测为了检测分离菌株携带的重要毒力因子,参考 KLIMA等[11]建立的特异性 PCR 方法,分别对gcp、gs60、tbpB、lktC、nmaA和adh等毒力基因进行扩增,引物信息见表2。

表2 MH主要毒力因子的引物序列
1.7 分离菌株对BALB/c小鼠的致病性从分离得到的19株MH分离株中,分别从属于A1和A2血清型的菌株中各选取1株,参考文献[2]对BALB/c小鼠进行半数致死量(LD50)的测定。
1.8 lktA基因扩增及序列分析本研究根据GenBank中提交的牛源、羊源MH相应基因序列,采用Primer 5.0软件设计引物。由于lktA基因全长CDS较大,为了保证获得有效扩增,设计3对引物,对其进行分段扩增,引物信息见表3。反应体系为20 μL,包括PCR-Mix 10 μL,上、下游引物各1 μL,DNA模板2 μL,ddH2O 6 μL。反应条件:95℃预变性 5 min;94℃变性 30 s,55℃ 退火 30 s,72℃延伸40 s,共35个循环;72℃总延伸10 min,16℃结束反应。PCR产物经1.5 %琼脂糖凝胶电泳分析,将目的条带切胶回收,送生工生物工程(上海)股份有限公司测序。
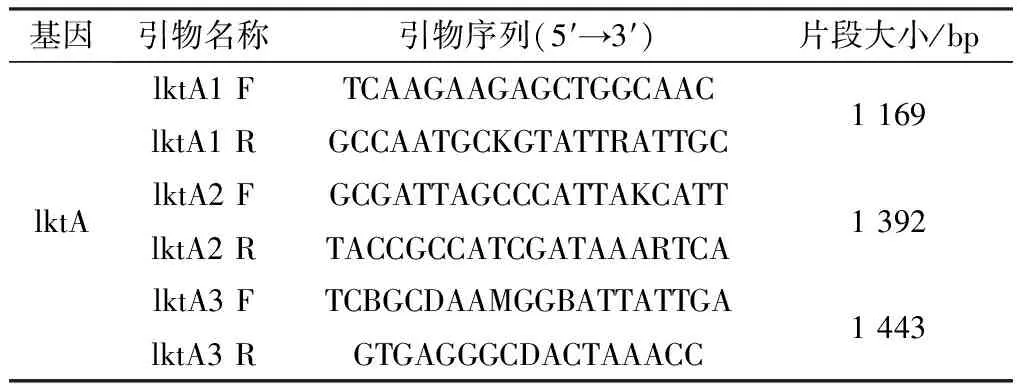
表3 lktA基因扩增引物
采用Lasergene的SeqMan软件对lktA基因的分段片段进行序列拼接获得完整的CDS。采用NCBI的BLAST 工具对上述19个分离株和不同血清型以及不同宿主来源的MH lktA基因的同源性进行分析,采用MAGA (Version7.0.26)软件构建进化树,并针对lktA基因分析其基因亚型与菌株的血清型和宿主来源之间的关系。
1.9 分离菌株的药物敏感性分析依据美国临床和实验室标准协会(CLSI)标准,采用K-B纸片法对19株MH 分离株进行药敏试验。挑取纯化后的单菌落接种于含5%马血清的TSB培养基中,37℃恒温振荡培养18 h。用 TSB 增菌液稀释菌体浓度至 1.5×108CFU/mL,吸取100 μL稀释好的菌液至含5%马血清TSA平板上,并用灭菌涂布棒均匀涂布,贴药敏片进行药敏试验。37℃恒温培养18 h后判定结果,药敏结果判定按NC-CLS 2012年标准记录进行。
2 结果
2.1 MH的分离及特异性PCR鉴定将采集自40只患病绵羊的鼻拭子接种于血琼脂平板,37℃培养18 h后,血平板上可见有β溶血单菌落,该菌落光滑、有光泽、呈中等大小的半透明状(图1)。经革兰染色镜检发现为两端钝圆的革兰阴性短杆菌(图2)。特异性PCR鉴定结果:分别从19只动物中分离获得19株MH,以S1~S19表示,部分菌株PCR检测结果见图3。

图1 MH分离菌株菌落形态
图2 MH分离菌株革兰染色结果 (10×100)
2.2 分离菌株生化鉴定结果将19株分离菌株的纯培养物接种于微量生化鉴定管内,结果显示:全部 19 株MH均发酵葡萄糖、麦芽糖、甘露醇和阿拉伯糖,不发酵脲酶、鼠李糖,其中 17 株发酵乳糖,16 株发酵蔗糖,14 株发酵木糖,符合MH的生化特性。重复 3 次,结果一致。
2.3 分离菌株的血清型鉴定采用MH血清型特异性PCR方法对19株分离株的血清型进行鉴定。结果,其中7株均为A1型,11株为A2型,剩余1株并未扩增出目的片段,为其他血清型。部分菌株血清型特异性PCR扩增结果如图4所示。
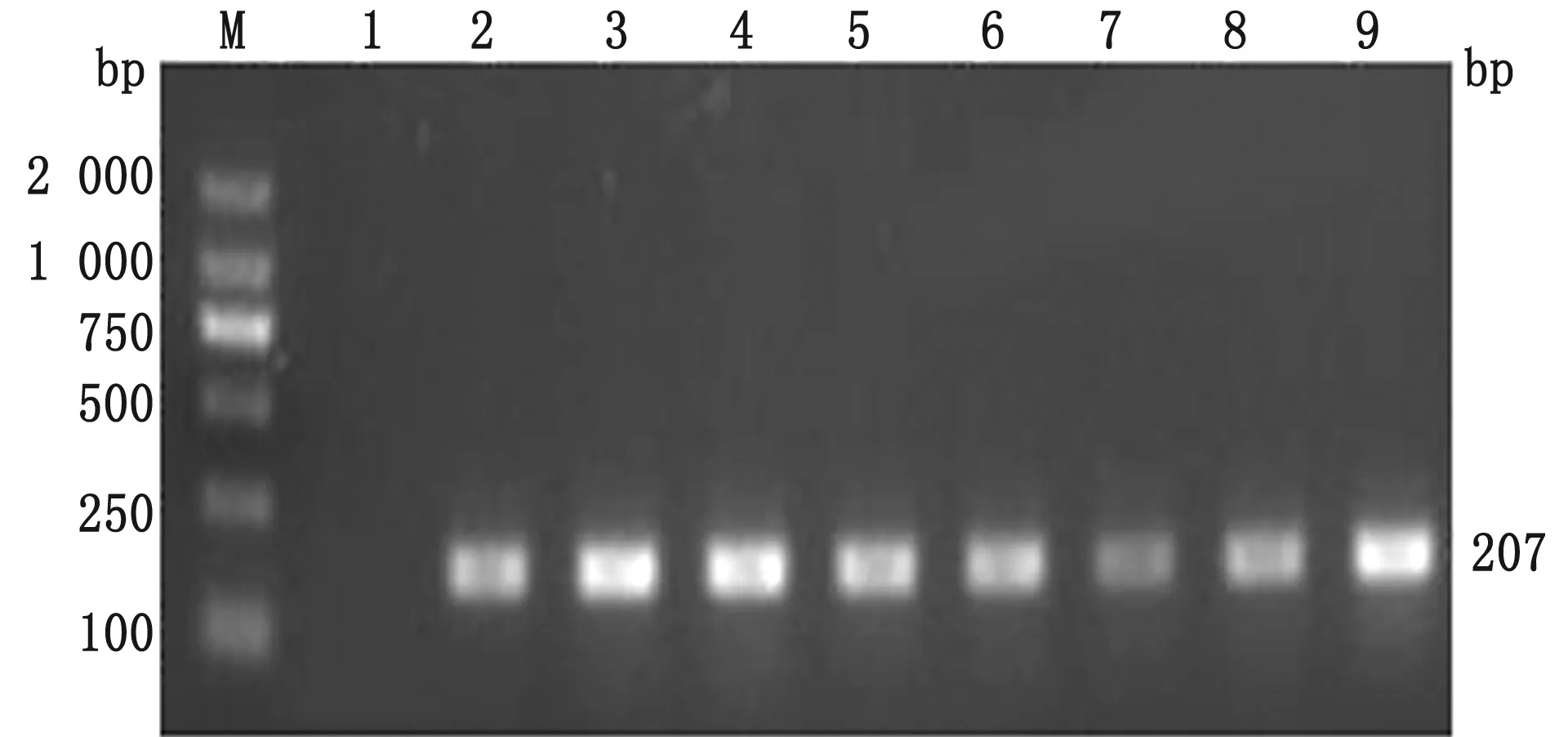
M. DL2000 DNA Marker;1.阴性对照;2~9.MH分离株
2.4 分离菌株的毒力基因鉴定对19株分离菌株的gcp、gs60、tbpB、lktC、nmaA和adh等毒力基因进行检测,结果表明gcp基因和lktC基因的阳性检出率所占比例最高,达 17/19,而gs60、tbpB、nmaA和adh基因的阳性率分别为12/19,8/19,0/19,8/19。根据血清型分析,血清 A1 型中gcp基因和lktC基因所占比例最高,达 7/7,其次是gs60,其检测率为 5/7,tbpB和adh基因检测率较低,为2/7;血清 A2 型中lktC基因所占比例最高,达 10/11,其次是gcp基因,其检测率为 9/11,gs60、tbpB和adh基因检测率较低,为6/11。其中有 1 株A2 型MH均携带5种毒力基因gcp、gs60、tbpB、lktC和adh,但19株分离菌株均不含有nmaA基因(表4)。

A.血清型A1扩增结果;B.血清型A2扩增结果。M.DL2000 DNA Marker;1.阴性对照;2~7.MH分离株
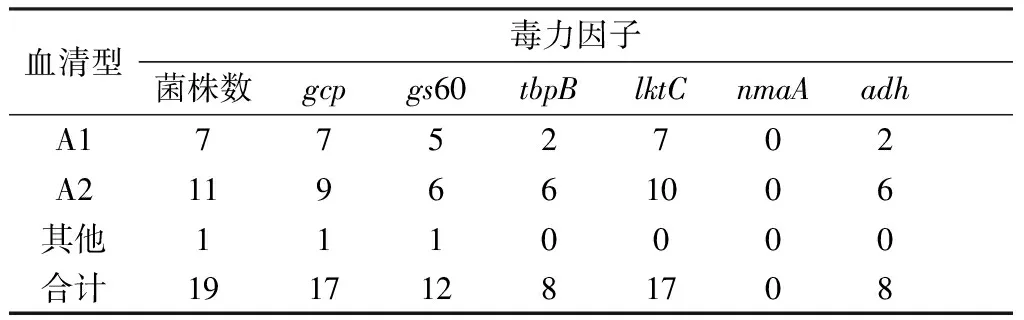
表4 19株MH分离株6种毒力基因的分布情况 株
2.5 LD50的测定结果攻毒后6 h,小鼠出现精神沉郁、被毛粗乱、畏寒扎堆。8 h 后小鼠陆续死亡,连续观察 24 h 记录死亡个数并计算 LD50。结果显示, S1 菌株的 LD50为1.34×107CFU/mL,S15 菌株的 LD50为 3.10×106CFU/mL,表明 S1 和S15 菌株对 BALB/c 小鼠均具有较强的致病性。
2.6 lktA基因的克隆和序列分析采用3对引物对分离株的lktA基因CDS全长进行分段扩增后进行拼接,结果3对引物从所有19株分离株中扩增获得大小分别约为1 169,1 392,1 443 bp片段,与预期相符(图5)。

A.lktA1引物扩增结果;B.lktA2引物扩增结果;C.lktA3 引物扩增结果;1~5.MH分离株;M.DL2000 DNA Marker
为了进一步分析19株分离株lktA基因的分子特征,本研究从GenBank中获取来自不同动物、不同血清型和文献中报道的代表不同lktA等位基因型的MH共20株的lktA基因序列,与MH同属的3株葡萄糖苷曼氏杆菌(Mannheimiaglucosidal)的lktA基因序列展开相关比较分析。结果显示,19株分离株中,分离株S1、S2、S3、S5、S15、S16属于lktA1型;分离株S6、S7、S17、S18属于lktA8型;分离株S4属于lktA6型。同时发现有5株分离株S8、S9、S10、S11、S12、S13、S19的lktA等位基因属于lktA4型(图6),此前,这一等位基因型被认为是葡萄糖苷曼氏杆菌所特有。此外,本研究中的分离株S14属于新的等位基因型,将其命名为lktA11。
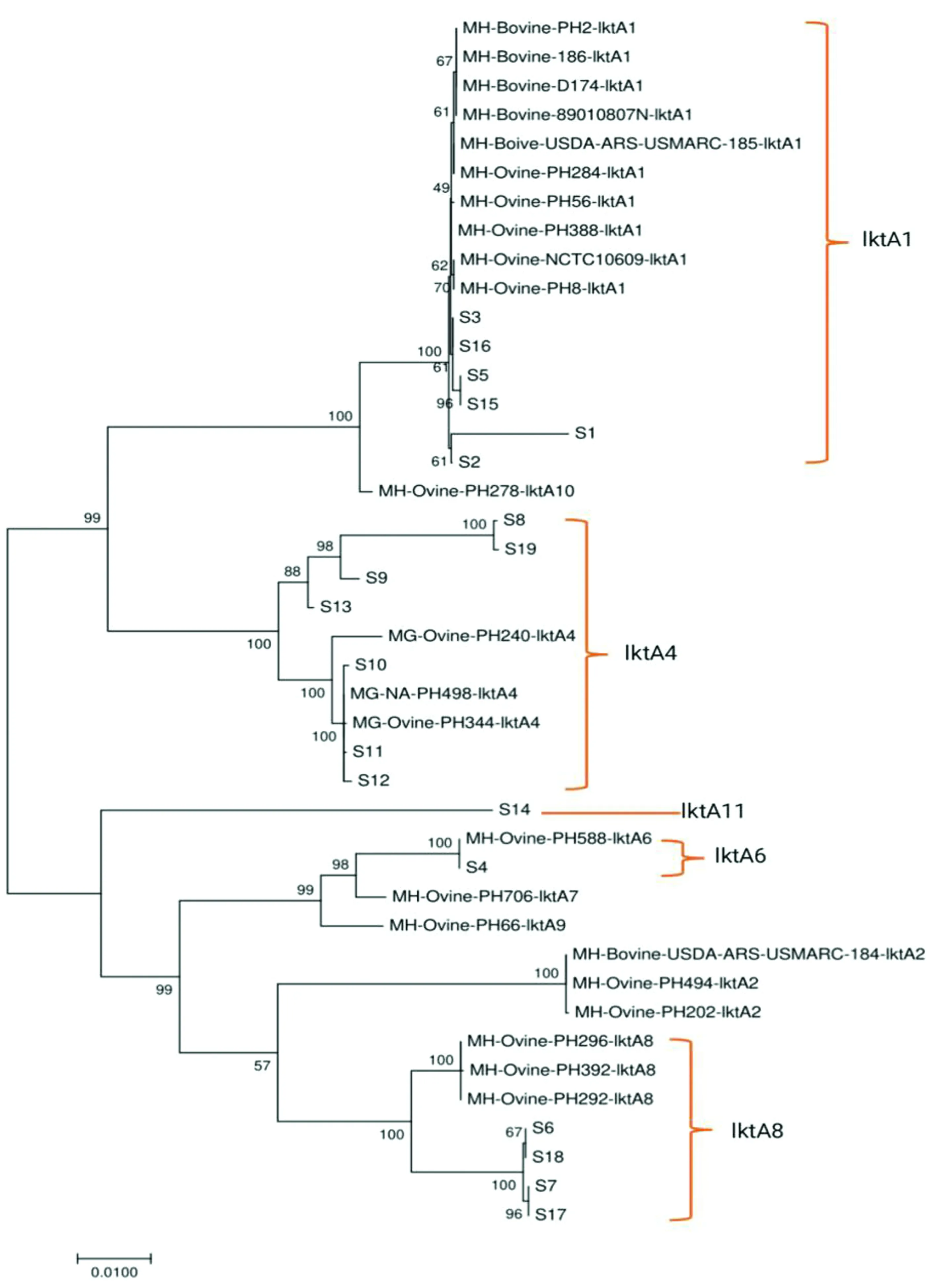
图6 MH lktA基因的系统发育树
2.7 分离菌株的药物敏感性分析对19株MH分离株,进行药敏试验,结果可见,分离株对复方新诺明的耐药性最高,达到100%;对卡那霉素、氟苯尼考和丁胺卡那敏感;部分菌株对链霉素、阿奇霉素、头孢氨苄、恩诺沙星和头孢噻吩耐药(表5)。
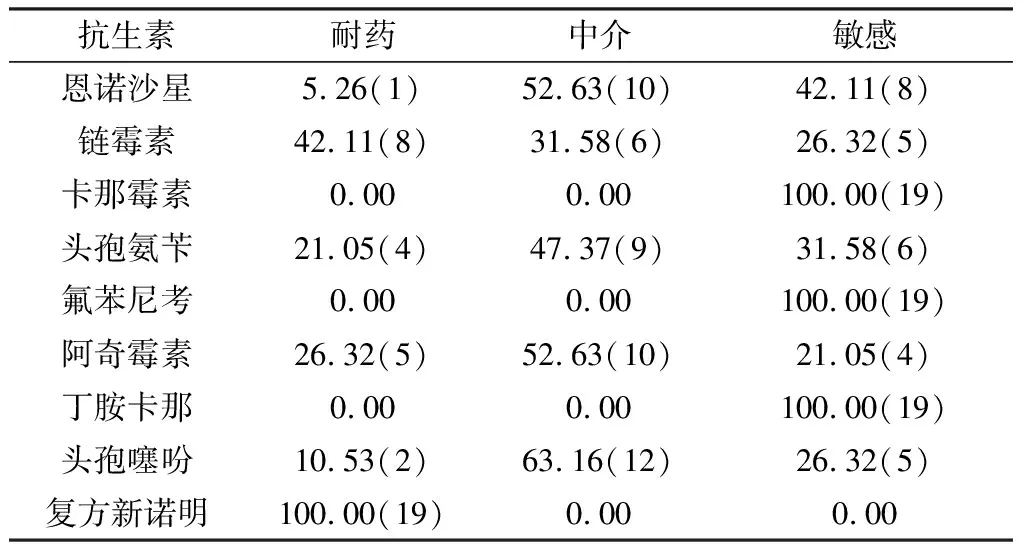
表5 19株MH分离株对药物敏感性 %
3 讨论
MH是引起山羊及绵羊呼吸道疾病的重要病原之一[12]。由MH引发羊发病死亡的确诊报道及对病原的生物学特性分析较少。本研究从四川省某患有严重呼吸道疾病的绵羊场分离获得19株MH,革兰染色涂片为阴性短杆菌,在血琼脂平板上可见光滑、半透明的菌落。生化试验结果显示分离菌株能发酵葡萄糖、麦芽糖、甘露醇、阿拉伯糖、乳糖、蔗糖、木糖,不发酵脲酶、鼠李糖,符合MH的生化反应特性。
MH根据其荚膜抗原不同可分为12个血清型,即:A1、A2、A5~A9、A12~A14、A16和A17血清型,其中A1、A2、A6分布最为广泛[13]。研究表明,A1型主要为引起牛呼吸道综合征的血清型,其次是A6型[9];而在羊源MH的感染中被认为血清型 A1 和 A2更为常见[14]。本研究发现,19株MH分离株中有7株为A1型,11株为A2型,研究结果与ABAY等[9]的试验结果一致。国内对MH的血清型鉴定的研究较少,所以本研究结果可为MH血清型的鉴定提供参考依据。
毒力基因检测结果表明,分离株均广泛携带毒力因子。其中,gcp基因和lktC基因的阳性检出率所占比例最高,达 17/19。gcp基因可以从宿主细胞表面分离糖蛋白[15],有利于细菌定植及肺部感染的形成。lktC基因属于RTX家族的成员之一,可使反刍动物白细胞受损,从而使MH逃避宿主的免疫反应,引起肺部炎症和组织损伤[16]。而gs60、tbpB和adh基因的携带率率分别为12/19,8/19,8/19。gs60和tbpB为外膜脂蛋白基因,IOVANE等[17]证明外膜蛋白对嗜中性粒细胞具有趋化作用,并能够抑制其吞噬作用和细菌杀伤作用,因此有利于MH在肺部的定植。adh基因参与细菌的黏附过程,使其能够在机体内定殖,造成机体损伤[18]。这些毒力基因在MH内不同的携带率也提示着细菌间存在毒力差异。
在致病性试验中,2株菌株分别于攻毒后6 h,小鼠均出现精神沉郁,畏寒抱团的现象,8 h后小鼠陆续死亡。在24 h内S1和S15菌株致小鼠死亡数分别11和14只。S1和S15分离株的DL50分为1.34×107和3.10×106CFU/mL,表明这2株分离株对小鼠的致病性较强。韩小丽等[19]对小鼠的致病性研究发现,MH的致病性可能与毒力因子的携带情况以及血清分型有关。因此加深对小鼠以及本动物的试验研究,可进一步为MH的致病性研究提供参考。
白细胞毒素LKT是曼氏杆菌最为主要的毒力因子。研究发现[19]lktA基因有着复杂的镶嵌结构,可在不同种及菌株之间发生基因在水平方向上的重组,形成多种不同的等位基因型,表现出丰富的多样性。此前的研究表明,不同的动物源lktA等位基因型与其宿主来源存在相关性。DAVIES等[19]根据序列相似性将lktA分为lktA1~lktA10共10个等位基因型。其中,羊源菌株主要为lktA1、lktA2、lktA8和lktA10等多种等位基因型,而牛源菌株主要包括lktA1、lktA2型等位基因型,而等位基因型lktA4仅从同属于曼氏杆菌的等位基因型中发现。本研究对19株MH的lktA基因序列的相似性进行比较分析,发现6株属于lktA1型;4株属于lktA8型;分离株S4属于lktA6型。但本研究中鉴定的7株等位基因型属于lktA4,而这一等位基因型属于葡萄糖苷曼氏杆菌,该结果首次发现羊源MH存在lktA4,也说明lktA基因在MH和葡萄糖苷曼氏杆菌之间发生了DNA的水平转移和重组。本研究中的分离株S14属于新的等位基因型,将其命名为lktA11,说明MH的lktA基因还存在更为丰富的等位基因型。
目前,针对动物呼吸道疾病的发生多用抗生素治疗,也正是由于抗生素药物的普遍使用,导致我国羊源MH存在耐药情况。王羽等[8]研究发现该菌对红霉素、庆大霉素和磺胺间甲氧嘧啶耐药。林裕胜等[7]研究发现其对氨苄西林、多黏菌素B和林可霉素耐药。本研究对19株MH分离株进行9 种临床药物的敏感性分析,结果发现,在MH分离株中,对复方新诺明的耐药性最高,达到了100%,对卡那霉素、氟苯尼考和丁胺卡那敏感。
本研究从四川省某绵羊场患有呼吸道疾病的动物中分离得到19株MH,并对其进行分离鉴定,血清学、lktA基因型、主要毒力因子和药物敏感性等生物学特性分析,结果不仅为该养殖场呼吸道疾病的防控提供参考,也为以后MH的生物学特性分析提供依据。

