浅绿色气球菌噬菌体vB_AviM_AVP编码蛋白的表达纯化和功能分析
张 昊,袭恒豫,毕斓婷,赵日虹,冀亚路,王心舞,王子晶,顾敬敏,韩文瑜
(吉林大学 动物医学学院,吉林 长春 130062)
浅绿色气球菌 (Aeroeoccusviridans)是过氧化氢酶和氧化酶阴性、微需氧性和非运动性细菌,一种革兰阳性球菌[1],广泛分布在环境中,由于其形态与链球菌很相似且常引起混合感染,故二者常混淆[2]。浅绿色气球菌虽然不是一种常见的病原菌,但却是潜在的机会病原菌,当机体免疫力下降或免疫功能不健全时,可以引起人类心内膜炎、败血症、菌血症以及关节炎等[3];在兽医临床上,可引起猪的脑膜炎、肺炎、尿路感染和关节炎,牛临床和亚临床乳腺炎等。目前,治疗由浅绿色气球菌引起的感染仍以抗生素为主。但近期研究表明,新分离的浅绿色气球菌具有多重耐药性[4],寻找新的治疗方法已经迫在眉睫。
噬菌体是一种能够特异性识别、感染和复制宿主细菌的细菌病毒[5-6],由于其具有特定的杀菌能力,在20世纪20年代早期,噬菌体一直被认为是治疗性的药物[7]。然而,由于抗生素的广泛应用,这种治疗方法被搁浅[8]。近年来,由于多重耐药细菌在全球多地广泛出现,以噬菌体为治疗的方法得到了广泛关注,裂解酶的应用也得到了推广。本研究根据已经报道的浅绿色气球菌噬菌体vB_AviM_AVP的基因组[9],对LysORF86、LysORF94、LysORF90和LysORF98进行原核表达与纯化,并对其活性进行初步研究。
1 材料与方法
1.1 菌株和质粒浅绿色气球菌AV-X1、N14-1,金黄色葡萄球菌R196、链球菌SS42、 Pet-15b由吉林大学动物医学学院微生物学与免疫学实验室保存;大肠杆菌DH5α、BL21感受态购自天根生化科技(北京)有限公司。
1.2 主要试剂BHI培养基、PrimeSTAR HS DNA Polymerase(TaKaRa);XhoⅠ、BamHⅠ(TaKaRa);T4DNA连接酶(NEB);氨苄青霉素、咪唑、IPTG(Sigma);Tris-base、SDS、甘氨酸、过硫酸铵(Amresco);Ni-NTA(GE)、蛋白Marker(Thermo);超滤管(Millipore);BCA蛋白定量试剂盒(Thermo)。
1.3 引物引物由生工生物工程(上海)股份有限公司设计并合成,引物序列见表1。

表1 引物信息
1.4 裂解酶载体的构建及蛋白表达与纯化
1.4.1载体的构建 以vB_AviM_AVP的基因组作为模板,用表1的引物通过PCR获得目的基因;选取适当的限制性内切酶对目的基因和载体进行双酶切;将酶切后的载体和目的片段按照1∶5的比例混合连接,先转化至DH5α感受态细胞中,然后转化至BL21感受态细胞中。
1.4.2诱导与表达 挑取Amp+平板上的单菌落培养10 h,转接入500 mL LB培养基中,按照1%的比例加入Amp+进行大量扩增。当菌液生长到对数期时(D600= 0.6~0.8),加入终浓度为1 mmol/L的IPTG,16℃低温诱导16 h。4℃、8 000 r/min离心10 min后弃上清,用50 mL Tris-NaCl溶液将菌体重悬。
1.4.3纯化 将收集的菌体置于冰上,超声30 min,破碎菌体。4℃、12 000 r/min离心20 min后收集上清。将超声上清加入Ni-NTA柱子中,并将填料重悬,使得蛋白能与填料充分结合。静置3 min 后,使上清液自然流出。用Tris-NaCl溶液将浓度为5 mol/L的咪唑分别稀释至终浓度为20,50,500 mmol/L。其中20,50 mmol/L的咪唑各50 mL洗涤杂蛋白,500 mmol/L的咪唑10 mL洗脱目的蛋白。通过超滤管以4℃、3 500 r/min离心30 min对纯化后的裂解酶进行浓缩。
1.5 LysORF86、LysORF94、LysORF90和LysOR-F98的活性检测将浅绿色气球菌AV-X1、NP-1,金黄色葡萄球菌R196、链球菌SS42活化,取100 μL 的菌液涂布在平板上,分别取10 μL的超声上清和纯化后的LysORF86、LysORF94、LysORF90和LysORF98蛋白,培养过夜,观察是否有空斑出现。
1.6 酶谱试验用500 mL BHI 扩增浅绿色气球菌AV-X1、金黄色葡萄球菌R196、链球菌SS42,扩增5 h后离心,ddH2O洗涤3次,用5 mL的ddH2O将菌体重悬后高压,于-20℃保存备用。配置SDS-PAGE分离胶,加入高压后的菌液,使胶呈半透明状态。样片加入Loading Buffer后进行跑胶,电泳结束后将胶置于复性剂中(50 mmol/L Tris,1% TristoX-100,pH 7.4),脱色摇床慢摇2 h复性。
1.7 高碘酸盐以及蛋白酶K处理菌体试验先将浅绿色气球菌AV-X1、金黄色葡萄球菌R196、链球菌SS42的菌液离心,弃掉上清,用无菌的PBS洗3次,加入等体积pH 5.2的50 mmol/L乙酸钠。分为4组,对照组,直接加入蛋白(50 mg/L)组,加入100 mmol/L高碘酸 25℃避光处理2 h组,加入蛋白酶K 10 μL处理3 h组。将后2组处理后的样品用无菌PBS洗5次,再分别加入蛋白(50 mg/L),测30,60,90,120 min以及12 h的D600值。
1.8 混合蛋白活性检测将浅绿色气球菌摇至D600值为0.8左右,用无菌的PBS洗3次后,用等体积的PBS重悬,分为4组,分别为空白对照组、混合蛋白组(LysORF86、LysORF94、LysORF90、LysORF98以相同浓度混合入1 mL体系中)、混合蛋白+裂解酶组(LysORF86、LysORF94、LysORF90、LysORF98、裂解酶以相同浓度混合入1 mL体系中)、裂解酶组。测30,60,90,120 min以及12 h的D600值。
2 结果
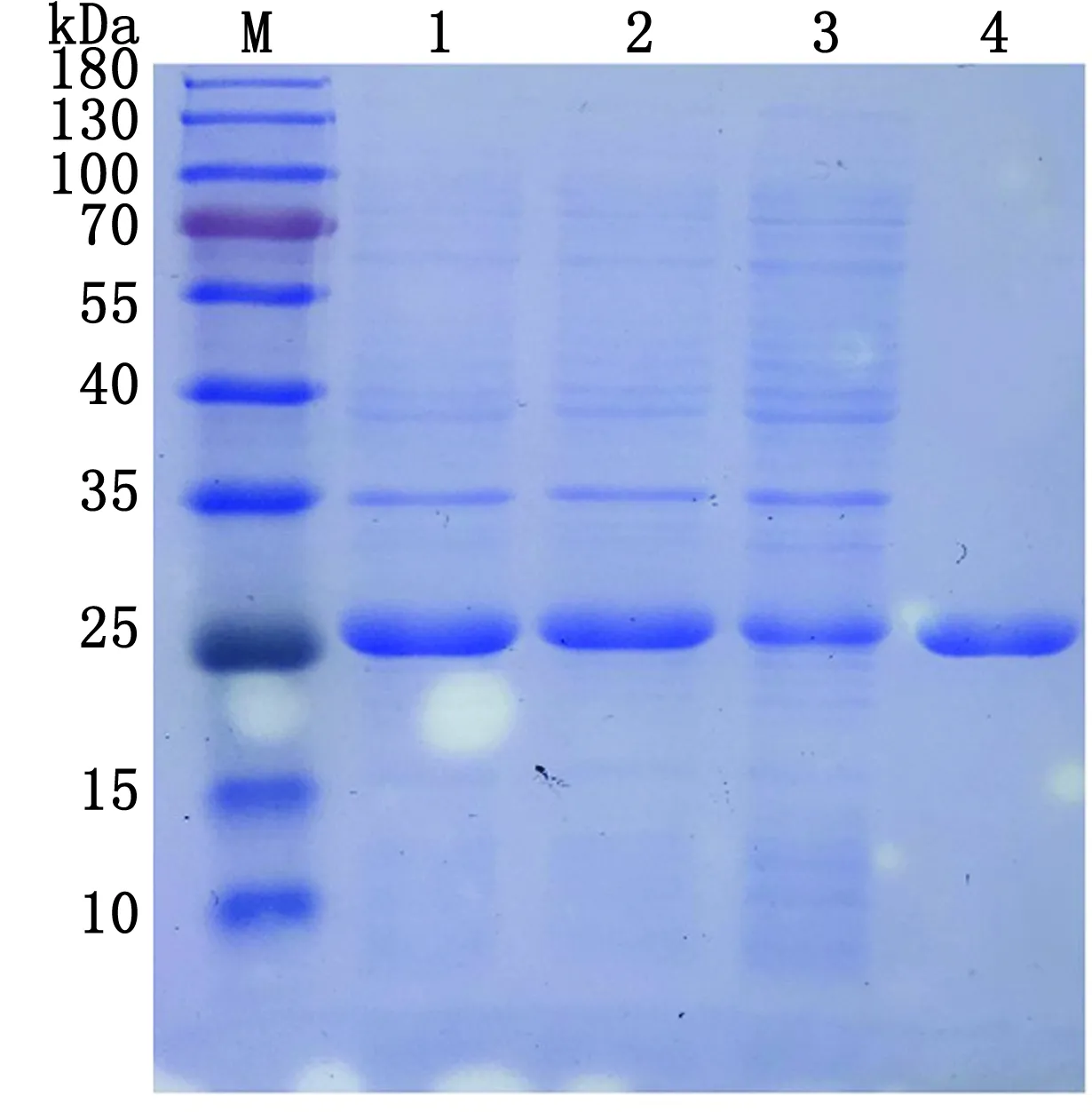
2.1 LysORF86、LysORF94、LysORF90和LysOR-F98的原核表达与纯化蛋白纯化结果如图1,2,3所示,结果表明LysORF86、LysORF94、LysORF90和LysORF98均得到表达,且表达形式为可溶性,纯化后分别得到了大小约为73.7,38.2,112.0,20.4 kDa蛋白。

M.蛋白Marker;1.诱导后的全菌;2.超声后的上清;3.超声后的沉淀;4.纯化后的LysORF86;5.诱导后的全菌;6.超声后的上清;7.超声后的沉淀;8.纯化后的LysORF94
2.3 Lys-AVP-02、Lys-AVP-05、Lys-AVP-07和Lys-AVP-08的活性检测平板涂布滴板结果表明,LysORF86、LysORF94、LysORF90和LysORF98均没有活性(图4,5)。
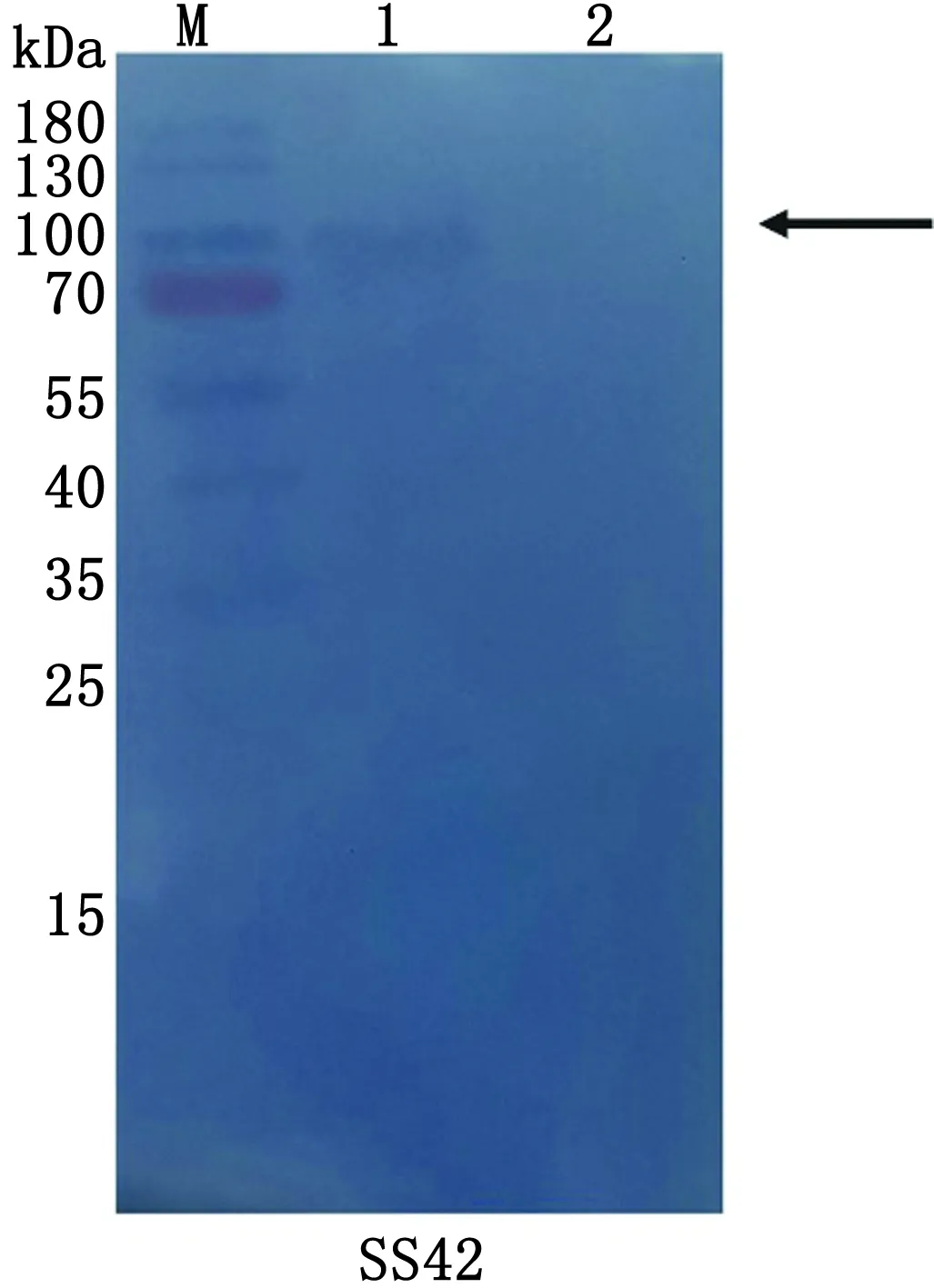
2.4 酶谱试验结果显示,蛋白LysORF86对AV-X1、SS42表现出活性(图6,7),蛋白LysORF90对AV-X1表现出活性(图8),蛋白LysORF94对R196表现出活性(图9),蛋白LysORF98对AV-X1无活性(图10)。

M.蛋白Marker;1.未诱导的菌液;2.诱导后的全菌;3.超声后的上清;4.超声后的沉淀;5.纯化后的LysORF90
M.蛋白Marker;1.未诱导的菌液;2.诱导后的全菌;3.超声后的上清;4.纯化后的LysORF98

A:AV.浅绿色气球菌AV-X1;NP-1.浅绿色气球菌NP-1;上清.LysORF90超声后的上清;纯化.纯化后的LysORF90。B:R196.金黄色葡萄球菌R196;SS42.链球菌SS42;上清.LysORF90超声后的上清;纯化.纯化后的LysORF90

A:AV.浅绿色气球菌AV-X1;NP-1.浅绿色气球菌NP-1;上清.LysORF98超声后的上清;纯化.纯化后的LysORF98。B:R196.金黄色葡萄球菌R196;SS42.链球菌SS42;上清.LysORF98超声后的上清;纯化.纯化后的LysORF98

M.蛋白Marker;1.ORF86;2.ORF94
M.蛋白Marker;1.ORF80;2.ORF94
2.5 高碘酸盐以及蛋白酶K处理菌体试验结果显示,蛋白LysORF86对AV-X1和SS42表现出极弱的杀菌活性(图11,12),lysORF94对R196未表现出杀菌活性(图13)。

M.蛋白Marker;1.ORF86;2.ORF90

M.蛋白Marker;1.ORF86;2.ORF94
2.6 混合蛋白活性检测结果如表2所示,30 min时混合蛋白可以引起D600值下降,与裂解酶混合后的蛋白或者单一的裂解酶D600值显著降低,超过30 min后,单独的混合蛋白基本没有影响,而与裂解酶混合后会引起D600值降低,但是主要因素仍取决于裂解酶。

M.蛋白Marker;1.ORF98

图11 LysORF86对处理后AV-X1的作用

图12 LysORF86对处理后SS42的作用
3 讨论
浅绿色气球菌是一种人畜共患条件性致病菌,广泛分布于咸肉、空气中,但临床上已出现越来越多的人和动物感染浅绿色气球菌的病例[10]。近年来,已有研究表明浅绿色气球菌对最常见的抗生素越来越耐药[11],已出现万古霉素耐药分离株[12],意味着在超级耐药菌出现之前,寻找新的抗菌方法已经迫在眉睫。

图13 LysORF94对处理后R196的作用
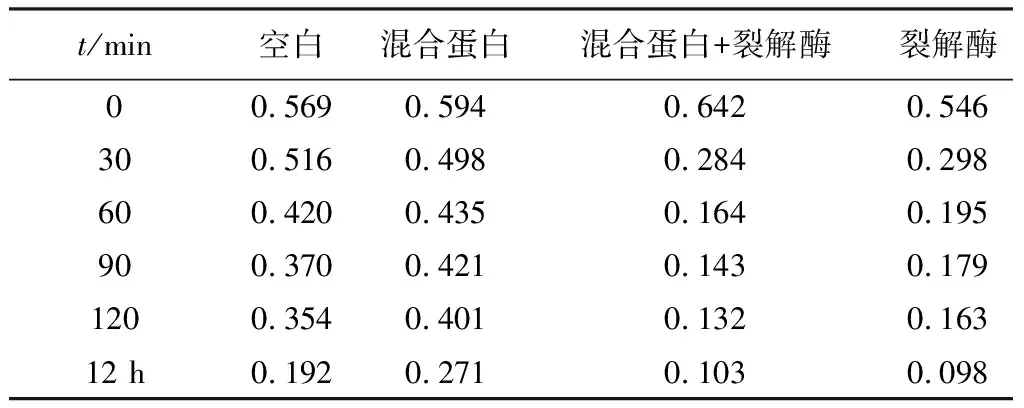
表2 混合蛋白活性检测D600值
噬菌体可以特异性的感染并杀死细菌,因此可以利用噬菌体对患者体内感染的细菌进行特异性清除。噬菌体种类繁多,在自然界中广泛分布,是天然的资源[13]。目前,国内外有许多成功利用噬菌体治愈患者超级耐药细菌感染的报道[14]。噬菌体裂解酶在噬菌体感染并裂解宿主菌的过程中发挥着重要的作用,而裂解酶作为一种蛋白质,可以通过基因工程的方法大量获得。这些都表明噬菌体及其裂解酶在替代传统抗生素疗法中具有很好的应用前景。
本研究通过对浅绿色气球菌噬菌体vB_AviM_AVP的全基因组分析、预测,并通过原核表达的方法,成功获得了LysORF86、LysORF94、LysORF90和LysORF98;通过平板涂布滴板试验,表明LysORF86、LysORF94、LysORF90和LysORF98不具有杀菌活性,这种情况在葛怀娜等[15]噬菌体的裂解酶表达过程中也出现过,可能是因为蛋白的活性不强,不能穿透细菌的细胞壁及细胞膜,因此本研究首先进行酶谱试验,验证LysORF86对AV-X1、SS42,LysORF90对AV-X1,LysORF94对R196表现出活性,LysORF98对AV-X1无活性;根据酶谱活性结果,进一步参照CAI等[16]的方法,利用高碘酸以及蛋白酶K处理菌体试验检测是否菌体本身影响了蛋白的效果。结果表明,菌体表面的多糖和蛋白可能对蛋白活性存在影响,但并不是主要因素;最后推测蛋白是有功效的,就像噬菌体可以裂解该细菌并非是单独的蛋白就可以裂解,需要多个蛋白及其他物质的参与,所以推断,是否混合后的蛋白就可以起到杀菌作用,或与其裂解酶合用能够增强杀菌能力。本研究通过测量D600值检测到混合后的蛋白,在30 min时可以略降低D600值,与裂解酶混合后功效也会略有增加,但是并没有引起显著变化。超过30 min后,单独的混合蛋白基本没有影响,而与裂解酶混合后还是会引起D600值降低,但是主要因素仍取决于裂解酶,这些结果表明,已经表达的蛋白功效尚待进一步研究开发。

