抗Ro52/TRIM21抗体在结缔组织病中临床作用的研究进展
严婷婷,薛 静
(1.浙江大学医学院附属第二医院 风湿免疫科, 浙江 杭州 310000;2.嘉兴市第二医院 风湿免疫科, 浙江 嘉兴 314000)
抗Ro52抗体是抗可提取核抗原(extractable nuclear antigen,ENA)抗体谱中的分布最广、最常见的抗体成分之一,因其靶抗原成分属于三结构域蛋白(tripartite motif,TRIM)家族,故又称为抗TRIM 21抗体。既往认为它是抗SSA(Sjögren’s syndrome A)抗体的组成成分之一,与抗Ro60抗体共同组成统一的抗SSA抗体。随着现代检测技术及临床疾病诊治精准分型的发展,抗Ro52抗体已公认为独立抗体,目前在ENA系列检测中要求必须独立检测并报告该抗体。本文综述抗Ro52抗体的发展历史及近年来相关临床意义的文献,从而重新认识其在结缔组织病(connective tissue disease, CTD)致病及预后评估中的临床作用。
1 抗Ro52抗体的发展变迁
1.1 抗SSA/Ro52抗体的由来
1961年,在干燥综合征(Sjögren’s syndrom,SS)患者的血清中发现了新的特异抗体并命名为SjD 和SjT,这是对抗SSA/Ro52抗体的最早描述。随后在系统性红斑狼疮(systemic lupus erythematosus,SLE)患者的研究同样检测到未知抗体,研究者将其命名为Ro。1975年,在SS患者血清中发现了抗SSA和SSB抗体,故将此名称沿用至今。直到1979年才证明SSA和Ro与之前报道的属相同抗原类型,此后该抗原系统称为SSA/Ro,抗SSA抗体又称抗Ro抗体。早期研究认为抗SSA/Ro抗原是由分子量相近的两部分多肽(52 ku和60 ku)组成的同一大分子复合体,随着研究的深入,现有的研究结果已证实天然的抗SSA抗体仅包括抗Ro60抗体,而抗Ro52抗体为何?长期存有争议。
1.2 抗Ro52抗体是独立的自身抗体
随着现代分子生物学技术的发展使用HeLa-S100免疫印迹法证实了Ro52抗原在免疫反应中不与抗Ro60抗体与抗SSB抗体反应,即抗Ro52抗体为独立存在的自身抗体,并提倡在临床诊断中需要区分对待。抗Ro52抗体缺乏特异的细胞核或细胞质荧光染色,这可能是导致抗Ro52抗体在临床检测中长期遗漏的重要原因。随后抗Ro60抗体与SS、SLE,亚急性皮肤型红斑狼疮的临床关系逐渐研究清晰,但抗Ro52抗体的临床意义仍不明确,关注亦较少。对1 438份连续的血清样本检测自身抗体,结果测得独立存在的抗Ro52抗体仅为0.5%(12例),随访结果发现抗Ro52抗体与SS或SLE临床表现及疾病进展等均无关,考虑到检测复杂性和检测的经济成本,一度对抗Ro52抗体是否有必要独立检测引起争论。
1.3 Ro52抗原和抗Ro52抗体的实验室检测
Ro52抗原基因位于人类11号染色体短臂末端,其表达的Ro52抗原标记为TRIM 21,因此抗Ro52抗体也称为抗TRIM 21抗体。TRIM 21蛋白具有典型的3个结构域,即环指/Bbox/卷曲-螺旋结构,根据C-末端结构域的序列,还能将TRIM蛋白分为11个不同的家族,TRIM21属于C-IV家族,共有34个成员蛋白。其中已知环指结构域具有E3泛素连接酶活性,在蛋白质的泛素化修饰中起到积极作用。另外Ro52抗原C端的B30.2结构(亦成为PRYSPRY结构)可特异性与血清中IgG分子的Fcγ段结合,导致Ro52自身免疫性抗原的暴露从而出现自身抗体,这也可能是抗Ro52抗体导致自身免疫性疾病的机制之一。另外,Ro52抗原有两种剪接模式,包括Ro52α和Ro52β,其蛋白结构的差异可能导致临床表现不同[1]。
多种实验室方法可用于检测抗Ro52抗体,如间接免疫荧光、对流免疫电泳、酶联免疫吸附、免疫配体测定法、免疫印迹法和可寻址激光珠试验等。世界疾病预防控制中心(centers for disease control,CDC) 的国际标准参考血清(CDC 2、3、7和10)也明确定义了抗Ro52抗体,从而使得实验室更好地标准化检测。
2 抗Ro52抗体在结缔组织病中临床意义再评价
2.1 抗Ro52在CTD中的分布及诊断效能
抗Ro52抗体可在CTD中广泛检测到,除早期认识的SLE、SS外,还包括炎性肌病(idiopathic inflammatory myopathies,IIM)、系统性硬化(systemic sclerosis,SSc)、类风湿关节炎、自身免疫性肝病等[2-3]。抗Ro52抗体在CTD中的阳性分布多不具特异性(表1),既往认为抗Ro52抗体与SS关联密切,2016年〈美国风湿病学会联合欧洲风湿病联盟〉发布的SS诊断标准[19]仅采纳抗SSA/Ro60抗体,并不包括抗Ro52抗体。可见,抗Ro52抗体对SS缺乏诊断特异性。另外,在IIM中自身抗体的研究越来越受到重视。该病的抗体类型分为肌炎特异性抗体(myositis-specific autoantibodies, MSAs)和肌炎相关性抗体(myositis-associated autoantibodies, MAAs)两大类,而抗Ro52抗体是MAAs中最常见的抗体。抗Ro52抗体可与多种MSAs重叠,包括抗合成酶抗体(anti-aminoacyl-tRNA synthetases antibodies,ARSs)[4]、抗MDA5抗体[11],少部分亦可独立存在于MSAs阴性的IIM患者。但其是否具有诊断效能呢?国内研究对280例受试者,包括130例多发性肌炎/皮肌炎(polymyositis/dermatomyositis,PM/DM),100例CTD对照和50例健康受试者进行MSAs收入研究发表时间为2015—2019年间,排除个案、摘要、短片报告、样本<50例研究;CTD.结缔组织病;ASS.抗合成酶抗体综合征;Jo-1.抗Jo-1抗体;PM.多发性肌炎;DM.皮肌炎;ILD.间质性肺炎;IIM.炎性肌病;JM.幼年型肌炎;SSc.系统性硬化症;SS.干燥综合征;SLE.系统性红斑狼疮;MCTD.混合型结缔组织病.
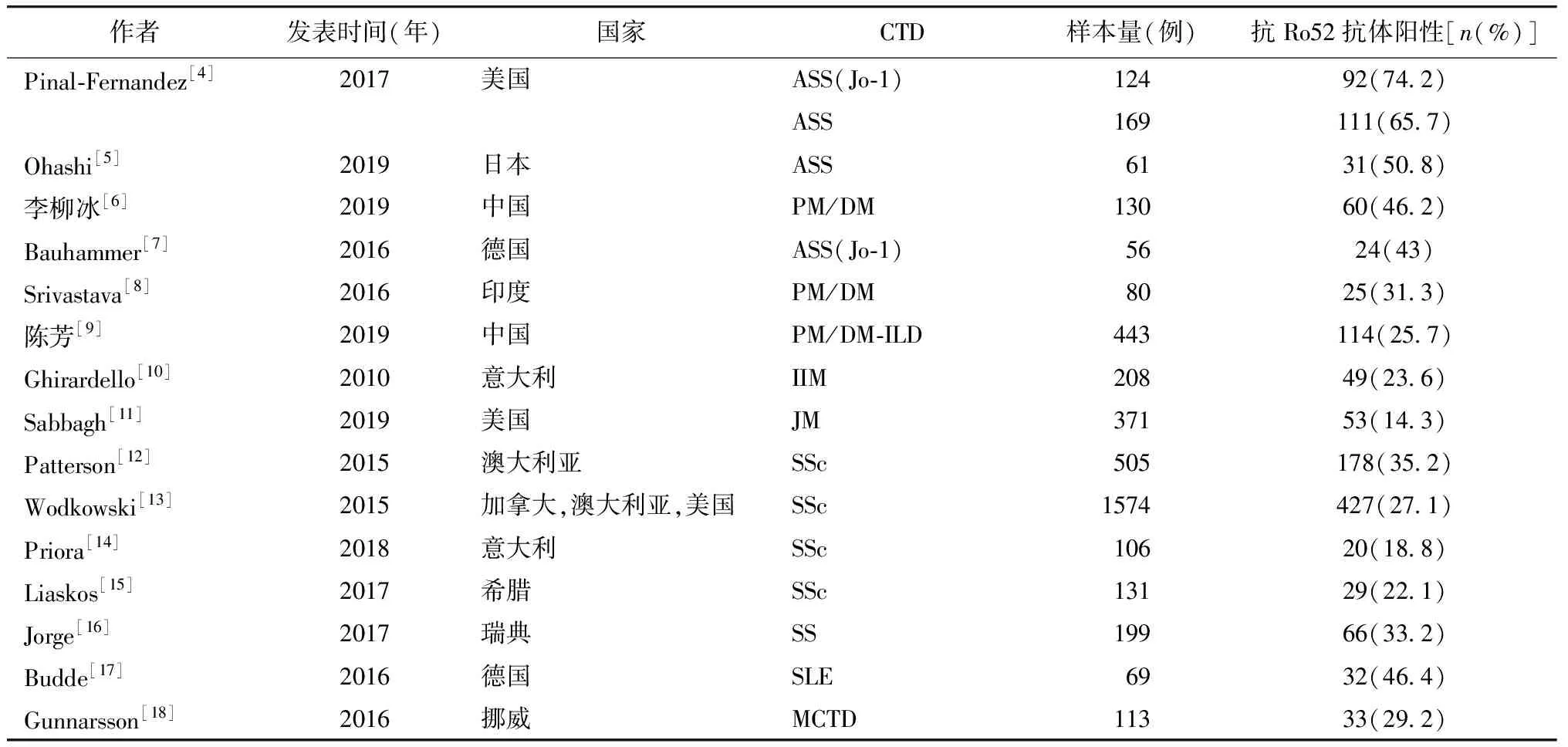
表1 抗Ro52抗体在CTD中的分布Table 1 Distribution of anti-Ro52 antibody in CTD
和MAAs检测,以评价不同抗体对疾病诊断的效能以及是否合并间质性肺炎(interstitial lung disease,ILD)的预测价值,结果发现抗Ro52抗体阳性对在CTD中诊断PM/DM及DM/PM-ILD的敏感性、特异性和阳性预测能力均有限,故单纯抗Ro52抗体阳性亦无法成为IIM诊断指标[6]。
抗Ro52抗体虽特异性不高,不具有诊断独立CTD的价值,却在区分疾病是否具有免疫色彩中起到了良性作用。其可能成为未分化结缔组织病[20]和具有自身免疫特征的间质性肺炎[21]的血清学指标,作为这些疾病的发展或严重程度的预测因子,从而增加必要的免疫学随访。
2.2 抗Ro52抗体与CTD脏器受累的临床意义
既往认为抗Ro52抗体非独立抗体,甚至认为它仅是抗SSA/Ro60抗体交叉反应的附属产物, 其临床特征相关性存在较多不确定。近年的研究较集中于其在IIM和SSc中的临床意义,不仅先后发现了抗Ro52抗体与ILD、心脏受累、不良预后的相关性,还显示其阳性可能与某些独特的临床特征相关,如技工手、雷诺现象、关节炎等(表2)。
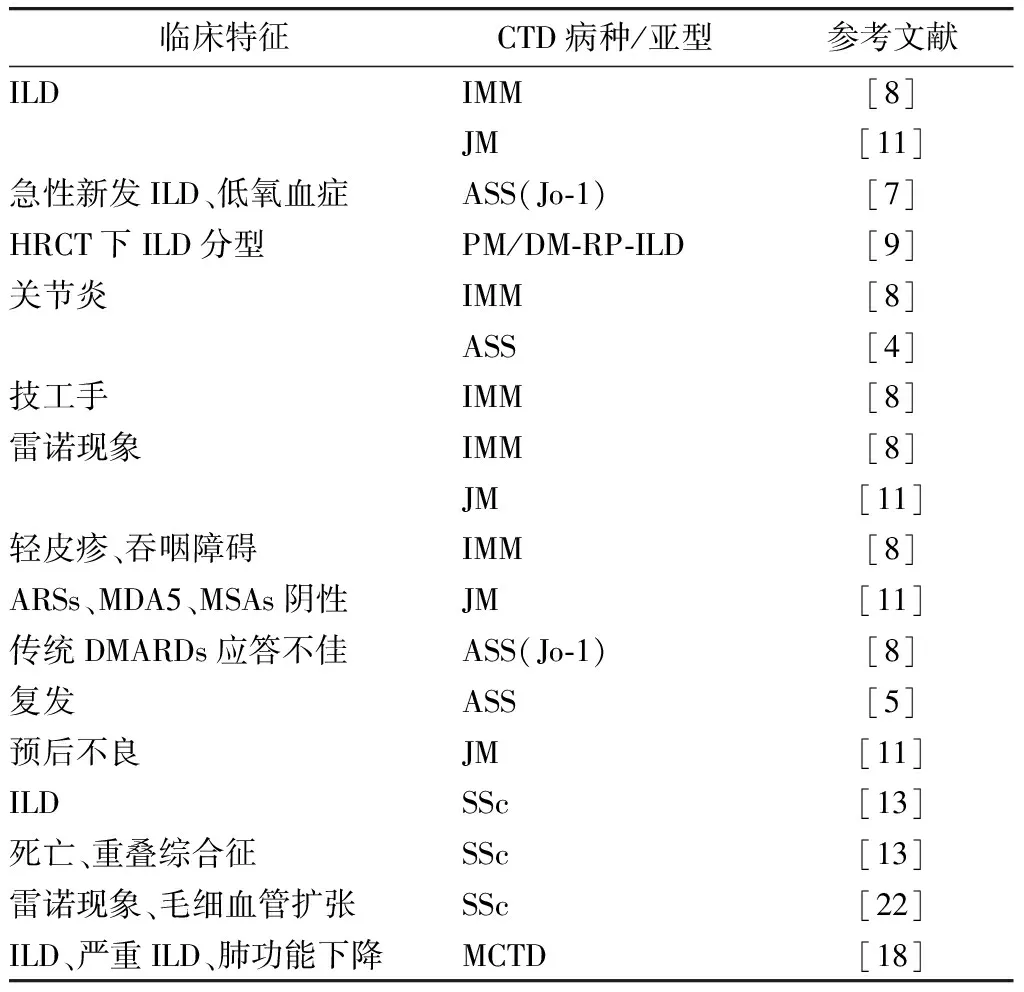
表2 抗Ro52抗体与CTD临床特征的关系
2.2.1 抗Ro52抗体与ILD:抗Ro52抗体与IIM并
收入研究发表时间为2015—2019年,排除个案、摘要、短片报告、样本<50例研究;CTD.结缔组织病;ILD.间质性肺炎;IIM.炎性肌病;JM.幼年型肌炎;ASS.抗合成酶抗体综合征;Jo-1.抗Jo-1抗体;PM.多发性肌炎;DM.皮肌炎;RP-ILD.快速进展性间质性肺炎;SSc.系统性硬化症;MDA5.抗MDA5抗体;ARSs:抗合成酶抗体;MSAs.肌炎特异性抗体;DMARDs:改善疾病的抗风湿药发ILD密切相关,对PM、 DM、 抗合成酶抗体综合征(anti-synthetase syndrome,ASS)等亚型的研究,同样显示抗Ro52抗体阳性与ILD的发生存在的密切联系。在抗Jo-1抗体阳性ASS中发现抗Ro52抗体与急性起病的ILD相关,其中高滴度的抗Ro52抗体显示了对ILD更显著的相关性[7]。对PM/DM受试者检测16项肌炎抗体的研究发现,DM/PM-ILD中抗Ro52抗体表达显著高于非ILD的DM/PM[6]。在幼年型肌炎患儿这一特殊群体中,具有抗Ro52抗体阳性的患儿会更容易并发ILD[11]。另外,抗Ro52抗体独立存在而其他MSAs阴性的PM/DM患者可并发快速进展性间质性肺炎,病例报道发现其HRCT上的影像主要表现为实变为主的机化性肺炎[9]。
抗Ro52抗体在SSc中的临床意义也受到关注。加拿大硬皮病研究组(CSRG)[22]的临床数据发现20%的SSc患者存在抗Ro52抗体,并且抗Ro52 抗体与ILD发病密切相关。之后该CSRG团队整合了澳大利亚、美国的多中心数据,组成1 574例SSc患者的大型队列,分析发现ILD是唯一与独立存在的抗Ro52抗体显著相关的临床变量[13]。相悖的声音同样存在,两项SSc研究认为抗Ro52与SSc临床表现(包括ILD)无相关性,但相较后者,前者的样本量显然更庞大[15,23]。
2.2.2 抗Ro52抗体与不良预后:抗Ro52抗体阳性表达与多种CTD的不良预后相关。在ASS患者中,抗Ro52抗体阳性者存在更高的疾病复发风险[5],这项有意思的研究将ASS患者确定3个组,分别为抗Jo-1抗体与抗Ro52抗体双阳性组(Jo-1双阳性组)、抗Ro52抗体阳性但合并除抗Jo-1抗体外其他ARSs抗体阳性组(非Jo-1双阳性组)以及双阴性组。研究发现双阴性组患者复发的比例明显低于前两组,在Jo-1双阳性组和非Jo-1双阳性组中,复发患者的比例没有差异。在幼年型肌炎的患儿中抗Ro52抗体的阳性者疾病缓解率更低、需使用更多药物治疗,更多表现为慢性复发病程[11]。SSc的患者中,与存在独立抗Ro52抗体的患者相比抗Ro52 抗体阴性患者的死亡风险显著增加[13]。另外,在Ⅰ型自身免疫性肝炎中的患者中可以看到,抗Ro52抗体阳性的患者并发肝病相关并发症的发生率较高[24],抗Ro52抗体联合可溶性肝抗原抗体阳性者与患者预后不良事件的发生独立相关,如肝硬化、肝衰竭或肝移植。
2.2.3 抗Ro52抗体与心脏损伤:母体抗SSA抗体阳性可导致胎儿或新生儿先天性房室传导阻滞、QTc间期延长、窦性心动过缓等心律失常及发病机制早有报道。但早期的研究多数未将SSA/Ro60抗体与抗Ro52抗体区分看待,因此究竟是哪一自身抗体导致这些临床症状尚存很大争议。对存在房室传导阻滞的患儿母亲进行自身抗体检测,其中48%的母亲血清中有存在自身抗体,其中抗Ro52抗体阳性率高达94.6%,其次为抗Ro60抗体达63%,这一研究认为母体自身抗体特别是抗Ro52抗体存在与胎儿或新生儿心脏不良事件发生相关[25]。在并发QTc间期延长的CTD成年患者中发现,血清抗Ro52抗体滴度水平与QTc延长的发生相关,而与抗Ro60抗体无关[26]。针对SSc的研究则显示,虽然QTc延长在SSc患者中很常见,但与抗Ro52抗体或抗Ro60抗体阳性均未显示相关。此外,抗Ro52抗体阳性可能与SSc相关肺动脉高压(超声心动图显示的肺动脉收缩压(pulmonary artery systolic pressure,PASP)>50 mmHg)相关[27]。迄今为止,抗Ro52抗体或抗Ro60抗体对CTD中心脏并发症的致病作用尚无确切定论,但不论心律失常抑或肺动脉高压PAH,鉴于其可能导致严重的不良结局,仍应该重视在抗Ro52抗体阳性的CTD患者中筛选和监测心脏损伤。
3 问题与展望
近年针对抗Ro52抗体的研究进展显然与肌炎抗体谱、CTD-ILD和CTD相关妊娠生育等热点问题同步,因此其最初认识虽来自于SS和SLE,但已发现与其临床特征联系最紧密的是IIM,特别是与CTD-ILD之纠葛令其贴上更加严肃的标签,不容轻视。但至今为止,针对抗Ro52抗体的研究仅是发现一系列临床现象,其致病机制的探索仍任重而道远。随着医学的发展抗Ro52抗体必将有更多研究接踵而至,期待更多真相挖掘。笔者在此也提出新的展望,抗Ro52抗体联合不同临床特征可能存在更独立特异的临床表型及预后价值,需早期识别,加强监测及随访。另外,Ro52抗原可否为CTD治疗提供进一步研究的方向同样值得思索。

