首诊乙型肝炎病毒相关肝细胞癌发生门静脉癌栓和肝外转移的危险因素及预测列线图△
林彤,何力,彭立生
1广州中医药大学第四临床医学院,广东 深圳 518033
深圳市中医院2肿瘤与血液病科,3科教科,广东 深圳 518033
原发性肝癌病死率居中国所有恶性肿瘤的第二位,超过90%为肝细胞癌(hepatocellular carcinoma,HCC),中国超过80%的HCC与乙型肝炎病毒(hepatitis B viral,HBV)感染有关。因早期症状隐匿,多数HCC患者首次确诊时就已经为进展期甚至晚期,出现了门静脉癌栓(portal vein tumor thrombus,PVTT)和(或)肝外转移(extrahepatic metastasis,EHM)。研究表明,中晚期HCC患者尚可明显获益于经导管动脉化疗栓塞和肝动脉灌注化疗等的较积极疗法。尽早诊断是为患者争取更多治疗机会和延长生存期的关键,但部分PVTT需经过增强CT与门静脉血栓鉴别,EHM的诊断需行全身影像检查,设备精度不够可能延误诊治;对低转移风险患者而言,繁琐的检查流程又可导致时间、金钱与医疗资源的浪费。对首诊HCC患者来讲,简便的风险警报系统能协助医师预估患者的病情并进行医疗决策,尤其适合诊疗条件较落后的地区,有望减少患者的就医次数和过度检查。
研究显示,肿瘤大小和数量、HBV DNA载量、甲胎蛋白(α-fetoprotein,AFP)水平和机体炎性因子水平等均与PVTT和EHM相关,但国内外尚无针对HBV相关HCC(HBV-HCC)患者发生PVTT或EHM的风险预测模型。本研究基于传统临床数据,探讨首诊HBV-HCC患者出现PVTT和EHM的独立危险因素,并建立风险预测列线图,旨在加深临床对HCC侵犯、转移机制的理解,协助医师以简便的预判系统对不同风险人群进行个性化决策,现报道如下。
1 资料与方法
1.1 一般资料
选取2014年1月1日至2020年5月30日深圳市中医院收治的首诊HCC患者。纳入标准:①年龄>18岁;②有慢性HBV病史,伴或不伴肝硬化。排除标准:①合并酒精性脂肪肝病、非酒精性脂肪性肝病等其他肝脏疾病;②除HBV外的肝炎病毒或人免疫缺陷病毒感染;③合并胆管细胞癌或混合型肝癌;④其他恶性肿瘤病史或可疑转移性肝癌;⑤孕期或哺乳期女性;⑥临床资料不完整。诊断标准:①HCC诊断按患者就诊年份,符合2011年、2017年或2019年版《原发性肝癌诊疗规范》的相关诊断标准;②肿瘤大体病理分型根据《内科学(第9版)》,即肿瘤结节小且呈弥漫性分布者为弥漫型,肿瘤直径<5 cm为结节型,肿瘤直径≥5 cm为块状型;③慢性乙肝、肝硬化诊断依据《慢性乙型肝炎防治指南(2019年版)》;④PVTT诊断依据《肝细胞癌合并门静脉癌栓多学科诊治中国专家共识(2018年版)》;⑤EHM指肝外器官或淋巴结受累,经脑、胸、腹部影像学检查确诊,包括CT、MRI、X线或骨扫描诊断。依据纳入标准、排除标准和诊断标准,本研究共纳入200例首诊HCC患者。
1.2 资料收集
收集200例首诊HCC患者的临床资料,包括性别、年龄、肿瘤大体病理分型、肿块数目、肿瘤中心位置、肿瘤最大径、肝硬化程度、中性粒细胞计数、淋巴细胞计数、血小板计数、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、γ-谷氨酰转移酶(γ-glutamyl transferase,GGT)、总胆红素、白蛋白、凝血酶原时间(prothrombin time,PT)、纤维蛋白原(fibrinogen,FIB)、AFP、HBV DNA定量和乙型肝炎e抗原(hepatitis B e antigen,HBeAg)。除肿瘤直径外,连续性变量按惯例或本实验室参考值转换为二分类变量。因NLR和PLR尚无公认阈值,本研究分别用这两个指标预测PVTT,取受试者工作特征(receiver operating characteristic,ROC)曲线上约登指数最大时对应的值(即最佳截断值)作为分界标准。
1.3 统计学方法
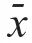
1.3.2 独立危险因素筛选 首诊HBV-HCC患者发生PVTT和EHM的影响因素采用单因素和多因素Logistic回归分析,将单因素分析中P<0.10的自变量纳入多因素Logistic回归分析。采用R 4.0.3软件“MASS”包进行双向逐步回归模型,筛选独立相关因素,结果用优势比(odds ratio,OR)及95%CI表示。
1.3.3 列线图的建立与评价 采用R软件“rms”包,利用独立相关因素构建列线图,用“pROC”包绘制ROC曲线,以最大约登指数确定列线图的诊断阈值,以ROC曲线下面积(area under the curve,AUC)评价模型区分度;用bootstrap法自抽样1000次行内部验证,用校准曲线和Hosmer-Lemeshow检验评价校准度;用“rmda”包行决策曲线分析(decision curve analysis,DCA),评价模型的临床效益。以P<0.05为差异有统计学意义。
2 结果
2.1 NLR、PLR对首诊HBV-HCC患者发生PVTT的预测价值
ROC曲线显示,NLR和PLR的最佳截断值分别为3.65和128.8,此时对HBV-HCC患者发生PVTT的预测价值最大,故以此为分界值。(表1、图1)

图1 NLR和PLR预测首诊HBV-HCC患者发生PVTT的ROC曲线

表1 NLR、PLR对首诊HBV-HCC患者发生PVTT的预测价值
2.2 临床特征
纳入的200例首诊HBV-HCC的患者中,男171例(85.5%),女29例(14.5%);年龄25~81岁,平均(54.42±13.16)岁;77例(38.5%)发生PVTT,31例(15.5%)发生EHM,21例(10.5%)同时存在PVTT和EHM。PVTT阳性患者的肿瘤最大径为10.1(4.0,13.4)cm、阴性患者为3.5(1.6,6.7)cm;EHM阳性患者的肿瘤最大径为6.0(2.0,12.0)cm、阴性患者为5.0(2.0,14.4)cm;其余首诊HBV-HCC患者的临床特征见表2。

表2 首诊HBV-HCC患者的临床特征
2.3 首诊HBV-HCC患者发生PVTT影响因素的单因素和多因素分析
单因素分析结果显示,性别、肿瘤最大直径、白蛋白水平、PT、FIB水平、血小板计数、ALT水平、AST水平、GGT水平、AFP水平、HBeAg表达情况均可能与首诊HBV-HCC患者发生PVTT无关(P>0.10)。年龄、肿块数目、肿瘤大体病理分型、肿瘤中心位置、肝硬化情况、总胆红素水平、中性粒细胞计数、淋巴细胞计数、NLR、PLR、HBV DNA载量均可能与首诊HBV-HCC患者发生PVTT有关(P<0.10),纳入多因素Logistic回归分析;且因NLR包含了中性粒细胞计数和淋巴细胞计数,对PVTT而言,NLR的|β|、OR和P值均较中性粒细胞计数和淋巴细胞计数显著,故仅将NLR纳入多因素Logistic回归分析。
多因素Logistic回归分析结果显示,肿瘤大体病理分型为块状型或弥漫型、多发肿瘤、总胆红素水平≥17.1 μmol/L、PLR≥128.8均为首诊HBV-HCC患者发生PVTT的独立危险因素(P<0.05)。(表3)

表3 首诊HBV-HCC患者发生PVTT影响因素的单因素和多因素分析(n=200)
2.4 首诊HBV-HCC患者发生EHM影响因素的单因素和多因素分析
单因素分析结果显示,性别、年龄、肿瘤最大径、总胆红素水平、PT、FIB水平、淋巴细胞计数、ALT水平、AST水平、GGT水平、AFP水平、HBeAg表达情况、HBV DNA载量均可能与首诊HBV-HCC患者发生EHM无关(P>0.10)。肿瘤大体病理分型、肿块数目、肿瘤中心位置、肝硬化情况、血小板计数、中性粒细胞计数、白蛋白水平、NLR、PLR、PVTT阳性情况均可能与首诊HBV-HCC患者发生EHM有关(P<0.10),纳入多因素Logistic回归分析;且对EHM而言,淋巴细胞计数与之无关,中性粒细胞计数的|β|、OR和P值均较NLR显著,故选择将中性粒细胞计数纳入多因素Logistic回归分析,而不纳入NLR。
多因素Logistic回归分析结果显示,肿瘤大体病理分型为块状型或弥漫型、多发肿瘤、中性粒细胞计数≥6.3×10/L均是首诊HBV-HCC患者发生EHM的独立危险因素(P<0.05)。(表4)

表4 首诊HBV-HCC患者发生EHM影响因素的单因素和多因素分析(n=200)
2.5 建立列线图
列线图是将每个危险因素的评分累计,总评分对应事件发生的预测概率。PVTT列线图包含5个计分因素,弥漫型肿瘤权重最大,对应100分,其后依次为块状型肿瘤、PLR≥128.8、总胆红素≥17.1 μmol/L和多发肿瘤,分别对应78、50、46和42分。EHM列线图包含块状型肿瘤、弥漫型肿瘤、中性粒细胞计数≥6.3×10/L和多发肿瘤4个因素,分别对应100、99、99和68分。(图2、图3)

图2 预测首诊HBV-HCC患者发生PVTT风险的列线图

图3 预测首诊HBV-HCC患者发生EHM风险的列线图
2.6 列线图的预测效果及临床价值
PVTT模型的概率阈值为36.6%,即列线图总分约132分时,具有最佳预测效果(图4A);EHM模型的概率阈值为12.3%,即列线图总分约140分时,具有最佳预测效果(图4D)。两模型的AUC>0.8,说明具有良好的区分能力,灵敏度也较高;且两模型的Hosmer-Lemeshow检验P>0.05,校准曲线显示预测概率和观察概率重合度高(图4B、图4E),即校准度良好。DCA提示,当PVTT的概率阈值为6%~71%和79%~93%时(图4C),EHM的概率阈值为2%~57%(图4F),模型的DCA曲线高于两条参考线,表示模型有临床净获益,而两模型的概率阈值均在上述范围内。(表5)

图4 列线图的预测能力和临床应用

表5 列线图预测阈值的准确度
3 讨论
本研究中,初诊HBV-HCC患者PVTT和EHM的发生率分别为38.5%和15.5%,与既往报道相符。多因素分析提示肿瘤大体病理分型为块状型或弥漫型、多发肿瘤是HBV-HCC早发PVTT或EHM共同的独立风险因素,这与既往的结论一致。肿瘤大小、数目是描述HCC侵袭性的最常用指标。研究显示,随肿瘤总体积增加,血管侵犯的发生率呈指数增长,且肿瘤倾向更低的分化程度。弥漫型肿瘤在HCC中的发生率为7%~13%,且常伴PVTT,这可能因为弥漫型肿瘤与门静脉系统小血管的接触面积更大,肿瘤细胞有更多的机会进入血管。相较于结节型,弥漫型肿瘤患者的总生存期更差(4.7个月vs 25.0个月)。
作为肝脏储备功能的评判指标之一,总胆红素的临床价值毋庸置疑。本研究结果显示,总胆红素≥17.1 μmol/L是首诊HBV-HCC患者发生PVTT的独立危险因素。PVTT形成的血流动力学基础是门静脉逆流,而肝硬化是其内因。肝硬化结节压迫肝小叶中央静脉,导致血流受阻从而引起门静脉高压,丰富的肝-门静脉交通支进一步加重了门静脉高压,使门静脉回流受阻甚至逆流,脱落的肝癌细胞容易滞留于门静脉形成PVTT。总胆红素水平可能与肝硬化的严重程度呈正相关,与PVTT的发生风险有关。有研究表明,不论肿瘤大小,总胆红素水平与HCC患者发生PVTT和多灶性肿瘤相关,但具体的机制有待进一步研究。
慢性炎症是肿瘤的固有特征之一,高炎症水平预示着不良转归。血小板可释放多种生长因子和细胞因子以促进HCC细胞的生长,并协助原发病灶外渗、转移灶新生血管生成及免疫逃逸,抗血小板治疗可降低远处转移的发生率。相反,淋巴细胞可参与抗肿瘤免疫过程,其浸润密度升高预示着更佳的治疗反馈和预后。既往研究提示,高血小板计数或PLR与HCC的血管侵犯、转移和复发有关,本研究用PLR≥128.8预测首诊HBVHCC患者发生PVTT的风险,准确度令人满意。中性粒细胞可通过直接作用于肿瘤细胞、促进肿瘤干细胞特性和调节肿瘤微环境等促进肿瘤发展,中性粒细胞计数与HCC分期、患者状态及不良预后相关。有报道用NLR>2.8衡量HCC的恶性程度,而本研究结果显示,中性粒细胞计数预测EHM发生风险的能力较NLR稍好。
本研究构建的两个可视化风险评分模型,能方便地预测首诊HBV-HCC患者发生PVTT和EHM的风险。当患者的列线图总分超过风险概率阈值,应进行全面检查;否则,应避免盲目检查并及时给予治疗。两模型均具有良好的区分能力,灵敏度均超过80%,尤其是EHM列线图。两列线图预测首诊HBV-HCC患者发生PVTT和EHM风险的特异度一般,说明其更适用于对高风险患者的排查。DCA结果表明,两模型在各自的诊断阈值下均能提供一定的临床净效益,即“真阳性率-假阳性率”,表明因正确诊断而获得的益处大于过度检查的浪费。
本研究是一次有意义的探索,但存在一些局限:①患者数据来自单一医院,样本量较小;②回顾性研究存在难以避免的偏倚;③未进行外部验证。因此,未来需通过大样本量的前瞻性研究进一步验证模型的可靠性,并进行外部验证。
综上所述,本研究建立了两个列线图,分别用于预测首诊HBV-HCC患者发生PVTT和EHM的风险,具有一定的临床应用前景。

