抗菌肽对鹌鹑生长性能、免疫功能、血清抗氧化功能和肠道发育的影响
杜 红,孙弟芬,易 鑫,唐子婷,徐 丹,舒 刚
(四川农业大学动物医学院,成都 611130)
抗菌肽(antibacterial peptides,ABPs)是动物先天免疫防御系统的重要组成部分,是由机体产生的一种相对分子量小、具有生物活性的多肽,具有广谱抗菌、抗病毒、抗原虫和提高免疫力等多种生物学功能[1]。由于碱性残基的存在,大多数昆虫抗菌肽都是阳离子分子,具有良好的抑菌活性[2]。与天然类似物相比,人工合成的抗菌肽具有合成效率高、成本低且能更显著提高机体抗菌和免疫调节效果等特点[3]。有研究表明,作为饲料添加剂的人工抗菌肽,能显著下调家禽肠道中致病性大肠杆菌的数量,防止病原菌的定植,提高免疫,同时具有改善动物健康和促进生长的潜力[4]。抗菌肽能够通过调节肠道微生物区系的组成来调节固有层T细胞的反应,从而维持促炎和抗炎免疫反应之间的平衡[5]。近年来,抗菌肽在动物养殖中应用广泛,在日粮中添加抗菌肽能提高肉鸡、断奶仔猪和兔子的生长和免疫功能,同时对抗应激和腹泻治疗效果显著[6-8]。综上所述,抗菌肽具有提高免疫力、抑制耐药菌株、改善肠道健康和促进生长等多种作用,是理想的饲料添加剂之一。然而,国内外对抗菌肽作为饲料添加剂在鹌鹑生产中应用的研究报道较少。因此,本试验通过在朝鲜鹌鹑饲粮中添加不同比例的抗菌肽,观察其对朝鲜鹌鹑生长性能、免疫功能、血清抗氧化及肠道发育影响,以期为抗菌肽在鹌鹑绿色养殖中的应用提供参考依据。
1 材料和方法
1.1 试验材料
试验动物朝鲜鹌鹑由眉山佳业鹌鹑合作社提供;试验用品抗菌肽采购自四川华德生物工程有限公司,由猪防御素(DHYICAKGGTCNFSPCPLFN RIEGTCYSGKAKCCIR)和苍蝇防御素(ATCDLL SGTGVKHSACAAHCLLRGNRGGYCNGRAICVCRN)按50%比例混合而成,生产批号:20160501。试剂盒均采购自南京建成生物工程研究所,包括总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、丙二醛(MDA),细 胞 因 子 IL2 和 IFN-γ,生 产 批 号 :20160522。
1.2 试验设计
试验采取单因子完全随机设计原则,选取1 200只1 d体重相当(7±1)g的健康雌性朝鲜鹌鹑,随机分为4组,每组4个重复,每个重复75只。对照组饲喂基础饲粮,抗菌肽Ⅰ组、抗菌肽Ⅱ组和抗菌肽Ⅲ组分别在基础日粮中添加0.1%、0.2%和0.4%抗菌肽,试验期为35 d,预试期7 d,正试期28 d。
1.3 基础饲粮和饲养管理
采用三层网床平养,小间分区,自由采食与饮水。严格按照常规饲养管理控制温度、湿度和光照,每天记录喂料量;按常规正常免疫程序进行免疫接种。基础饲粮组成及营养成分参照表1。
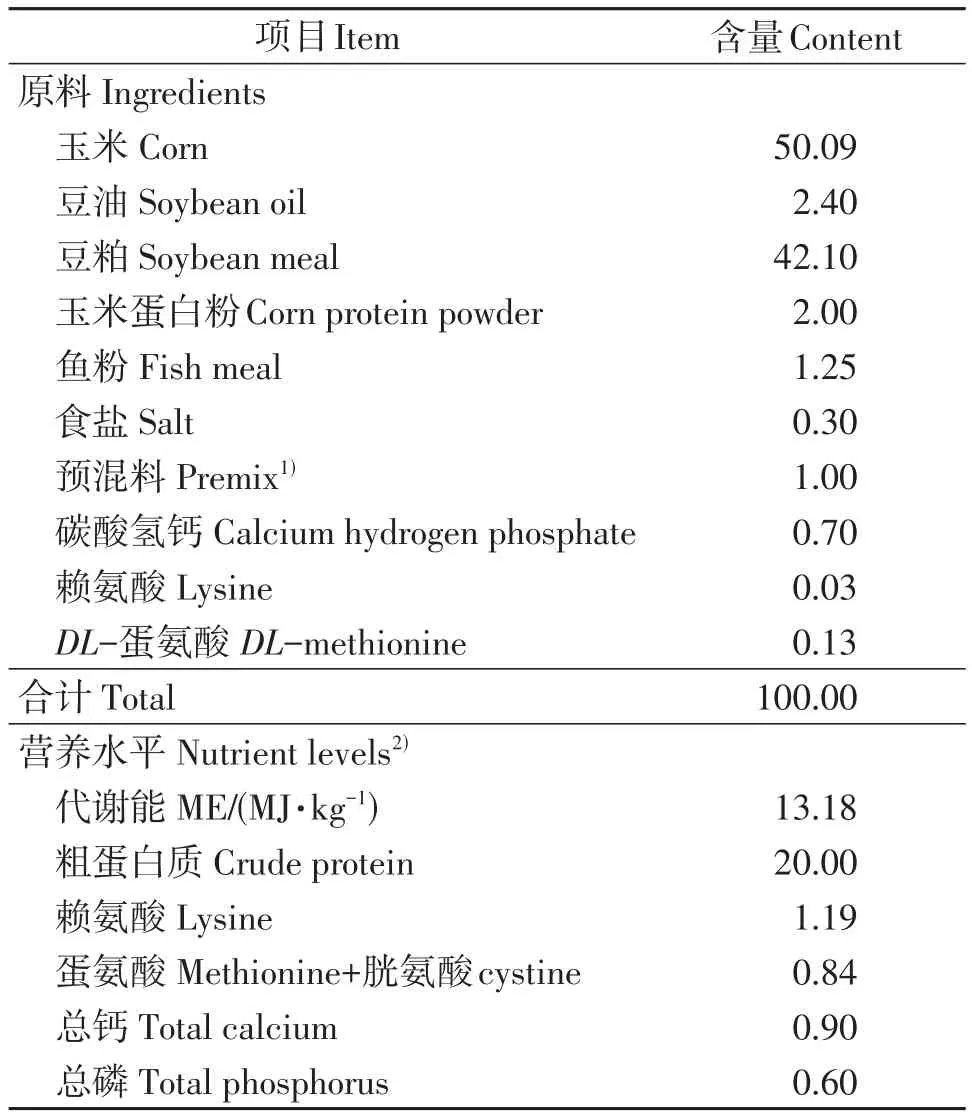
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.4 样品采集与指标测定方法
1.4.1 生长性能测定
试验期内每日观察朝鲜鹌鹑的行为和精神状况,记录和解剖死亡鹌鹑;以重复为单位,准确记录正式期内每周每个重复的给料量和剩余量,分别于试验第7、14、21和35天早晨称朝鲜鹌鹑空腹体重,根据耗料量和体重,统计每周平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。公式如下:
平均日采食量(ADFI)=试验期采食量/试验天数
平均日增重(ADG)=(试验末体重-试验初体重)/试验天数
料重比(F/G)=日采食量/日增重
1.4.2 血清和组织器官采集
试验第21天和35天,以重复为单位,每个重复随机抽取8只朝鲜鹌鹑,每组共计32只,记录活体体重,采取颈静脉采血方式收集血液。室温静置2 h后,3 500 r/min离心10 min,分离和分装血清,用于抗体、细胞因子和抗氧化指标的测定;之后按照常规方式进行解剖,采集鹌鹑免疫器官(胸腺、脾脏和法氏囊)用于免疫器官指数测定;分离各段小肠,测定各段肠道的长度和重量;试验第35天,采集每组8只朝鲜鹌鹑的2 cm左右的空肠肠段用于制作石蜡切片[9]。
1.4.3 免疫功能测定
1.4.3.1 免疫器官指数计算
免疫器官指数(g/kg)=器官重量(g)/体重(kg)。
1.4.3.2 血清新城疫抗体效价
通过血凝-血凝抑制(HA-HI)试验测定朝鲜鹌鹑血清新城疫抗体效价。
1.4.3.3 血清细胞因子含量测定
采用酶联免疫吸附法(ELASA)测定各重复朝鲜鹌鹑血清中白细胞介素-2(IL-2)、干扰素-γ(IFN-γ)含量,试验步骤严格南京建成试剂盒按照说明书执行。
1.4.4 血清抗氧化指标测定
按照试剂盒步骤说明,采用黄嘌呤氧化酶法测定朝鲜鹌鹑血清中总超氧化物歧化酶(T-SOD)活性、采用FRAP法测定总抗氧化能力(T-AOC)、采用TBA法测定丙二醛(MDA)含量[10]。
1.4.5 肠道发育
1.4.5.1 肠道长度和重量测定
常规方式解剖后,分离各段小肠,测量各段小肠长度和重量。
1.4.5.2 空肠形态学观察
用4%甲醛溶液中固定空肠组织,固定完成之后进行不同浓度乙醇脱水、二甲苯透明、浸蜡、包埋、切片、HE染色和中性树脂封片等操作,在荧光显微镜下观察空肠组织形态,拍照记录,测量空肠隐窝深度和绒毛高度,计算肠绒毛高度与隐窝深度的比值(V/C)[11]。
1.4.6 数据统计分析
原始数据用Microsoft Excel 2010软件统计整理,然后采用SPSS 19.0软件的ANOVA单因素方差统计分析,用最小显著差数法(LSD)进行多重比较,P<0.05为差异显著判断标准,结果以“平均值±标准差”表示。
2 结果与分析
2.1 抗菌肽对朝鲜鹌鹑生长性能的影响
基础饲粮添加抗菌肽对鹌鹑生长性能的影响见表2。由表2可知,7~14 d,所有抗菌肽试验组ADFI相较于对照组无显著变化趋势(P>0.05);抗菌肽Ⅰ组、抗菌肽Ⅲ组ADG显著高于对照组和抗菌肽Ⅱ组(P<0.05);抗菌肽Ⅰ组、抗菌肽Ⅲ组F/G显著低于对照组和抗菌肽Ⅱ组(P<0.05)。14~21 d,抗菌肽Ⅰ组、抗菌肽Ⅱ组ADFI显著高于对照组和抗菌肽Ⅲ组(P<0.05);抗菌肽Ⅱ组ADG显著高于抗菌肽Ⅰ组(P<0.05);抗菌肽Ⅱ组、抗菌肽Ⅲ组和对照组F/G显著低于抗菌肽Ⅰ组(P<0.05)。21~28 d,与对照组和抗菌肽Ⅰ组相比,抗菌肽Ⅱ组和抗菌肽Ⅲ组ADFI和ADG都显著升高(P<0.05),而各组料重比无显著变化(P>0.05)。28~35 d,抗菌肽Ⅰ组ADFI显著高于对照组、抗菌肽Ⅱ组和抗菌肽Ⅲ组(P<0.05);抗菌肽Ⅱ组和抗菌肽Ⅲ组ADG显著高于对照组(P<0.05);与对照组和抗菌肽Ⅰ组相比,抗菌肽Ⅱ组和抗菌肽Ⅲ组F/G显著降低(P<0.05)。7~35 d整个试验阶段,在ADFI方面,与对照组相比,所有试验组均有上升趋势,但差异不显著(P>0.05);在ADG方面,抗菌肽Ⅱ组和抗菌肽Ⅲ组显著高于对照组和抗菌肽Ⅰ组(P<0.05);在F/G方面,抗菌肽Ⅱ组和抗菌肽Ⅲ组显著低于对照组和抗菌肽Ⅰ组(P<0.05)。结果表明,随着抗菌肽添加量的增加,鹌鹑生长性能也逐步提高,但0.2%、0.4%抗菌肽添加量无显著差异(P>0.05)。

表2 抗菌肽对鹌鹑生长性能的影响Table 2 Effects of antimicrobial peptide on growth performance of quails
2.2 抗菌肽对朝鲜鹌鹑免疫功能的影响
基础饲粮添加抗菌肽对鹌鹑免疫机能的影响见表3。由表3可知,21 d,所有抗菌肽试验组的法氏囊指数、脾脏指数与对照组相比无显著差异(P>0.05);而抗菌肽Ⅱ组和抗菌肽Ⅲ组血清新城疫抗体效价水平显著高于对照组(P<0.05);抗菌肽Ⅲ组胸腺指数显著高于对照组和抗菌肽Ⅰ组(P<0.05)。35 d,抗菌肽Ⅱ组和抗菌肽Ⅲ组血清新城疫抗体效价水平和胸腺指数显著高于对照组(P<0.05);抗菌肽Ⅱ组和抗菌肽Ⅲ组脾脏指数显著高于对照组和抗菌肽Ⅰ组(P<0.05)。

表3 抗菌肽对鹌鹑免疫机能的影响Table 3 Effects of antimicrobial peptide on immune function of quails g·kg-1
基础饲粮添加抗菌肽对鹌鹑血清细胞因子的影响见表4。由表4可知,与对照组相比,不同浓度抗菌肽的添加对21 d鹌鹑血清IL-2和IFN-γ含量无显著影响(P>0.05)。35 d,抗菌肽Ⅱ组和抗菌肽Ⅲ组鹌鹑血清IL-2和IFN-γ含量均显著高于对照组(P<0.05)。结果表明,随着抗菌肽添加量的增加,鹌鹑的免疫机能也逐步提高,但0.2%、0.4%抗菌肽添加量无显著差异。
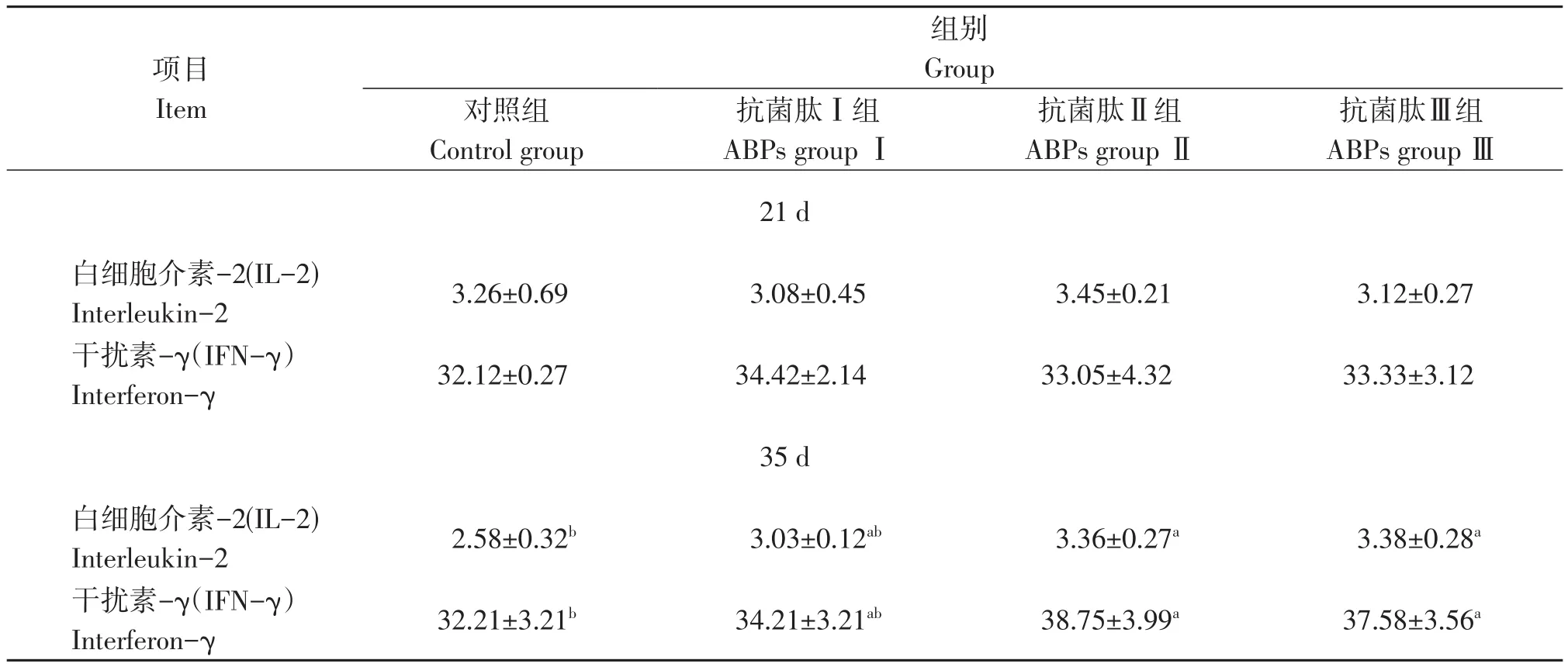
表4 抗菌肽对鹌鹑血清细胞因子的影响Table 4 Effects of antimicrobial peptide on cytokine contents in serum of quails ng/L
2.3 抗菌肽对朝鲜鹌鹑血清抗氧化指标的影响
基础饲粮添加抗菌肽对鹌鹑血清抗氧化指标的影响见表5。21 d,与对照组相比,添加抗菌肽的所有试验组血清T-SOD和T-AOC均显著升高(P<0.05),其中抗菌肽Ⅲ组T-AOC显著高于抗菌肽Ⅰ组、抗菌肽Ⅱ组;抗菌肽Ⅱ组和抗菌肽Ⅲ组血清MDA含量显著低于对照组和抗菌肽Ⅰ组(P<0.05)。35 d,所有抗菌肽试验组血清T-SOD和T-AOC均显著高于对照组(P<0.05),其中抗菌肽Ⅲ组T-SOD和T-AOC均显著高于抗菌肽Ⅰ组和抗菌肽Ⅱ组;所有抗菌肽试验组MDA含量显著低于对照组(P<0.05)。结果表明,随着抗菌肽添加量的增加,鹌鹑的抗氧化能力也逐步提高。

表5 抗菌肽对鹌鹑血清抗氧化指标的影响Table 5 Effects of antimicrobial peptide on serum antioxidant indexes of quails
2.4 抗菌肽对朝鲜鹌鹑肠道发育的影响
基础饲粮添加抗菌肽对鹌鹑肠道发育的影响见表6。21 d,在空肠长度和重量方面,抗菌肽Ⅱ组和抗菌肽Ⅲ组显著高于对照组和抗菌肽Ⅰ组(P<0.05);在回肠长度和重量方面,抗菌肽Ⅲ组回肠长度显著高于对照组、抗菌肽Ⅰ组和抗菌肽Ⅱ组(P<0.05),抗菌肽Ⅰ组和抗菌肽Ⅲ组回肠重量显著高于对照组和抗菌肽Ⅱ组(P<0.05)。35 d,抗菌肽Ⅲ组十二指肠重量显著高于抗菌肽Ⅰ组(P<0.05);抗菌肽Ⅱ组和抗菌肽Ⅲ组空肠重量显著高于对照组(P<0.05)。

表6 抗菌肽对鹌鹑肠道发育的影响Table 6 Effects of antimicrobial peptide on intestinal development of quails
基础饲粮添加抗菌肽对鹌鹑空肠形态的影响见表7。在空肠绒毛高度方面,添加抗菌肽的所有试验组都显著高于对照组(P<0.05);抗菌肽Ⅰ组、抗菌肽Ⅱ组空肠隐窝深度显著高于对照组和抗菌肽Ⅲ组(P<0.05);与对照组相比,基础饲粮添加抗菌肽对35 d鹌鹑空肠绒毛高度/隐窝深度无显著影响(P>0.05)。结果表明,随着抗菌肽添加量的增加,鹌鹑的肠道发育逐步提高,但0.2%、0.4%抗菌肽添加量无显著差异。
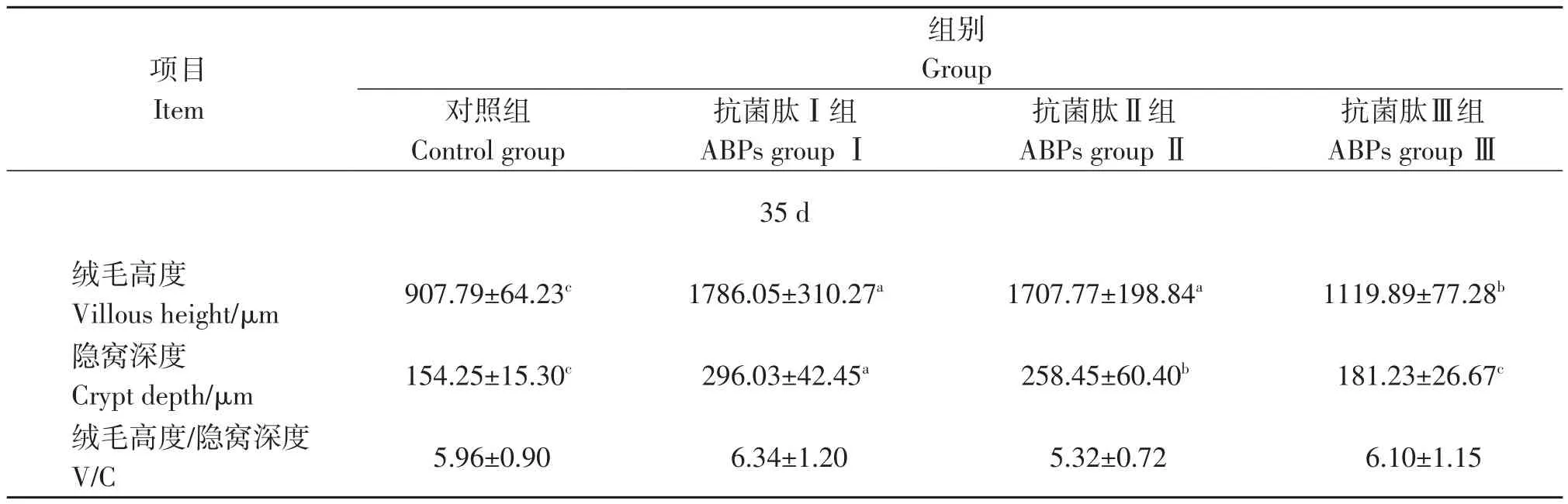
表7 抗菌肽对鹌鹑空肠形态的影响Table 7 Effects of antimicrobial peptide on jejunal morphology of quails
3 讨论
3.1 抗菌肽对朝鲜鹌鹑生长性能的影响
动物生长状况和肠道健康息息相关,目前一些饲料添加物的使用促进动物机体肠道微生物平衡,如抗菌肽在动物生长性能方面的影响已有了一定的研究,Xie Z.等[12]发现在饲粮中添加抗菌肽能提高肉鸡饲料转化率、存活率和降低料重比。添加的重组抗菌肽可富集于鸡的小肠中,促进鸡肠道发育和促进养分的吸收,降低料重比[13]。本试验表明,与对照组相比,不同浓度抗菌肽的添加在所有时间段均能增加鹌鹑平均日增重,降低料重比,提高生长性能,其中添加0.2%抗菌肽组效果最好。田志梅等[14]研究发现,抗菌肽是具有广谱抑菌活性的肽类物质,一方面主要通过与细菌细胞膜上受体特异性结合,膜内外渗透压发生紊乱,使其细胞壁或细胞膜的物理屏障遭到破坏;另一方面通过正负电荷相互吸引作用,改变细菌鞭毛的动力学特性,从而抑制细菌生长代谢,在畜禽养殖上有一定的应用。本试验发现在基础饲粮中添加抗菌肽提高了鹌鹑生长性能,可能是由于抗菌肽的摄入,诱导肠道上皮细胞膜通透性改变来防止与上皮表面潜在病原微生物的相互作用和入侵,从而促进肠道黏膜良好发育,增强肠道物理和化学屏障功能,从而提高消化吸收养分的能力。本试验发现,饲料中添加0.2%抗菌肽和0.4%抗菌肽均能显著提高朝鲜鹌鹑生长性能,且两组在统计学上无显著差异,考虑到成本,故0.2%抗菌肽最适宜。
3.2 抗菌肽对朝鲜鹌鹑免疫机能的影响
免疫器官指数是评价动物机体免疫器官发育状态及机体免疫功能强弱的指标之一,在一定范围内免疫器官发育良好,免疫功能强,抵御外来微生物能力越强,机体自身能更好地维持内环境稳态,能高效进行机体各项生理活动,提高机体免疫力,就是提高机体抗病力[15]。本试验中,与对照组相比,基础饲粮中添加抗菌肽有提高免疫器官指数的趋势,其中在正常范围内,0.4%抗菌肽组能显著提高35 d鹌鹑的胸腺指数和脾脏指数,表明抗菌肽在一定范围内能够刺激免疫细胞,促进免疫细胞、组织的生长发育,进而促进鹌鹑免疫器官的良好发育,具体的机制还有待研究。吕尊周等[16]发现抗菌肽能通过促进与细胞因子相关基因的转录、翻译,从而促进细胞因子的合成,促进脾脏发育,增强机体自身免疫力。李金莲[17]发现抗菌肽可以提高肉仔鸡的免疫功能,主要是通过促进肉仔鸡免疫器官发育,提高新城疫疫苗免疫后的抗体效价实现的。本试验中,0.2%抗菌肽组朝鲜鹌鹑血清中新城疫抗体效价水平显著高于对照组,表明抗菌肽能够促进免疫球蛋白的合成和增加其活性,提高鹌鹑的抗病力,与上述报道一致。
细胞因子存在于体液中,是机体免疫细胞或组织合成和分泌的小分子多肽或糖蛋白,在机体抵御异物入侵,启动免疫应答,维持稳态过程中十分重要[18]。复合抗菌肽能提高断奶仔猪血清细胞因子含量,减缓断奶应激,抵御病原微生物入侵[19]。抗菌肽能通过P38通路刺激Th17细胞表达CD73核苷酸外切酶,同时诱导细胞死亡,为癌症免疫治疗提供新思路[20]。本试验中,与对照组相比,试验组抗菌肽Ⅱ组、抗菌肽Ⅲ组血清中细胞因子含量显著升高,表明抗菌肽能够在一定范围内增加鹌鹑机体细胞因子的含量,增强机体非特异性免疫,抵御病原微生物,此研究发现和前人类似。但受到抗菌肽来源差异、动物品种不同以及饲养管理差异,所以文献中抗菌肽的添加剂量存在差异,本试验中,0.2%抗菌肽添加量最适宜。
3.3 抗菌肽对朝鲜鹌鹑血清抗氧化指标的影响
机体抗氧化能力与健康密切相关,机体氧化与抗氧化水平一般维持在相对稳定的状态,当这种状态被破坏时,过量自由基的释放会干扰核酸的复制、转录和翻译,导致抗氧化酶活性降低,造成氧化应激和细胞损伤,影响生物体内环境的相对稳定性[18]。T-AOC、SOD和MDA是衡量机体抗氧化和清除自由基的能力[21]。本次试验中,与对照组相比,所有抗菌肽组血清T-SOD活性和T-AOC含量均显著升高,血清MDA含量显著降低,与前人研究结果类似,说明抗菌肽能够平衡鹌鹑体内氧化系统和抗氧化系统动态变化,缓解氧化应激,保护细胞膜结构和功能的完整,提高鹌鹑的抗应激能力。杨海涛[22]发现与抗生素相比,抗菌肽能显著提高肉鸡血清内超氧化物歧化酶(SOD)和谷胱甘肽(GSH)的活性。孙全友等[23]发现在肉仔鸡饲粮中单独或联合添加抗菌肽或姜黄素时能及时清除活性氧,缓解机体的氧化应激,促进自身稳态恢复。
3.4 抗菌肽对朝鲜鹌鹑肠道发育的影响
完整的小肠结构和功能是营养物质消化吸收过程的基础,各肠段长度和重量反映了肠段的生长发育程度,而发育程度又能反映消化吸收的功能[24]。本试验中,与对照组相比,0.2%抗菌肽组和0.4%抗菌肽组空肠长度和重量显著增加;其中0.4%抗菌肽组回肠长度和回肠重量也显著高于对照组,抗菌肽能够富集于空肠和回肠中,促进鹌鹑肠道上皮黏膜健康发育和肠道物理屏障的完整性。
肠道绒毛高度、隐窝深度是衡量肠道健康和消化吸收能力的重要指标之一,绒毛高度越高,表明上皮成熟细胞越多吸收越强;隐窝深度越浅表示成熟细胞生成增加;二者的比值反映小肠消化吸收功能,比值升高,表明黏膜发育良好,消化吸收能力强[25]。Hu F.等[26]发现猪肠道抗菌肽(SGAMP)能在热应激下减轻肉鸡肠道损伤、维持正常肠道物理、化学屏障,从而缓解热应激对肉鸡的生长抑制。在肉仔鸡饮用水或基础饲粮中添加猪源抗菌肽PABP可影响肠道碱性磷酸酶AKP活性和表观能量效率,从而增加绒毛高度和黏膜厚度,促进肠道发育,提高对营养物质的吸收率[27]。Liu T.等[28]发现兔圆小囊抗菌肽可通过显著提高雏鸡十二指肠和空肠的肠绒毛高度,促进雏鸡肠道物理屏障的完整性。本实验中,与对照组相比,添加抗菌肽使鹌鹑空肠绒毛高度显著升高,促进肠道上皮细胞的生成和成熟,进而促进肠道发育,与前人研究结果相似。
4 结论
在饲料中添加抗菌肽可显著提高鹌鹑生长性能、免疫功能、血清抗氧化功能和肠道发育,其中以0.2%抗菌肽效果最佳。

