ShRNA Piezo1通过VEGF/FGF-2抑制ApoE(-/-)小鼠动脉粥样硬化形成
王秀玲,王正忠
动脉粥样硬化(AS)是临床上常见的疾病之 一,具有发病率高,危害大等特点[1,2]。AS的发病始于心血管的内膜,先后合并有多种病变,包括局部脂质及复合糖类积聚、纤维组织增生以及钙质沉着而导致斑块形成,并渐发生动脉中层退变,其继发性病变尚有斑块内出血、斑块破裂以及局部血栓形成。病变常常累及大、中肌性动脉,进而阻塞动脉管腔,导致所受累动脉所供应的组织或者器官的缺血或坏死[3,4]。目前针对AS的预防与治疗尚未找到有效手段,利用基因工程原理,寻求AS形成和发展的关键基因分子,并通过siRNA干扰技术进行基因沉默,从而特异性的阻断AS的形成,是一种有效的可行的手段之一。本研究寻找AS发生和发展的关键分子,利用基因干预技术,沉默基因表达,对于AS的预防和治疗具有重要意义。
Piezo1蛋白是最新发现的一种机械敏感性离子通道蛋白,与机械牵张应力的传导密切相连,且广泛表达于真核细胞[5,6]。研究表明,机械敏感性离子通道Piezo1蛋白参与胚胎血管的形成,Piezo1的过度表达可以促进心肌梗死动物中血管的新生,与血管内血液的流体力学密切相关[7,8]。然而Piezo1蛋白在血管动脉硬化中的作用尚未见报道。本研究利用ApoE(-/-)小鼠AS模型,构建Piezo1的基因沉默载体,小鼠腹腔注射shRNA-38A干扰载体,观察shRNA-Piezo1对ApoE(-/-)小鼠AS形成的影响,以求为临床上AS的治疗提供新的思路,报告如下:
1 材料与方法
1.1 实验动物ApoE基因敲除[ApoE(-/-)]雄性昆明小鼠30只,均购自山东济南动物中心,均为SPF级动物,批号为鲁05316253777,周龄6~8周,体重25~31 g;基因正常雄性昆明小鼠30只,均购自山东济南动物中心,均为SPF级动物,批号:鲁05316253001,周龄5~8周,体重24~33 g。
1.2 建立AS模型以ApoE(-/-)小鼠为研究对象,置于SPF级动物实验中心,调节动物房温度为(21.45±2.08)℃,湿度为(57.21±5.44)%。饲以高脂饲料,诱导构建AS动物模型,模型成功率85%以上。
1.3 shRNA-Piezo1慢病毒载体的构建和筛选根据siRNA干扰载体构建的方法,构建机械敏感性离子通道Piezo1蛋白编码基因Piezo1的干扰载体,利用NCBI基因库查询鼠源性Piezo1蛋白的编码基因Piezo1的序列,Gene ID是234839,位于第8号染色体,基因编码为NC_000074.6;根据siRNA靶点设计原理,构建siRNA-Piezo1的干扰序列。设计3种干扰序列分别为:
shRNA-Piezo1-homo-3299:GCGTCATCATC GTGTGTAAGA;
shRNA-Piezo1-homo-5762:GCCTCAAGTAC TTCATCATCAACT;
shRNA-Piezo1-homo-1875:GCGTCTTCCTT AGCCATTACT;选取上海吉凯公司提供的hU6-MCS-CMV-EGFP慢病毒载体作为酶切对象,加入shRNA-Piezo1干扰序列后,转染人胚肾293T细胞,进行克隆测定,质粒抽提,慢病毒的包装备用。
1.4 实验分组按照实验目的,将实验动物分成四组,每组10只。其中空白对照组是以健康雄性昆明小鼠为研究对象,给予普通饲料喂养8周,腹腔注射100 μg生理盐水,1/周,12周后处死。ApoE(-/-)阴性对照组是以ApoE(-/-)小鼠为研究对象,余处理同空白对照组。ApoE(-/-)AS组:以ApoE(-/-)小鼠为研究对象,给予高脂饲料喂养8周,其余处理同空白对照组。shRNA-Piezo1干预组是以ApoE(-/-)小鼠为研究对象,给予高脂饲料喂养8周,造模成功后,腹腔注射100 μg shRNAPiezo1慢病毒载体,1/周,12周后处死。
1.5 RT-PCR检测成纤维细胞生长因子-2(FGF-2)和血管内皮生长因子(VEGF)的mRNA表达水平四组小鼠处死后,解剖小鼠主动脉组织5 mg,加入1 ml的Trizol RNA iso试剂,电动研磨棒进行研磨,萃取小鼠主动脉组织的总RNA,TAKARA逆转录试剂盒处理RNA,将总RNA转成cRNA,4℃保存,TAKARA荧光定量PCR试剂盒。采用FS2000系统对PCR进行分析,反应条件:95℃预变性30 s;然后95℃ 5 s,60℃ 30 s,共进行40个循环。溶解曲线:95℃ 5 s;60℃ 1 min。降温:50℃ 30 s,1个循环。内参基因GAPDH、FGF-2和VEGF引物由上海生工生物工程有限公司生产。采用2-△△CT的方法计算目的基因的相对表达量(表1)。

表1 目的基因的引物序列
1.6 Western-blot检测四组小鼠处死后,解剖小鼠主动脉组织5 mg,电动研磨棒进行研磨,加入1 ml RIPA细胞裂解液,各组细胞在冰上裂解30 min,收集入1.5 ml的离心管中,在预冷4℃的离心机中离心,预设:5000 r/min,5 min后提取上清,经95℃煮沸后,收集蛋白备用。按照说明书制备浓缩胶10 ml,分离胶20 ml。上样后电泳分离,转膜后在4℃冰箱避光孵育过夜(>12 h)。经一抗稀释液(Piezo1,FGF-2和VEGF)1:10000稀释后加入样本离子膜。第2 d用PBST稀释液洗膜,重复3次,加用山羊抗小鼠IgG二抗经二抗稀释液1:1000稀释后孵育二抗1.5 h,用PBST稀释液洗膜,重复3次,而后用DAB显影液处理样本。Image J软件可以用来分析蛋白条带。
1.7 主动脉冰冻切片油红O染色四组小鼠处死后,解剖小鼠主动脉组织,甲醛-钙液混合物(40%甲醛和0.1 g氯化钙组成)固定30 min,PBS冲洗3遍,每次5 min,利用石腊机制备主动脉石蜡,切片机切片后,利用40%酒精浸润30 min,PBS冲洗3遍,每次5 min,60%异丙醇浸润10 min,PBS冲洗3遍,每次5 min,置于油红O染液2 min,PBS冲洗3遍,每次5 min,甘油明胶封片,显微镜下观察主动脉血管脂肪部分。
1.8 主动脉冰冻切片苏木精-伊红(HE)染色四组小鼠处死后,解剖小鼠主动脉组织,制备石腊,切片机切片后,利用40%酒精浸润30 min,PBS冲洗3遍,每次5 min,60%异丙醇浸润10 min,PBS冲洗3遍,每次5 min,苏木素染色液染色 5 min,PBS冲洗3遍,每次5 min,伊红染色液染色90 s,PBS冲洗3遍,每次5 min,中性树脂封片,普通光学显微镜下观察斑块面积及形态。
1.9 免疫组化染色四组小鼠处死后,解剖小鼠主动脉组织,制备石腊,切片机切片后,利用40%酒精浸润30 min,PBS冲洗3遍,每次5 min,60%异丙醇浸润10 min,PBS冲洗3遍,每次5 min。加入一抗(FGF-2,VEGF)经1:500稀释后,湿盒避光4℃孵育过夜,TBS冲洗3遍,每次5 min,TBS漂洗后加入生物素辣根酶(HPR)标记二抗,常温避光孵育20 min,TBS冲洗3遍,每次5 min,DAB试剂盒孵育5 min,TBS冲洗3遍,每次5 min。光学显微下观察,对VEGF阳性细胞计数。
1.10 统计学处理实验结果应用SPSS统计软件19.0版本进行数据分析。空白对照组,ApoE(-/-)阴性对照组,ApoE(-/-)AS组和shRNA-Piezo1干预组四组的组间比较采用单因素方差分析(F检验),组间比较采用q检验。P<0.05为差异有统计学意义。
2 结果
2.1 shRNA-Piezo1慢病毒转染结果结果显示,按照预先设计的3种序列siRNA-Piezo1-homo-3299,siRNA-Piezo1-homo-5762和siRNAPiezo1-homo-1875。以293T细胞为靶细胞,分别采用10-1,10-2,10-3,10-4μl病毒量进行转染,从而选择最优的病毒滴度。结果显示,10-1μl慢病毒量转染率最高,病毒滴度为1×108TU/ml,图1。

图1 3种序列的基因测序和慢病毒转染结果
2.2 shRNA-Piezo1干扰载体的筛选RT-PCR检测结果显示,shRNA-Piezo1-homo-5762组的mRNA水平要明显低于shRNA-Piezo1-homo-1875组和shRNA-Piezo1-3299组,比较具有统计学差异(P<0.05);另外Western Blot检测结果显示shRNA-Piezo1-homo-5762组的Piezo1蛋白表达水平要明显低于shRNA-Piezo1-homo-1875组和shRNA-Piezo1-3299组,比较具有统计学差异(P<0.05)。本研究选取shRNA-Piezo1-homo-5762作为干扰序列,进行后续试验,图2。

图2 3种序列的shRNA-Piezo1干扰载体的筛选结果
2.3 各组苏木精-伊红(HE)染色结果主动脉HE染色结果显示,空白对照组小鼠主动脉内膜和中膜平滑,形态正常,未见脂肪细胞浸润(图3A)。ApoE(-/-)阴性对照组中小鼠主动脉脂肪细胞浸润主动脉内膜(如黑色箭头所示),尚未侵及中膜(图3B);ApoE(-/-)AS模型组小鼠主动脉壁内膜有粥样斑块形成,可见炎性细胞和泡沫细胞浸润(图3C);shRNA-Piezo1干预组小鼠主动脉壁平滑,未见明显炎性细胞和泡沫细胞浸润(图3D);四组小鼠主动脉粥样硬化斑块体积所占总体积的百分比见表2,其中,shRNAPiezo1干预组中主动脉粥样硬化斑块体积所占总体积的百分比与ApoE(-/-)AS模型组相比明显减少,具有统计学差异(P<0.05)。
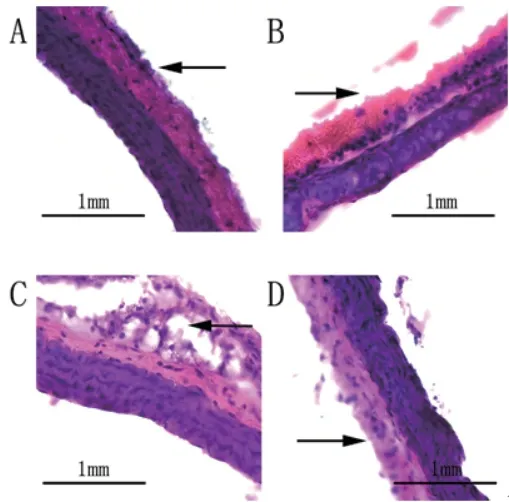
图3 苏木精-伊红(HE)染色(400×)

表2 各组HE染色主动脉粥样硬化斑块面积百分比
2.4 各组主动脉冰冻切片油红O染色结果主动脉油红O染色结果显示,空白对照组小鼠主动脉动脉壁内膜、中膜形态正常,未见动脉粥样斑块(图4A)。ApoE(-/-)阴性对照组中小鼠主动脉动脉壁中膜毛糙和断裂(图4B);ApoE(-/-)AS模型组小鼠主动脉壁中膜粗糙,可见大量泡沫细胞浸润(图4C);shRNA-Piezo1干预组小鼠主动脉有少许泡沫细胞浸润(图4D);4组小鼠主动脉粥样硬化斑块体积所占总体积的百分比见表3,其中,shRNA-Piezo1干预组中主动脉粥样硬化斑块体积所占总体积的百分比与ApoE(-/-)AS模型组相比明显减少,具有统计学差异(P<0.05)。
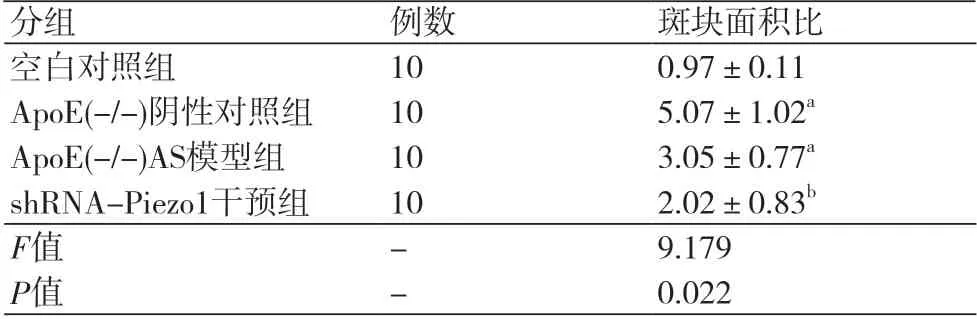
表3 各组油红染色主动脉粥样硬化斑块面积百分比
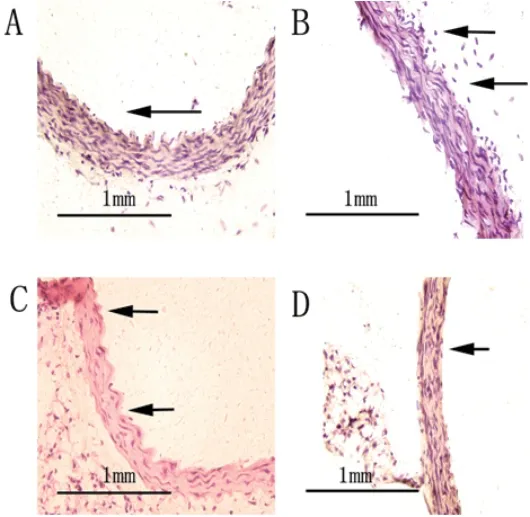
图4 冰冻切片油红O染色结果(400×)
2.5 RT-PCR和Western blot检测结果PT-PCR和Western blot结果显示: ApoE(-/-)AS模型组中FGF-2的mRNA相对表达量明显大于空白对照组(P<0.05)ApoE(-/-)阴性对照组中主动脉FGF-2的mRNA相对表达量与空白对照组比较统计学差异(P>0.05); shRNA-Piezo1干预组中主动脉FGF-2的mRNA相对表达量与ApoE(-/-) AS模型组比较具有统计学差异(P<0.05)。ApoE(-/-)AS模型组中VEGF的mRNA相对表达量明显大于空白对照组(P<0.05);ApoE(-/-)阴性对照组中主动脉VEGF的mRNA相对表达量与空白对照组比较无统计学差异(P>0.05);shRNA-Piezo1干预组中主动脉VEGF的mRNA相对表达量与 ApoE(-/-)AS模型组比较具有统计学差异(P<0.05)。ApoE(-/-)AS模型组中FGF-2和VEGF蛋白的表达量明显大于空白对照组(P<0.05);ApoE(-/-)阴性对照组中主动脉FGF-2和VEGF蛋白的表达量与空白对照组比较无统计学差异(P>0.05);shRNA-Piezo1干预组中主动脉FGF-2和VEGF蛋白的表达量与ApoE(-/-)AS模型组比较具有统计学差异(P<0.05)。
2.6 FGF-2,VEGF的免疫组织化学染色结果结果显示,ApoE(-/-)AS模型组中FGF-2和VEGF蛋白的棕色染色较空白对照组明显增加,shRNAPiezo1干预组中FGF-2和VEGF蛋白的棕色染色较空白对照组明显减少(图6~7)。
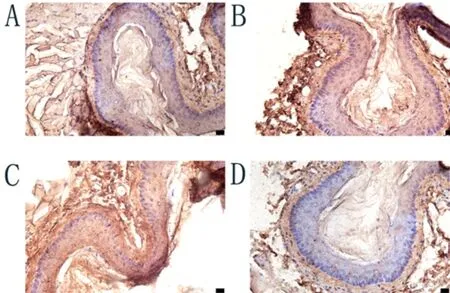
图6 FGF-2的免疫组织化学染色结果(DAB染色,400×)
3 讨论

图5 FGF-2和VEGF的mRNA相对表达量和蛋白灰度值
动脉粥样硬化(AS)是个逐渐变化的过程,始于内皮细胞的病变,然后伴随脂质沉积、炎症细胞浸润等密切相关[9,10]。AS的初始阶段是由血管内皮细胞的损伤所引起,在血管血流的刺激下,损伤内皮细胞释放各种激酶,例如丝裂原活化蛋白激酶,整合素家族分子,受体酪氨酸激酶以及G蛋白等,从而加剧AS的进展[11-13]。既往研究表明,血管血流剪切应力在AS的进展中具有明显的促进作用[14]。因此,寻找力学信号传导在AS进展中的作用具有重要意义。
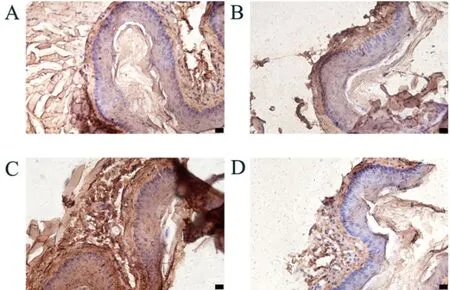
图7 VEGF的免疫组织化学染色结果(DAB染色,400×)
机械敏感性离子通道Piezo1蛋白可以广泛表达于真核细胞,比如软骨细胞,髓核细胞,膀胱上皮细胞以及血管内皮细胞等[15-17]。而且,Piezo1对于血管生长发育具有重要作用,将小鼠敲除Piezo1后,会引起胚胎的死亡,而且在血管发育中,Piezo1蛋白也具有重要作用,Piezo1蛋白的突变会引起红细胞的发育异常,与镰状细胞综合症的发生密切相关[18]。另外,在血液流体力学的刺激下,Piezo1蛋白参与血管的重构,且在血管内皮细胞中敲除Piezo1,会引起血管的发育异常[19]。与之前研究相同,我们发现在血管动脉粥样硬化的小鼠模型中,Piezo1蛋白的表达明显增加,为探究Piezo1蛋白在AS进展中的作用,通过siRNA的干扰载体构建原理,构建shRNA-Piezo1的干扰载体,沉默Piezo1蛋白的表达,结果说明,Piezo1蛋白的表达与动脉粥样硬化之间存在一定关系,表明研究shRNA-Piezo1对动脉粥样硬化的潜在治疗意义。
本研究利用慢病毒作为转染方法,以人胚肾293T细胞为靶细胞,筛选有效干扰序列,结果表明,shRNA-Piezo1-homo-5762组的mRNA水平要明显低于shRNA-Piezo1-homo-1875组和shRNA-Piezo1-3299组,比较具有统计学差异(P<0.05),说明,shRNA-Piezo1-homo-5762是有效的干扰序列。另外,shRNA相较于siRNA干扰载体,可以对Piezo1蛋白的表达持续抑制,通过腹腔注射AS小鼠模型的方法,探究shRNA-Piezo1对AS小鼠模型的作用。利用HE染色,油红染色和免疫组织化学染色方法检测shRNA-Piezo1对AS的保护作用,结果显示,shRNA-Piezo1能有效抑制AS,与ApoE(-/-)AS组相比,可明显抑制动脉中膜断裂和泡沫细胞浸润。说明shRNA-Piezo1对AS具有一定保护作用。
既往研究表明,生长因子血管内皮生长因子(VEGF)和成纤维细胞生长因子2(FGF-2)与AS密切相关,可促进血管的新生[20,21]。另外,在AS的进展过程中,VEGF首先集聚粥样斑块的基底部和中央位置,因为该处巨噬细胞较多[22]。而FGF-2与内皮细胞增殖密切相关。研究表明,血管内皮细胞受到损伤时,FGF-2表达量增多,促进内皮细胞的增殖,参与血管的重建,但由于无序的增生,导致血管构型的改变,从而进一步加重血管壁的狭窄,促进动脉中膜的断裂[23]。本研究推测Piezo1蛋白介导的流体力学信号可以通过生长因子VEGF和FGF-2的改变,促进AS的进展,利用RT-PCR,Western Blot和免疫组织化学染色等方法,检测VEGF和FGF-2的表达,结果显示相较于空白对照组,ApoE(-/-)AS组中VEGF和FGF-2的表达明显增加,而shRNA-Piezo1可明显抑制VEGF和FGF-2的表达。我们认为,VEGF和FGF-2可能作为机械敏感性离子通道蛋白Piezo1的下游信号因子存在,介导机械信号。而利用shRNA基因干扰技术沉默Piezo1的编码基因Piezo1后,可抑制VEGF和FGF-2的表达,从而抑制AS的进展。
综上所述,shRNA-Piezo1可通过抑制VEGF和FGF-2的表达,抑制AS进展,从而起到保护内皮细胞的作用。

