嵌合抗原受体-T细胞对弥漫大B细胞淋巴瘤患者Toll样受体4、核因子κB的影响研究
路晓辉,陈香莉
(1.焦作市人民医院,河南 焦作 454150;2.河南省人民医院,河南 郑州 450003)
临床研究结果显示,弥漫大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)属于最为常见的一种非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)。其基本特点为具有较强的侵袭性,且具有高度异质性病理特征[1]。目前条件下针对该类患者实施治疗主要采取化疗方式。据相关统计结果数据显示,40%左右的DLBCL 患者一般在接受化疗治疗后完全缓解,但仍有超过50%的患者对化疗无任何反应,特别是由于多药耐药(MDR)引起复发转移或者进展,从而使得预后状况不理想[2]。近年来,过继性免疫治疗已被成功地用于恶性血液疾病的临床治疗中,尤其是基于基因改造技术表达肿瘤特异性嵌合抗原受体(CAR)-T 细胞可对肿瘤抗原进行特异性地识别,不受主要组织相容性复合体(MHC)限制的限制,对DLBCL 具有十分理想的临床疗效[3]。本研究主要探讨了CAR-T 对DLBCL 患者Toll 样受体4(toll-like receptor 4,TLR4)及核因子κB(nuclear factor kappa B,NF-κB)的影响,现报道如下。
1 资料及方法
1.1 一般资料
选择2017 年7 月至2020 年7 月焦作市人民医院收治的14 例DLBCL 患者作为研究对象,均给予CAR-T 治疗(观察组)。另外选择同期接受常规化疗治疗的14 例DLBCL 患者作为对照组。入选标准:①均为初诊患者,且此前未接受任何放疗或者化疗治疗;②患者组织标本均经手术或切除活检获取;③均经患者知情同意,且自愿签署知情同意书,并对组织标本用于实验研究工作了解;④均经WHO 制定的相关标准[4],且均经医院病理学诊断为DLBCL;⑤资料完整。排除标准:①中途退出者;②过敏体质者;③具有精神疾病史者;④合并其他恶性肿瘤者;⑤对本研究用药过敏者。两组患者基础资料比较差异无统计学意义(P>0.05),具有可比性。见表1。
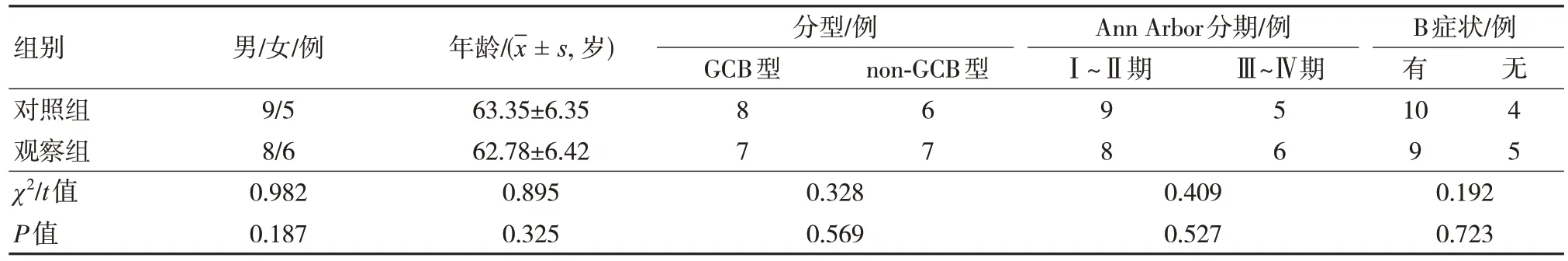
表1 两组患者基础资料比较(n=14)
1.2 研究方法
对照组采用常规化疗方案进行治疗,具体方法为:环磷酰胺(CTX)2~3 g/m2+依托泊苷(VP16)200 mg/m2,第1 天,粒细胞集落刺激因子(G-CSF)10 μg/(kg·d)第5 天开始,对外周血进行监测分析,CD34+细胞>20 个/μL 时加以采集。
观察组采用CAR-T 进行治疗。预处理方法:在CAR-T 细胞回输前的一两周,对患者进行预处理;预处理方案为:250 mg/(m2·d)CTX,第1 天至第3 天;25 mg/(m2·d)的氟达拉滨,第1 天至第3 天。CAR-T 细胞制备方法:①患者T细胞采集,使用血细胞分离机淋巴细胞采集流程,采集100 mL 的血细胞,经体外分离、纯化T 细胞;②体外制备CAR-T 细胞,经①中的方法采集所得的淋巴细胞,于细胞实验室中制备CAR-T 细胞,其具体的制备方法、制备过程、细胞数量以及质量控制等均由该实验室掌握。
1.3 观察指标
1.3.1 外周血TLR4 表达量检测方法 采用聚蔗糖密度梯度方法将外周血单个核细胞(peripheral blood mononuclear cell,PBMC)进行提取。细胞总RNA 采用Trizol 法进行提取,然后逆转录为cDNA。以此作为模板,开展PCR 扩增反应。TLR4 引物均购自于上海生工生物有限公司。引物上游:5'-TACGCTAGCGACTAGCTACT-3',下游:5'-GCGTACGTACGCTAGCGCAT-3'。扩增条件为:95℃下扩增5 min,95℃下扩增0.5 min,55℃下扩增0.5 min,72℃下扩增0.5 min,上述过程共计40 个循环。目的基因相对含量计算:RQ=2-ΔΔCt。
1.3.2 血NF-κB 的检测方法 取患者治疗前后清晨空腹状态下肘静脉血2.0 mL,应用乙二胺四乙酸(EDTA)进行抗凝处理,采用淋巴细胞分离液将单核细胞予以分离;细胞核蛋白与浆蛋白抽提试剂盒,将胞浆蛋白与胞核蛋白予以提取,所有标本均于6 h 之内完成蛋白抽提,并将其置于-80℃温度条件下保存。NF-κB 采用酶联免疫吸附法(ELISA 法)进行检测,全部操作均严格根据试剂盒上的说明书实施。
1.3.3 检测细胞增值 比较二代与三代CD19 CAR-T 细胞体外增殖能力:取传代CD19 CAR-T细胞,加入培养液和MTT 培养液,放置在培养箱中进行孵育,孵育细胞后弃掉细胞的培养液后,加入二甲基亚砜(DMSO)的原液,震荡10 min,等待所有的结晶全部得到溶液后,用酶标仪测量490 nm 处的波长,并对其OD 值进行计算。
1.3.4 疗效判定 完全缓解(CR):DLBCL 病变完全消失,并且保持1 个月以上;部分缓解(PR):DLBCL 肿瘤病灶经治疗后最大垂直直径乘积缩小超过50%,并且保持≥4 周;病情稳定(SD):DLBCL 肿瘤病灶经治疗后最大垂直直径乘积明显缩小<25%,或乘积明显增大<25%;疾病进展(PD):DLBCL 肿瘤病灶经治疗后最大垂直直径乘积明显增大>25%,或患者产生新的病变。总有效率为CR 与PR 之和。比较T 淋巴细胞亚群(CD3+、CD4+、CD4+/CD8+)的水平。
1.3.5 T 淋巴细胞亚群 统计两组患者治疗前后T淋巴细胞亚群(CD3+、CD4+、CD4+/CD8+)的水平变化。
1.4 统计学方法
采用SPSS 22.0 软件对数据进行统计分析。计量资料以均数±标准差()表示,组间比较采用t检验;计数资料以百分率(%)表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 二代与三代CD19 CAR-T 细胞体外增殖能力比较
三代细胞在各培养时间点(0 h、24 h、48 h)细胞体外增殖能力均显著大于二代细胞,差异有统计学意义(P<0.05)。见表2。
表2 二代与三代CD19 CAR-T 细胞体外增殖能力比较(n=14,,%)
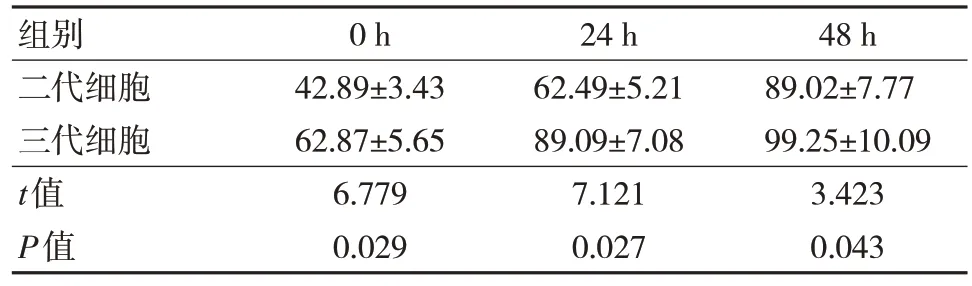
表2 二代与三代CD19 CAR-T 细胞体外增殖能力比较(n=14,,%)
2.2 两组患者治疗后临床疗效比较
观察组患治疗后,CR+PR 有效率明显高于对照组,差异有统计学意义(χ2=4.094,P=0.043)。见表3。

表3 两组患者治疗疗效比较(n=14)
2.3 两组治疗前后CD19+细胞百分率比较
对照组治疗后3 d 及7 d CD19+细胞百分率均大于治疗前,差异有统计学意义(P<0.05),观察组治疗后CD19+细胞百分率均小于治疗前,差异有统计学意义(P<0.05),且观察组治疗后3 d 及7 d CD19+细胞百分率均小于对照组,差异有统计学意义(P<0.05)。见表4。
表4 两组治疗前后CD19+细胞百分率比较(n=14,,%)

表4 两组治疗前后CD19+细胞百分率比较(n=14,,%)
2.4 两组患者治疗前后TLR4 与NF-κB 水平的变化情况比较
观察组治疗后3 d 及治疗后7 d TLR4 与NF-κB 水平较治疗前均显著下降,差异有统计学意义(P<0.05),且观察组治疗后上述指标水平均小于对照组治疗后,差异有统计学意义(P<0.05)。见表5。
表5 两组患者治疗前后TLR4 与NF-κB 水平的变化情况比较(n=14,)
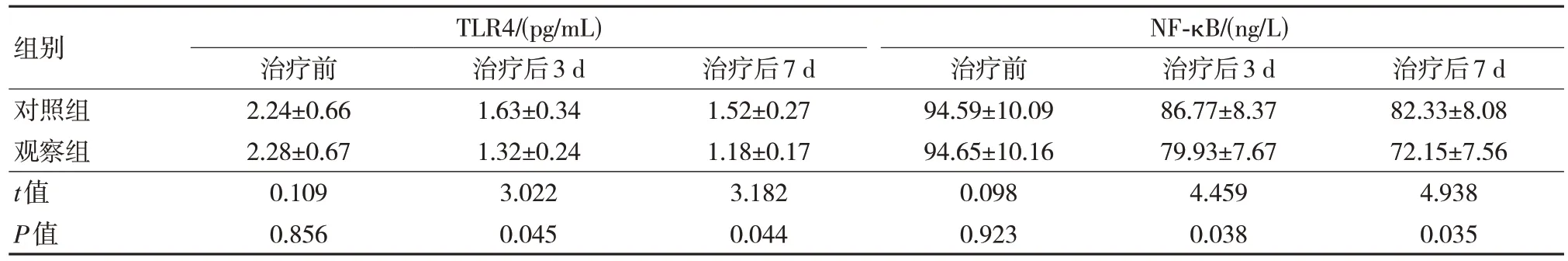
表5 两组患者治疗前后TLR4 与NF-κB 水平的变化情况比较(n=14,)
2.5 两组患者免疫功能指标比较
治疗后,观察组的CD3+、CD4+、CD4+/CD8+水平均高于对照组,差异有统计学意义(P<0.05)。见表6。
表6 两组患者免疫功能指标比较(n=14,)
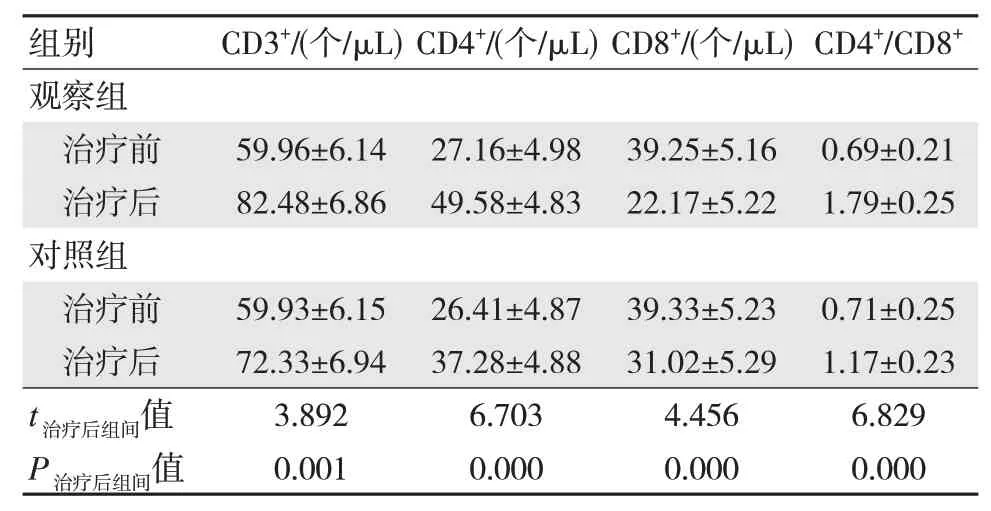
表6 两组患者免疫功能指标比较(n=14,)
3 讨论
DLBCL 属于一种大B 淋巴细胞弥散性恶性增生性疾病,其异质性非常强[5]。DLBCL 为侵袭性淋巴瘤,发病初期不易被发现,且病情发展非常快,患者一旦发病,其淋巴结会迅速肿大,常合并淋巴结外疾病及骨髓侵犯等,一旦确诊已为晚期,死亡率高。相关研究结果显示:TLR 可通过从病毒与各自内源性分子中辨识出不同的病原相关分子模式,多表达于单核细胞、巨噬细胞及树突细胞等固有免疫系统细胞表面[6]。有文献报道称:TLR4 作为TLR 家族中的常见成员,不仅能够广泛地在自然杀伤细胞等免疫原性细胞表达,也在宫颈癌等恶性肿瘤细胞广泛表达[7]。YANG等[8]研究发现:TLR-4 可高表达于乳腺癌细胞之中。NF-κB 蛋白因子通过与核内增强子κB 部位之间特异性结合,以加速相关蛋白转录进程,在体液免疫与肿瘤发病进程中扮演着十分重要的角色。还有研究发现:TLR-4 可高表达于多种淋巴瘤细胞之中[9],然而该因子具体作用机理尚未完全明晰。NF-κB 作为TLR-4 的一种十分常见的下游分子,可高表达于淋巴瘤、肺癌以及乳腺癌细胞之中。
近些年来,随着特异性识别B 细胞表面CD19的CAR-T 的研究及其在B 淋巴细胞血液恶性肿瘤临床治疗之中的广泛应用,此类疾病患者死亡率大大降低,生存率及治愈率进一步提升。本研究结果显示:治疗后观察组患者TLR4 与NF-κB 水平较治疗前显著降低(P<0.05)。此结果提示:CAR-T 疗法对DLBCL 的临床治疗疗效可能通过降低患者机体TLR4 与NF-κB 水平而得以实现。
周伟等[10]研究表明,免疫功能和DLBCL 病情发展息息相关,而T 淋巴细胞亚群体内表达含量过低则会导致抑制或杀灭癌细胞失败,进而导致患者预后不良。本研究治疗后,观察组的CD3+、CD4+、CD4+/CD8+水平均高于对照组(P<0.05),这表明CAR-T 细胞方案治疗DLBCL 患者能显著提升其T 淋巴细胞亚群水平。CAR-T 细胞方案有效治疗需T细胞与DLBCL 病灶细胞直接接触,而实体瘤中细胞浸润于正常细胞、肌纤维间,CAR-T 细胞方案难以进入内部。本研究采用第3代CAR-T细胞方案,其包含CD28 及4-1BB 两共刺激信号域,具有较高的体内增殖及存活能力,但仍有部分患者采用CAR-T 细胞方案治疗无效,可推测由于CAR-T 细胞很难在机体大量扩增、细胞功能缺陷,进而导致治疗失败。CAR-T 细胞方案联合检查点抑制剂能够明显提高治疗疗效。今后,笔者将监测CAR-T 细胞方案在体内存活增殖情况,以进一步提高、改进CAR-T 细胞工艺、以求在其他治疗方面获得更好疗效。
综上所述,CAR-T 治疗DLBCL 短期临床疗效较为显著,可有效降低患者机体TLR4 与NF-κB 水平。

